ඔක්සිකාරක ආතතිය
Back Clinic Oxidative Stress Chiropractic and Functional Medicine Team. ඔක්සිකාරක ආතතිය යනු ප්රතික්රියාශීලී ඔක්සිජන් නිෂ්පාදනය (නිදහස් රැඩිකලුන්) සහ ප්රතිඔක්සිකාරක ආරක්ෂණ අතර සමතුලිතතාවයේ බාධාවක් ලෙස අර්ථ දැක්වේ. වෙනත් වචන වලින් කිවහොත්, එය නිදහස් රැඩිකලුන් නිෂ්පාදනය සහ ප්රතිඔක්සිකාරක මගින් උදාසීන කිරීම හරහා හානිකර බලපෑම් වලට ප්රතිවිරෝධී හෝ විෂ ඉවත් කිරීමට ශරීරයට ඇති හැකියාව අතර අසමතුලිතතාවයකි. ඔක්සිකාරක ආතතිය ශරීරයේ බොහෝ ව්යාධිජනක තත්වයන් ඇති කරයි. මේවාට ස්නායු විකෘතිතා රෝග, එනම් පාකින්සන් රෝගය, ඇල්සයිමර් රෝගය, ජාන විකෘති, පිළිකා, නිදන්ගත තෙහෙට්ටුව සින්ඩ්රෝමය, බිඳෙනසුලු X සින්ඩ්රෝමය, හෘද හා රුධිර නාල ආබාධ, ධමනි සිහින් වීම, හෘදයාබාධ, හෘදයාබාධ සහ ගිනි අවුලුවන රෝග ඇතුළත් වේ. ඔක්සිකරණය අවස්ථා කිහිපයක් යටතේ සිදු වේ:
සෛල ශක්තිය නිපදවීමට ග්ලූකෝස් භාවිතා කරයි
ප්රතිශක්තිකරණ පද්ධතිය බැක්ටීරියා වලට එරෙහිව සටන් කර දැවිල්ල ඇති කරයි
සිරුරු දූෂක, පළිබෝධනාශක සහ සිගරට් දුම විස නැති කරයි
ඔක්සිකරණයට හේතු විය හැකි ක්රියාවලීන් මිලියන ගණනක් අපගේ ශරීරයේ ඕනෑම වේලාවක සිදු වේ. මෙන්න රෝග ලක්ෂණ කිහිපයක්:
ආකෘතිය
මතකය නැතිවීම සහ හෝ මොළයේ මීදුම
මාංශ පේශි සහ හෝ සන්ධි වේදනාව
අළු හිසකෙස් සමග රැලි
ඇස් පෙනීම අඩු වීම
හිසරදය සහ ශබ්දයට සංවේදීතාව
ආසාදන වලට ගොදුරු වීමේ හැකියාව
කාබනික ආහාර තෝරා ගැනීම සහ ඔබේ පරිසරයේ විෂ ද්රව්ය වළක්වා ගැනීම විශාල වෙනසක් ඇති කරයි. මෙය, ආතතිය අඩු කිරීම සමඟ, ඔක්සිකරණය අඩු කිරීම සඳහා ප්රයෝජනවත් විය හැක.
by ආචාර්ය ඇලෙක්ස් ජිමිනෙස් | නිදන්ගත වේදනාව, විෂාදිය, ක්රියාකාරී වෛද්ය විද්යාව, සෞඛ්යය, බෙහෙත් වෛද්ය විද්යාව, ස්වභාවික සෞඛ්යය, පෝෂණ, ඔක්සිකාරක ආතතිය, පිළියම්, පර්යේෂණ අධ්යයන, අතිරේක, ප්රතිකාර, සුවතාව
සෛල බෙදීම, දැවිල්ල, ප්රතිශක්තිකරණ ක්රියාකාරිත්වය, ස්වයංක්රීයකරණය සහ ආතති ප්රතිචාරය ඇතුළුව මිනිස් සිරුරේ අත්යවශ්ය ක්රියාවලීන් නියාමනය කිරීම සඳහා ඔක්සිකාරක සාමාන්යයෙන් පාලිත ආකාරයකින් නිපදවනු ලැබේ. කෙසේ වෙතත්, මෙම ඔක්සිකාරකවල පාලනයකින් තොරව නිෂ්පාදනයට දායක විය හැක ඔක්සිකාරක ආතතිය, සෛලීය ක්රියාකාරිත්වයට බලපෑම් ඇති කළ හැකි අතර, විෂ වීම, නිදන්ගත රෝග සහ පිළිකා වර්ධනය වීමට හේතු වේ. මිනිස් සිරුරේ ආරක්ෂිත ප්රතිඔක්සිකාරක යාන්ත්රණය නියාමනය කරනු ලබන්නේ ඔක්සිකාරක වලට සෛලයේ ප්රතිචාරය පාලනය කරන වැදගත් මාර්ග මාලාවක් මගිනි. න්යෂ්ටික සාධකය එරිත්රොයිඩ් 2 ආශ්රිත සාධකය, වෙනත් ආකාරයකින් Nrf2 ලෙස හැඳින්වේ, ඔක්සිකාරක වලට සෛලීය ප්රතිරෝධයේ නැගී එන නියාමකයකි. පහත ලිපියේ අරමුණ වන්නේ මයිටොකොන්ඩ්රිය ශ්රිතයේ Nrf2 හි මතුවන භූමිකාව සාකච්ඡා කිරීම සහ නිරූපණය කිරීමයි.
වියුක්ත
පිටපත් කිරීමේ සාධකය NF-E2 p45-ආශ්රිත සාධකය 2 (Nrf2; ජාන නාමය NFE2L2) ප්රතිඔක්සිකාරක, ප්රති-ගිනි අවුලුවන සහ ඩෙටොක්සිකරණ එන්සයිම ද ඇතුළුව විවිධ සයිටොප්රොටෙක්ටිව් ප්රෝටීන වල ජාන ප්රකාශනය නියාමනය කිරීමෙන් ආතතියේ තත්වයන් යටතේ අනුවර්තනය වීමට සහ පැවැත්මට ඉඩ සලසයි. හානියට පත් සාර්ව අණු අළුත්වැඩියා කිරීමට හෝ ඉවත් කිරීමට සහාය වන ප්රෝටීන ලෙස. Glutathione, thioredoxin සහ NADPH වල ජෛව සංස්ලේෂණය, භාවිතය සහ පුනර්ජනනය නියාමනය කිරීම සහ මයිටොකොන්ඩ්රියා සහ NADPH ඔක්සිඩේස් මගින් ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ නිෂ්පාදනය පාලනය කිරීම මගින් සෛලීය රෙඩොක්ස් හෝමියස්ටැසිස් නඩත්තු කිරීමේදී Nrf2 තීරණාත්මක කාර්යභාරයක් ඉටු කරයි. හෝමියස්ථිතික තත්වයන් යටතේ, Nrf2 මයිටොකොන්ඩ්රියල් පටල විභවය, මේද අම්ල ඔක්සිකරණය, ශ්වසනය සඳහා උපස්ථර (NADH සහ FADH2/succinate) ලබා ගැනීම සහ ATP සංස්ලේෂණය කෙරෙහි බලපායි. ආතතිය හෝ වර්ධක සාධක උත්තේජනයේ තත්වයන් යටතේ, Nrf2 සක්රීය කිරීම මයිටොකොන්ඩ්රියාවේ වැඩිවන ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ නිෂ්පාදනයට ප්රතික්රියා කරයි, විසන්ධි කරන ප්රෝටීන් 3 පිටපත් කිරීම මගින් මයිටොකොන්ඩ්රිය ජෛව උත්පාදනයට බලපෑම් කරයි න්යෂ්ටික ශ්වසන සාධකය 1 සහ පෙරොක්සිසෝම් ප්රගුණක-සක්රීය ප්රතිග්රාහක මට්ටම් පවත්වා ගෙන යාම. coactivator 1?, මෙන්ම purine nucleotide biosynthesis ප්රවර්ධනය කිරීම මගින්. ඖෂධීය Nrf2 සක්රියකාරක, ස්වභාවිකව ඇති වන isothiocyanate sulforaphane වැනි, මයිටොකොන්ඩ්රියල් පාරගම්ය සංක්රාන්ති සිදුරු සහ මයිටොකොන්ඩ්රියල් ඉදිමීම ඔක්සිකාරක-මැදිහත් වීම වළක්වයි. කුතුහලයට කරුණක් නම්, මුලින් Nrf1,4 සක්රියකාරකයක් ලෙස නිර්මාණය කරන ලද කෘතිම 1,2,3-ඩයිෆෙනයිල්-2-ට්රයිසෝල් සංයෝගයක්, මයිටොෆාගි ප්රවර්ධනය කිරීම සඳහා සොයා ගන්නා ලද අතර එමඟින් සමස්ත මයිටොකොන්ඩ්රියල් හෝමියස්ටැසිස් වලට දායක වේ. මේ අනුව, Nrf2 මයිටොකොන්ඩ්රියාවේ ව්යුහාත්මක සහ ක්රියාකාරී අඛණ්ඩතාවයට සහය දැක්වීමේ ප්රමුඛ ක්රීඩකයෙකු වන අතර, ආතතියේ තත්වයන් යටතේ මෙම භූමිකාව විශේෂයෙන් තීරණාත්මක වේ.
ප්රධාන වචන: Bioenergetics, Cytoprotection, Keap1, Mitochondria, Nrf2, Free radicals
විශේෂාංග
- සෛලීය රෙඩොක්ස් හෝමියස්ටැසිස් නඩත්තු කිරීමේදී Nrf2 තීරණාත්මක කාර්යභාරයක් ඉටු කරයි.
- Nrf2 මයිටකොන්ඩ්රියල් පටල විභවය සහ ATP සංශ්ලේෂණයට බලපායි.
- Nrf2 මයිටොකොන්ඩ්රියල් මේද අම්ල ඔක්සිකරණයට බලපෑම් කරයි.
- Nrf2 මයිටොකොන්ඩ්රියාවේ ව්යුහාත්මක සහ ක්රියාකාරී අඛණ්ඩතාවයට සහය දක්වයි.
- මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වය අඩපණ වූ විට Nrf2 සක්රියකාරක හිතකර බලපෑම් ඇති කරයි.
හැදින්වීම
පිටපත් කිරීමේ සාධකය NF-E2 p45-අදාළ සාධකය 2 (Nrf2; ජාන නාමය NFE2L2) විවිධ සයිටොප්රොටෙක්ටිව් ක්රියාකාරකම් සහිත ප්රෝටීන කේතනය කරන ජාන ජාලවල ප්රකාශනය නියාමනය කරයි. Nrf2 මූලික වශයෙන් ප්රෝටීන් ස්ථායීතාවයේ මට්ටමින් පාලනය වේ. පාදක තත්ත්වයන් යටතේ, Nrf2 යනු කෙටි කාලීන ප්රෝටීනයක් වන අතර එය අඛණ්ඩ සර්වජනනයට සහ ප්රෝටීසෝම පරිහානියට ලක් වේ. Nrf2 පිරිහීමට දායක වන දන්නා ubiquitin ligase පද්ධති තුනක් ඇත. ඓතිහාසික වශයෙන්, Nrf2 හි පළමු සෘණ නියාමකය සොයාගනු ලැබුවේ Kelch-like ECH-ආශ්රිත ප්රෝටීන් 1 (Keap1) [1], Cullin 3 (Cul3)/Rbx1 ubiquitin ligase [2], [3], [ 4]. Keap1 විසින් Nrf2 සර්වප්රකාරව හා ප්රෝටීසෝම පරිහානිය සඳහා ඉලක්ක කිරීමට ඉතා කාර්යක්ෂම චක්රීය යාන්ත්රණයක් භාවිතා කරයි, එම කාලය තුළ Keap1 අඛණ්ඩව ප්රතිජනනය වන අතර එමඟින් චක්රය ඉදිරියට යාමට ඉඩ සලසයි (රූපය 1A) [5]. Glycogen synthase kinase (GSK)2/?-TrCP මත යැපෙන Cul3 මත පදනම් වූ ubiquitin ligase [1], [6] මගින් මැදිහත් වීමෙන් Nrf7 පිරිහීමට ලක් වේ. ඉතා මෑතක දී, එන්ඩොප්ලාස්මික් රෙටිකුලම් ආතති තත්වයන් තුළ, E2 ubiquitin ligase Hrd3 [1] මගින් මැදිහත් වන ක්රියාවලියකදී Nrf8 සර්වප්රකාරව හා හායනය වන බව වාර්තා විය.
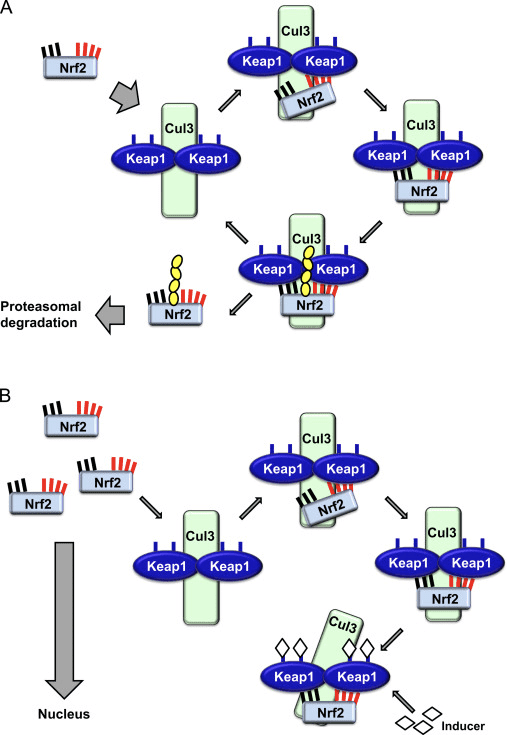 රූපය 1 Nrf1 හි Keap2-මධ්යගත පිරිහීම සඳහා චක්රීය අනුක්රමික බන්ධන සහ ප්රතිජනන ආකෘතිය. (A) Nrf2 නිදහස් Keap1 dimer එකකට අනුක්රමිකව බන්ධනය කරයි: පළමුව එහි ඉහළ-සම්බන්ධතා ETGE (රතු කූරු) බන්ධන වසම හරහා සහ පසුව එහි අඩු-සම්බන්ධතා DLG (කළු කූරු) බන්ධන වසම හරහා. ප්රෝටීන් සංකීර්ණයේ මෙම අනුකූලතාවයේ දී, Nrf2 සර්ව ව්යාප්තියට භාජනය වන අතර ප්රෝටේසෝම පරිහානිය සඳහා ඉලක්ක කර ඇත. නිදහස් Keap1 නැවත උත්පාදනය කර අලුතින් පරිවර්තනය කරන ලද Nrf2 වෙත බැඳීමට හැකි වන අතර, චක්රය නැවත ආරම්භ වේ.(B) Inducers (සුදු දියමන්ති) Keap1 හි සංවේදක cysteines (නිල් කූරු) සමඟ ප්රතික්රියා කරයි, එය අනුරූපී වෙනසක් සහ දුර්වල වූ උපස්ථර ඇඩැප්ටර ක්රියාකාරිත්වයට මග පාදයි. නිදහස් Keap1 නැවත උත්පාදනය නොවන අතර, අලුතින් සංස්ලේෂණය කරන ලද Nrf2 සමුච්චය වී න්යෂ්ටිය වෙත මාරු වේ.
රූපය 1 Nrf1 හි Keap2-මධ්යගත පිරිහීම සඳහා චක්රීය අනුක්රමික බන්ධන සහ ප්රතිජනන ආකෘතිය. (A) Nrf2 නිදහස් Keap1 dimer එකකට අනුක්රමිකව බන්ධනය කරයි: පළමුව එහි ඉහළ-සම්බන්ධතා ETGE (රතු කූරු) බන්ධන වසම හරහා සහ පසුව එහි අඩු-සම්බන්ධතා DLG (කළු කූරු) බන්ධන වසම හරහා. ප්රෝටීන් සංකීර්ණයේ මෙම අනුකූලතාවයේ දී, Nrf2 සර්ව ව්යාප්තියට භාජනය වන අතර ප්රෝටේසෝම පරිහානිය සඳහා ඉලක්ක කර ඇත. නිදහස් Keap1 නැවත උත්පාදනය කර අලුතින් පරිවර්තනය කරන ලද Nrf2 වෙත බැඳීමට හැකි වන අතර, චක්රය නැවත ආරම්භ වේ.(B) Inducers (සුදු දියමන්ති) Keap1 හි සංවේදක cysteines (නිල් කූරු) සමඟ ප්රතික්රියා කරයි, එය අනුරූපී වෙනසක් සහ දුර්වල වූ උපස්ථර ඇඩැප්ටර ක්රියාකාරිත්වයට මග පාදයි. නිදහස් Keap1 නැවත උත්පාදනය නොවන අතර, අලුතින් සංස්ලේෂණය කරන ලද Nrf2 සමුච්චය වී න්යෂ්ටිය වෙත මාරු වේ.
ubiquitin ligase උපස්ථර ඇඩැප්ටර ප්රෝටීනයක් ලෙස ක්රියා කිරීමට අමතරව, Keap1 යනු Nrf2 (ප්රේරක ලෙස හඳුන්වන) [9] හි කුඩා අණු සක්රියකාරක පුළුල් පරාසයක සංවේදකය වේ. Inducers Keap1 [2], [1] තුළ ඇති විශේෂිත cysteine අපද්රව්ය රසායනිකව වෙනස් කිරීමෙන් හෝ Keap10:Nrf11 බන්ධන අතුරුමුහුණත [1], [2] සෘජුවම කඩාකප්පල් කිරීමෙන් Nrf12 හි Keap13-මධ්යගත පිරිහීමේ චක්රය අවහිර කරයි. එහි ප්රතිඵලයක් ලෙස, Nrf2 ක්ෂය නොවන අතර, පිටපත් කිරීමේ සාධකය සමුච්චය වී න්යෂ්ටිය වෙත පරිවර්තනය වේ (රූපය 1B), එහිදී එය කුඩා Maf ප්රෝටීනයක් සහිත විෂම විෂමයක් සාදයි; ප්රතිඔක්සිකාරක-ප්රතිචාර මූලද්රව්ය, එහි ඉලක්කගත ජානවල උඩුගං නියාමන කලාපවලට බන්ධනය කරයි; සහ පිටපත් කිරීම [14], [15], [16] ආරම්භ කරයි. Nrf2 ඉලක්ක වල බැටරිය xenobiotic පරිවෘත්තීය එන්සයිම, ප්රතිඔක්සිකාරක සහ ප්රති-ගිනි අවුලුවන ක්රියාකාරකම් සහිත ප්රෝටීන සහ ප්රෝටීසෝම අනු ඒකක මෙන්ම සෛලීය රෙඩොක්ස් හෝමියස්ටැසිස් නියාමනය කරන සහ අතරමැදි පරිවෘත්තීය ක්රියාවලියට සහභාගී වන ප්රෝටීන ඇතුළු විවිධ සයිටොප්රොටෙක්ටිව් ක්රියාකාරකම් සහිත ප්රෝටීන වලින් සමන්විත වේ.
Nrf2: Cellular Redox Homeostasis හි ප්රධාන නියාමකයෙකි
සෛලීය රෙඩොක්ස් හෝමියස්ටැසිස් හි ප්රධාන නියාමකයෙකු ලෙස Nrf2 හි ක්රියාකාරිත්වය පුළුල් ලෙස හඳුනාගෙන ඇත. ?-glutamyl cysteine ligase හි උත්ප්රේරක සහ නියාමන අනු ඒකක දෙකෙහිම ජාන ප්රකාශනය, අඩු කරන ලද glutathione (GSH) හි ජෛව සංස්ලේෂණයේ අනුපාත සීමා කිරීමේ පියවර උත්ප්රේරණය කරන එන්සයිමය Nrf2 [17] මගින් සෘජුවම නියාමනය කරනු ලැබේ. සෛල තුළට සිස්ටීන් ආනයනය කරන xc- පද්ධතියේ xCT අනු ඒකකය, Nrf2 [18] හි සෘජු පිටපත් කිරීමේ ඉලක්කයකි. සෛලය තුළ, සිස්ටීන් GSH හි ජෛව සංස්ලේෂණය සඳහා පූර්වගාමියා වන සිස්ටීන් බවට පරිවර්තනය වේ. GSH ජෛව සංස්ලේෂණය තුළ එහි කාර්යභාරයට අමතරව, Nrf2 ග්ලූටතයෝන් නිශ්පාදන 1 [19], [20] සම්බන්ධීකරණය කරන ලද පිටපත් කිරීමේ නියාමනය මගින් එහි අඩු තත්වයේ ග්ලූටතයෝන් නඩත්තු කිරීම සඳහා මාධ්යයන් සපයයි, එමඟින් NADPH වලින් සමාන ද්රව්ය අඩු කිරීමෙන් GSH දක්වා ඔක්සිකරණය වූ ග්ලූටතයෝන් අඩු කරයි. . අවශ්ය NADPH ප්රධාන NADPH ජනනය කරන එන්සයිම හතරක් මගින් සපයනු ලැබේ, malic enzyme 1 (ME1), isocitrate dehydrogenase 1 (IDH1), glucose-6-phosphate dehydrogenase (G6PD) සහ 6-phosphogluconate dehydrogenase (PGD), මේ සියල්ල Nrf2 (පය. 2) [21], [22], [23], [24] මගින් කොටස් වශයෙන් පිටපත් කිරීම නියාමනය කර ඇත. කුතුහලයට කරුණක් නම්, Nrf2 විසින් NAD(P)+ සහකාරකයක් ලෙස භාවිතා කරන ඇල්ඩිහයිඩ් ඩිහයිඩ්රොජිනේස් [25] හි සයිටොසොලික්, මයික්රොසෝමල් සහ මයිටොකොන්ඩ්රියල් ආකාරවල ප්රේරක ජාන ප්රකාශනය නියාමනය කරයි, NAD(P)H හටගනී. ඇත්ත වශයෙන්ම, Nrf2-knockout (Nrf2-KO) මීයන්ගෙන් හුදකලා වූ කලල ෆයිබ්රොබ්ලාස්ට් වල NADPH මට්ටම් සහ NADPH/NADP+ අනුපාතය අඩු වන අතර, ඔවුන්ගේ වල්-වර්ගයේ (WT) සගයන්ගේ සෛල හා සසඳන විට NADPH මට්ටම් Nrf2 knockdown මත අඩු වේ. ව්යවස්ථාපිතව ක්රියාකාරී Nrf2 සහිත පිළිකා සෛල රේඛා [26]. අපේක්ෂා කළ පරිදි, Nrf2 කඩාකප්පල් වී ඇති සෛලවල GSH මට්ටම අඩුය; ප්රතිලෝමව, ජානමය හෝ ඖෂධීය ක්රම මගින් Nrf2 සක්රීය කිරීම GSH ඉහළ නැංවීමට මඟ පාදයි [27], [28], [29]. වැදගත් ලෙස, Nrf2 අත්යවශ්ය වන තයෝරෙඩොක්සින් [30], [31], [32], තයෝරෙඩොක්සින් රිඩක්ටේස් 1 [28], [29], [32], [33] සහ සල්ෆිරෙඩොක්සින් [34] වල ජාන ප්රකාශනය ද නියාමනය කරයි. ඔක්සිකරණය වූ ප්රෝටීන් තයෝල් අඩු කිරීම සඳහා.
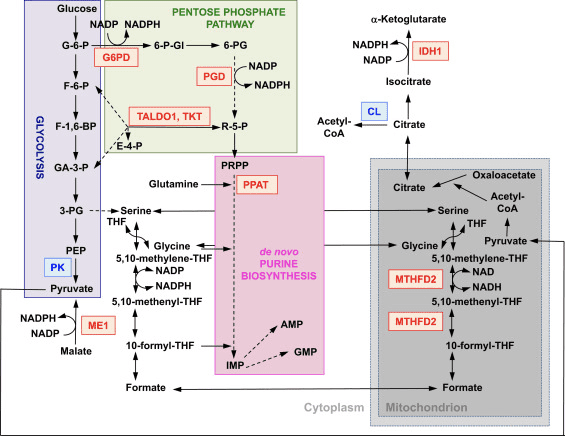 රූපය 2 වේගයෙන් පැතිරෙන සෛලවල පරිවෘත්තීය ක්රියාවලියේදී Nrf2 හි කාර්යභාරය. Nrf2 යනු ඔක්සිකාරක හස්තයේ [එනම්, ග්ලූකෝස්-6-පොස්පේට් ඩිහයිඩ්රොජිනේස් (G6PD) සහ 6-ෆොස්පොග්ලුකොනේට් ඩිහයිඩ්රොජිනේස් (PGD)] සහ ඔක්සිකාරක නොවන හස්තයේ [එනම්, ට්රාන්ස්ඇල්ඩොලේස් 1 (TALDO1) සහ ට්රාන්ස්කෙටෝලේස් යන දෙකෙහිම ජාන කේතන එන්සයිමවල ධනාත්මක නියාමකයෙකි. TKT)] පෙන්ටෝස් පොස්පේට් මාර්ගයේ. G6PD සහ PGD NADPH ජනනය කරයි. Nrf2 අනෙක් NADPH උත්පාදක එන්සයිම දෙක වන malic එන්සයිම 1 (ME1) සහ isocitrate dehydrogenase 1 (IDH1) වල ජාන ප්රකාශනය නියාමනය කරයි. de novo purine biosynthetic මාර්ගයට ඇතුල්වීම උත්ප්රේරක කරන phosphoribosyl pyrophosphate amidotransferase (PPAT) හි ජාන ප්රකාශනය ද Nrf2 මගින් ධනාත්මකව නියාමනය කරනු ලැබේ, මෙතිලීන්ටෙට්රාහයිඩ්රොෆොලේට් ඩිහයිඩ්රොජිනේස් 2 (MTHFD2) තීරනාත්මක භූමිකාවේ ප්රකාශනය මෙන්ම එන්සයිමෙටොක්ඩොන්ඩ්රි. de novo purine biosynthesis සඳහා එක් කාබන් ඒකක සැපයීම. Pyruvate kinase (PK) Nrf2 මගින් සෘණාත්මකව නියාමනය කරනු ලබන අතර ග්ලයිකොලයිටික් අතරමැදි ගොඩනැගීමට සහ G6PD සමඟ එක්ව පෙන්ටෝස් පොස්පේට් මාර්ගය හරහා පරිවෘත්තීය නාලිකා සහ න්යෂ්ටික අම්ල, ඇමයිනෝ අම්ල සහ ෆොස්ෆොලිපිඩ් සංශ්ලේෂණයට අනුග්රහය දැක්වීමට අපේක්ෂා කෙරේ. Nrf2 ATP-citrate lyase (CL) හි ජාන ප්රකාශනය සෘණාත්මකව නියාමනය කරයි, එමඟින් මයිටොකොන්ඩ්රියල් භාවිතය සඳහා සයිටේ්රට් ලබා ගැනීමේ හැකියාව හෝ IDH1 සඳහා (isocitrate හරහා) වැඩි කළ හැක. රතු සහ නිල් පිළිවෙළින් ධනාත්මක සහ සෘණ නියාමනය පෙන්නුම් කරයි. මයිටොකොන්ඩ්රියන් අළු පැහැයෙන් දැක්වේ. පරිවෘත්තීය කෙටි යෙදුම්: G-6-P, ග්ලූකෝස් 6-පොස්පේට්; F-6-P, ෆෲක්ටෝස් 6-පොස්පේට්; F-1,6-BP, ෆෲක්ටෝස් 1,6-බිස්පොස්පේට්; GA-3-P, glyceraldehyde 3-ෆොස්ෆේට්; 3-PG, 3-ෆොස්ෆොග්ලිසරේට්; PEP, ෆොස්ෆොඑනොල්පිරුවාට්; 6-P-Gl, 6-ෆොස්ෆොග්ලුකොනොලැක්ටෝන්; 6-PG, 6-ෆොස්ෆොග්ලුකොනේට්; R-5-P, ribulose 5-ෆොස්ෆේට්; PRPP, 5-phosphoribosyl-?-1-pyrophosphate; THF, tetrahydrofolate; IMP, ඉනොසීන් මොනොපොස්පේට්; AMP, ඇඩෙනොසීන් මොනොපොස්පේට්; GMP, guanosine මොනොපොස්පේට්.
රූපය 2 වේගයෙන් පැතිරෙන සෛලවල පරිවෘත්තීය ක්රියාවලියේදී Nrf2 හි කාර්යභාරය. Nrf2 යනු ඔක්සිකාරක හස්තයේ [එනම්, ග්ලූකෝස්-6-පොස්පේට් ඩිහයිඩ්රොජිනේස් (G6PD) සහ 6-ෆොස්පොග්ලුකොනේට් ඩිහයිඩ්රොජිනේස් (PGD)] සහ ඔක්සිකාරක නොවන හස්තයේ [එනම්, ට්රාන්ස්ඇල්ඩොලේස් 1 (TALDO1) සහ ට්රාන්ස්කෙටෝලේස් යන දෙකෙහිම ජාන කේතන එන්සයිමවල ධනාත්මක නියාමකයෙකි. TKT)] පෙන්ටෝස් පොස්පේට් මාර්ගයේ. G6PD සහ PGD NADPH ජනනය කරයි. Nrf2 අනෙක් NADPH උත්පාදක එන්සයිම දෙක වන malic එන්සයිම 1 (ME1) සහ isocitrate dehydrogenase 1 (IDH1) වල ජාන ප්රකාශනය නියාමනය කරයි. de novo purine biosynthetic මාර්ගයට ඇතුල්වීම උත්ප්රේරක කරන phosphoribosyl pyrophosphate amidotransferase (PPAT) හි ජාන ප්රකාශනය ද Nrf2 මගින් ධනාත්මකව නියාමනය කරනු ලැබේ, මෙතිලීන්ටෙට්රාහයිඩ්රොෆොලේට් ඩිහයිඩ්රොජිනේස් 2 (MTHFD2) තීරනාත්මක භූමිකාවේ ප්රකාශනය මෙන්ම එන්සයිමෙටොක්ඩොන්ඩ්රි. de novo purine biosynthesis සඳහා එක් කාබන් ඒකක සැපයීම. Pyruvate kinase (PK) Nrf2 මගින් සෘණාත්මකව නියාමනය කරනු ලබන අතර ග්ලයිකොලයිටික් අතරමැදි ගොඩනැගීමට සහ G6PD සමඟ එක්ව පෙන්ටෝස් පොස්පේට් මාර්ගය හරහා පරිවෘත්තීය නාලිකා සහ න්යෂ්ටික අම්ල, ඇමයිනෝ අම්ල සහ ෆොස්ෆොලිපිඩ් සංශ්ලේෂණයට අනුග්රහය දැක්වීමට අපේක්ෂා කෙරේ. Nrf2 ATP-citrate lyase (CL) හි ජාන ප්රකාශනය සෘණාත්මකව නියාමනය කරයි, එමඟින් මයිටොකොන්ඩ්රියල් භාවිතය සඳහා සයිටේ්රට් ලබා ගැනීමේ හැකියාව හෝ IDH1 සඳහා (isocitrate හරහා) වැඩි කළ හැක. රතු සහ නිල් පිළිවෙළින් ධනාත්මක සහ සෘණ නියාමනය පෙන්නුම් කරයි. මයිටොකොන්ඩ්රියන් අළු පැහැයෙන් දැක්වේ. පරිවෘත්තීය කෙටි යෙදුම්: G-6-P, ග්ලූකෝස් 6-පොස්පේට්; F-6-P, ෆෲක්ටෝස් 6-පොස්පේට්; F-1,6-BP, ෆෲක්ටෝස් 1,6-බිස්පොස්පේට්; GA-3-P, glyceraldehyde 3-ෆොස්ෆේට්; 3-PG, 3-ෆොස්ෆොග්ලිසරේට්; PEP, ෆොස්ෆොඑනොල්පිරුවාට්; 6-P-Gl, 6-ෆොස්ෆොග්ලුකොනොලැක්ටෝන්; 6-PG, 6-ෆොස්ෆොග්ලුකොනේට්; R-5-P, ribulose 5-ෆොස්ෆේට්; PRPP, 5-phosphoribosyl-?-1-pyrophosphate; THF, tetrahydrofolate; IMP, ඉනොසීන් මොනොපොස්පේට්; AMP, ඇඩෙනොසීන් මොනොපොස්පේට්; GMP, guanosine මොනොපොස්පේට්.
සෛලීය රෙඩොක්ස් හෝමියස්ටැසිස් හි ප්රධාන නියාමකයෙකු ලෙස Nrf2 හි තීරණාත්මක කාර්යභාරය සැලකිල්ලට ගෙන, WT සෛල හා සසඳන විට, Nrf2 කඩාකප්පල් වී ඇති සෛලවල ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ (ROS) මට්ටම ඉහළ මට්ටමක පැවතීම පුදුමයක් නොවේ (Nrf2-KO) [35]. ඔක්සිකාරක ආතතිය ඇති කරන නියෝජිතයන් සමඟ ඇති අභියෝගය මත මෙම වෙනස විශේෂයෙන් කැපී පෙනේ. එපමනක් නොව, Nrf2 හි ඌනතාවයෙන් යුත් සෛල විවිධ වර්ගවල ඔක්සිකාරකවල විෂ සහිතතාවයට වඩා සංවේදී වන අතර Nrf2 ප්රේරක මගින් ආරක්ෂා කළ නොහැක, එම තත්වයන් යටතේම, WT සෛල වලට කාර්යක්ෂම හා දිගුකාලීන ආරක්ෂාවක් සපයයි [29], [36] , [37]. සමස්ත සෛලීය රෙඩොක්ස් හෝමියස්ටැසිස් වලට අමතරව, මයිටොකොන්ඩ්රියල් රෙඩොක්ස් හෝමියස්ටැසිස් නඩත්තු කිරීම සඳහා ද Nrf2 ඉතා වැදගත් වේ. මේ අනුව, WT හා සසඳන විට, Keap1-KO හි සම්පූර්ණ මයිටොකොන්ඩ්රියල් NADH සංචිතය සැලකිය යුතු ලෙස වැඩි වී ඇති අතර Nrf2-KO සෛලවල නාටකාකාර ලෙස අඩු වී ඇත [35].
සජීවී සෛල රූපකරණය භාවිතා කරමින්, අපි මෑතකදී WT, Nrf2-KO, හෝ Keap1-knockdown (Keap1-KD) මීයන්ගෙන් හුදකලා වූ ප්රාථමික ග්ලියෝනුරෝනල් සංස්කෘතීන් සහ මොළයේ පටක පෙතිවල ROS නිෂ්පාදනයේ අනුපාත නිරීක්ෂණය කළෙමු [38]. අපේක්ෂා කළ පරිදි, ඔවුන්ගේ WT සගයන්ට සාපේක්ෂව Nrf2-KO සෛල සහ පටක වල ROS නිෂ්පාදනයේ වේගය වේගවත් විය. කෙසේ වෙතත්, WT හා සසඳන විට Keap1-KD සෛල ROS නිෂ්පාදනයේ ඉහළ අනුපාත ඇති බව අපි අනපේක්ෂිත නිරීක්ෂණය කළ නමුත් WT සහ Keap1-KD ප්රවේණි වර්ග අතර වෙනසෙහි විශාලත්වය WT සහ Nrf2-KO අතරට වඩා කුඩා විය. . මොළයේ ව්යාධි විද්යාවට සම්බන්ධ වූ NADPH ඔක්සිඩේස් (NOX) සමස්ථානික දෙකේ උත්ප්රේරක උප ඒකක වන NOX2 සහ NOX4 හි mRNA මට්ටම් අපි විශ්ලේෂණය කළ අතර, Nrf2 ඌනතාවයේ තත්ව යටතේ NOX2 නාටකාකාර ලෙස වැඩි වී ඇති බව සොයා ගත් අතර, Nrf4 විට NOX2 නියාමනය වේ. කුඩා ප්රමාණයකට වුවද, ව්යවස්ථාපිතව සක්රීය වේ. ප්රමාණාත්මකව, විකෘති මීයන්ගෙන් සෛල සහ පටකවල ඉහළ නැංවීමේ විශාලත්වය ROS නිෂ්පාදනයේ අනුරූප වැඩි වීම්වලට සමාන වේ [38]. සිත්ගන්නා කරුණ නම්, Nrf2 NADPH ඔක්සිඩේස් නියාමනය කරනවා පමණක් නොව, NADPH ඔක්සිඩේස් මගින් නිපදවන ROS හට පුඵ්ඵුසීය අපිච්ඡ සෛල සහ හෘද සෛලවල [2], [39] පෙන්වා ඇති පරිදි Nrf40 සක්රිය කළ හැකිය. තවද, ඉතා මෑත කාලීන අධ්යයනයකින් පෙන්නුම් කර ඇත්තේ Nrf2 හි NADPH ඔක්සිඩේස් මත යැපෙන සක්රිය කිරීම නිදන්ගත පීඩන අධි බරකදී හෘදයේ මයිටොකොන්ඩ්රියල් හානි සහ සෛල මිය යාමෙන් ආරක්ෂා වීම සඳහා වැදගත් ආවේණික යාන්ත්රණයක් වන බවයි [41].
NADPH ඔක්සිඩේස් හි උත්ප්රේරක ක්රියාකාරකමට අමතරව, මයිටොකොන්ඩ්රියල් ශ්වසනය ROS හි තවත් ප්රධාන අන්තර් සෛලීය ප්රභවයකි. මයිටොකොන්ඩ්රියා-විශේෂිත පරීක්ෂණ MitoSOX භාවිතයෙන්, අපි ප්රාථමික ග්ලියෝනුරෝනල් කොකල්චූරනල් කෝකියුලේටඩ් හි සමස්ත ROS නිෂ්පාදනය සඳහා මයිටොකොන්ඩ්රියා සම්භවයක් ඇති ROS හි දායකත්වය පරීක්ෂා කර ඇත්තෙමු. WT, Nrf2-KO, හෝ Keap1-KD මීයන්ගෙන් [38]. අපේක්ෂා කළ පරිදි, Nrf2-KO සෛල WT ට වඩා මයිටොකොන්ඩ්රියල් ROS නිෂ්පාදනයේ ඉහළ අනුපාතයක් තිබුණි. සමස්ත ROS නිෂ්පාදනය සඳහා වූ සොයාගැනීම් සමඟ එකඟව, Keap1-KD හි මයිටොකොන්ඩ්රියල් ROS නිෂ්පාදනයේ අනුපාත ද WT සෛලවලට සාපේක්ෂව වැඩි විය. වැදගත් කරුණක් නම්, රොටෙනෝන් සමඟ සංකීර්ණ I අවහිර කිරීම WT සහ Keap1-KD සෛල දෙකෙහිම මයිටොකොන්ඩ්රියල් ROS නිෂ්පාදනයේ නාටකාකාර වැඩි වීමක් ඇති කළ නමුත් Nrf2-KO සෛල තුළ කිසිදු බලපෑමක් ඇති කළේ නැත. පයිරුවේට් එකතු කිරීමෙන් පසු WT සෛලවල මයිටොකොන්ඩ්රියල් ROS නිෂ්පාදනයේ අපේක්ෂිත වැඩිවීමට ප්රතිවිරුද්ධව (NADH ලබා ගැනීමේ හැකියාව වැඩි දියුණු කිරීමට, මයිටොකොන්ඩ්රියල් පටල විභවය වැඩි කිරීමට සහ ශ්වසනය සාමාන්ය කිරීමට), Nrf2-KO සෛල තුළ ROS නිෂ්පාදනය අඩු විය. එක්ව, මෙම සොයාගැනීම් දැඩි ලෙස යෝජනා කරන්නේ, Nrf2 නොමැති විට: (i) සංකීර්ණ I හි ක්රියාකාරිත්වය දුර්වල වන අතර, (ii) සංකීර්ණ I හි ක්රියාකාරීත්වය අඩාල වීම උපස්ථර සීමා කිරීම නිසා වන අතර (iii) සංකීර්ණයේ ක්රියාකාරිත්වය අඩාල වීම සංකීර්ණ II වෙතින් ඉලෙක්ට්රෝන ප්රවාහය ප්රතිලෝම වීම නිසා විය හැකි මයිටොකොන්ඩ්රිය ROS නිෂ්පාදනය වැඩි වීමට එක් ප්රධාන හේතුවක් I වේ.
Nrf2 මයිටොකොන්ඩ්රියල් පටල විභවය සහ ශ්වසනය කෙරෙහි බලපායි
මයිටොකොන්ඩ්රියල් පටල විභවය (??m) යනු මයිටොකොන්ඩ්රිය සෞඛ්යය සහ සෛලයේ පරිවෘත්තීය තත්ත්වය පිළිබඳ විශ්වීය දර්ශකයකි. නිරෝගී සෛලයක, ??m නඩත්තු වන්නේ මයිටොකොන්ඩ්රියල් ශ්වසන දාමය මගිනි. සිත්ගන්නා කරුණ නම්, සංස්කෘතීන් මත පදනම් වූ ප්රෝටෝමික්ස් අධ්යයනයේ ඇමයිනෝ අම්ල සහිත ස්ථායී සමස්ථානික ලේබල් කිරීම estrogen receptor-negative nontumorigenic human breast epithelial MCF10A සෛල රේඛාවක් මගින් පෙන්වා දී ඇත්තේ මයිටොකොන්ඩ්රියල් ඉලෙක්ට්රෝන ප්රවාහන දාම සංරචකය NDUFA4 NDUFA2 ඖෂධීය සක්රීය කිරීම මගින් (fharmaxy සක්රීය කිරීම මගින්) නියාමනය කර ඇති බවයි. Nrf2 (Keap1 knockdown මගින්) ප්රවේණික නියාමනය COX2 සහ COX4I1 යන සයිටොක්රොම් c ඔක්සිඩේස් අනු ඒකක අඩු කිරීමට හේතු වේ. ද්විමාන ජෙල් විද්යුත් විච්ඡේදනය සහ න්යාසය ආශ්රිත ලේසර් අවශෝෂණ/අයනීකරණ ස්කන්ධ වර්ණාවලීක්ෂය භාවිතයෙන් අක්මා ප්රෝටියෝමය පිළිබඳ අධ්යයනයකින් Nrf42 ATP සින්තේස් අනු ඒකකයේ ප්රකාශනය නියාමනය කරන බව සොයාගෙන තිබේද? [2]. මීට අමතරව, I [43] සංකීර්ණයේ ක්රියාකාරිත්වය පවත්වාගෙන යාමේ කාර්යභාරයක් ඉටු කරන මයිටොකොන්ඩ්රියල් ප්රෝටීන් DJ-1 Nrf44 [2], [45], ඖෂධීය හෝ ජාන සක්රීය කිරීමේ ස්නායු ආරක්ෂක බලපෑම් වුවද ස්ථායීකරන බව වාර්තා වී ඇත. Nrf46 හි DJ-2 [1] වෙතින් ස්වාධීන වේ. කෙසේ වෙතත්, මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වය සඳහා මෙම නිරීක්ෂණවල ප්රතිවිපාක විමර්ශනය කර නොමැත.
Nrf2 ඌනතාවයේ කොන්දේසි යටතේ සංකීර්ණ I හි ආබාධිත ක්රියාකාරකම් සමඟ එකඟව, බාසල් ??m Nrf2-KO මූසික කළල තන්තුමය තන්තු (MEFs) සහ සංස්කෘතික ප්රාථමික ග්ලියෝනෙයුරෝනල් සෛලවල WT සගයන් හා සැසඳීමේ දී අඩු වේ (රූපය 3, ඇතුල් කිරීම) [35]. ඊට ප්රතිවිරුද්ධව, Nrf2 ජානමය වශයෙන් ව්යුහාත්මකව නියාමනය කළ විට (Keap1 knockdown හෝ knockout මගින්) බාසල් ??m වැඩි වේ. ප්රවේණි වර්ග අතර ??m හි මෙම වෙනස්කම් පෙන්නුම් කරන්නේ Nrf2 හි ක්රියාකාරිත්වය මගින් ශ්වසනයට බලපාන බවයි. ඇත්ත වශයෙන්ම, බාසල් තත්ත්වයේ ඔක්සිජන් පරිභෝජනය තක්සේරු කිරීමෙන් හෙළි වී ඇත්තේ, WT හා සසඳන විට, ඔක්සිජන් පරිභෝජනය Nrf2-KO සහ Keap1-KO MEF වල පිළිවෙලින් ~50 සහ ~35% කින් අඩු බවයි.
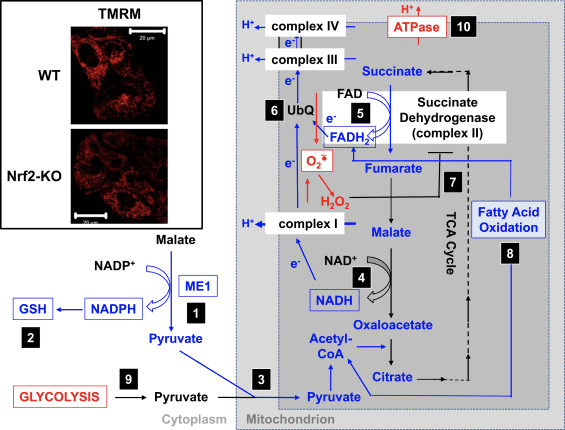 රූපය 3 Nrf2 ඌනතාවයේ කොන්දේසි යටතේ සම්මුතිගත මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වය සඳහා යෝජිත යාන්ත්රණය. (1) ME1, IDH1, G6PD, සහ PGD මට්ටම් අඩුවීම NADPH මට්ටම් අඩුවීමට හේතු වේ. (2) GSH මට්ටම් ද අඩුය. (3) ME1 හි අඩු ක්රියාකාරිත්වය මයිටොකොන්ඩ්රියාවට ඇතුළු වන පයිරුවේට් සංචිතය අඩු කළ හැකිය. (4) NADH උත්පාදනය මන්දගාමී වන අතර, සංකීර්ණ I හි ක්රියාකාරිත්වය අඩාල වීමට සහ මයිටොකොන්ඩ්රිය ROS නිෂ්පාදනය වැඩි කිරීමට හේතු වේ. (5) මයිටොකොන්ඩ්රියල් ප්රෝටීන වල FAD FADH2 දක්වා අඩු කිරීම ද අඩු වන අතර, FADH2 සිට UbQ දක්වා සහ සංකීර්ණ III දක්වා ඉලෙක්ට්රෝන ප්රවාහය අඩු කරයි. (6) UbQH2 හි සෙමින් ගොඩනැගීම succinate dehydrogenase හි එන්සයිම ක්රියාකාරිත්වය අඩු කළ හැක. (7) ROS හි වැඩි වූ මට්ටම් සංකීර්ණ II හි ක්රියාකාරිත්වය තවදුරටත් වළක්වයි. (8) මේද අම්ල ඔක්සිකරණයේ අඩු කාර්යක්ෂමතාව මයිටොකොන්ඩ්රියල් ශ්වසනය සඳහා උපස්ථර ලබා ගැනීමේ අඩුවීමට දායක වේ. (9) ඔක්සිකාරක පොස්පරීකරණයේ අඩු වූ ATP නිෂ්පාදනය සඳහා වන්දි යාන්ත්රණයක් ලෙස Glycolysis වැඩි දියුණු කර ඇත. (10) ATP සින්තේස් ??m පවත්වා ගැනීමට ප්රතිලෝමව ක්රියා කරයි. රතු සහ නිල් පිළිවෙළින් ඉහළ නියාමනය සහ අඩු කිරීම පෙන්නුම් කරයි. පෙට්ටිවලින් පෙන්නුම් කරන්නේ පර්යේෂණාත්මක සාක්ෂි තිබීමයි. පොටෙන්ටියෝමිතික ප්රතිදීප්ත ගවේෂණ ටෙට්රාමෙතිල්රොඩමයින් මෙතිල් එස්ටරය (TMRM; 2 nM) මගින් දෘශ්යමාන කරන ලද WT සහ Nrf25-KO cortical astrocytes වල මයිටොකොන්ඩ්රියා වල රූප ඇතුලත් කිරීම පෙන්වයි. පරිමාණ තීරුව, මීටර් 20.
රූපය 3 Nrf2 ඌනතාවයේ කොන්දේසි යටතේ සම්මුතිගත මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වය සඳහා යෝජිත යාන්ත්රණය. (1) ME1, IDH1, G6PD, සහ PGD මට්ටම් අඩුවීම NADPH මට්ටම් අඩුවීමට හේතු වේ. (2) GSH මට්ටම් ද අඩුය. (3) ME1 හි අඩු ක්රියාකාරිත්වය මයිටොකොන්ඩ්රියාවට ඇතුළු වන පයිරුවේට් සංචිතය අඩු කළ හැකිය. (4) NADH උත්පාදනය මන්දගාමී වන අතර, සංකීර්ණ I හි ක්රියාකාරිත්වය අඩාල වීමට සහ මයිටොකොන්ඩ්රිය ROS නිෂ්පාදනය වැඩි කිරීමට හේතු වේ. (5) මයිටොකොන්ඩ්රියල් ප්රෝටීන වල FAD FADH2 දක්වා අඩු කිරීම ද අඩු වන අතර, FADH2 සිට UbQ දක්වා සහ සංකීර්ණ III දක්වා ඉලෙක්ට්රෝන ප්රවාහය අඩු කරයි. (6) UbQH2 හි සෙමින් ගොඩනැගීම succinate dehydrogenase හි එන්සයිම ක්රියාකාරිත්වය අඩු කළ හැක. (7) ROS හි වැඩි වූ මට්ටම් සංකීර්ණ II හි ක්රියාකාරිත්වය තවදුරටත් වළක්වයි. (8) මේද අම්ල ඔක්සිකරණයේ අඩු කාර්යක්ෂමතාව මයිටොකොන්ඩ්රියල් ශ්වසනය සඳහා උපස්ථර ලබා ගැනීමේ අඩුවීමට දායක වේ. (9) ඔක්සිකාරක පොස්පරීකරණයේ අඩු වූ ATP නිෂ්පාදනය සඳහා වන්දි යාන්ත්රණයක් ලෙස Glycolysis වැඩි දියුණු කර ඇත. (10) ATP සින්තේස් ??m පවත්වා ගැනීමට ප්රතිලෝමව ක්රියා කරයි. රතු සහ නිල් පිළිවෙළින් ඉහළ නියාමනය සහ අඩු කිරීම පෙන්නුම් කරයි. පෙට්ටිවලින් පෙන්නුම් කරන්නේ පර්යේෂණාත්මක සාක්ෂි තිබීමයි. පොටෙන්ටියෝමිතික ප්රතිදීප්ත ගවේෂණ ටෙට්රාමෙතිල්රොඩමයින් මෙතිල් එස්ටරය (TMRM; 2 nM) මගින් දෘශ්යමාන කරන ලද WT සහ Nrf25-KO cortical astrocytes වල මයිටොකොන්ඩ්රියා වල රූප ඇතුලත් කිරීම පෙන්වයි. පරිමාණ තීරුව, මීටර් 20.
??m හි මෙම වෙනස්කම් සහ ප්රවේණි වර්ග අතර ශ්වසනය පිළිබිඹු වන්නේ මයිටොකොන්ඩ්රියල් ශ්වසනය සඳහා උපස්ථර භාවිතා කිරීමේ වේගයෙනි. ට්රයිකාබොක්සිලික් අම්ලය (TCA) චක්රය සඳහා උපස්ථර යෙදීම (malate/pyruvate, එය සංකීර්ණ I උපස්ථරය NADH නිෂ්පාදනය වැඩි කරයි) හෝ සංකීර්ණ II සඳහා උපස්ථරයක් වන මෙතිල් succinate, WT දෙකෙහිම ??m හි පියවරෙන් පියවර වැඩි වීමක් ඇති කරයි. සහ Keap1-KD නියුරෝන, නමුත් වැඩි වීමේ වේගය Keap1-KD සෛලවල වැඩි වේ. වඩාත් වැදගත් දෙය නම්, මෙම TCA චක්ර උපස්ථර සඳහා ප්රතිචාරයේ හැඩතල ප්රවේණි වර්ග දෙක අතර වෙනස් වන අතර, උපස්ථර එකතු කිරීමේදී Keap1-KD සෛලවල ??m හි සීඝ්ර ඉහළ යාම සානුවකට වඩා ඉක්මන් පහත වැටීමක් අනුගමනය කරමින් අසාමාන්ය ලෙස යෝජනා කරයි. වේගවත් උපස්ථර පරිභෝජනය. මෙම සොයාගැනීම් WT MEF හා සසඳන විට Keap50-KO හි [U-70C1]ග්ලූකෝස් 13-h ස්පන්දනයකින් පසුව නිරීක්ෂණය කරන ලද malate, pyruvate සහ succinate ඉතා අඩු (6-1% කින්) මට්ටම් සමඟ සමීප එකඟතාවයකින් යුක්ත වේ. සෛල [24]. Nrf2-KO නියුරෝන වල, පයිරුවේට් පමණක් ??m වැඩි කිරීමට සමත් වන අතර, malate සහ methyl succinate මෘදු depolarization ඇති කරයි. මයිටොකොන්ඩ්රිය උපස්ථර නිෂ්පාදනයට Nrf2 හි බලපෑම Nrf2 මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වයට බලපාන ප්රධාන යාන්ත්රණය බව පෙනේ. මයිටොකොන්ඩ්රියල් NADH රෙඩොක්ස් දර්ශකය (සංකීර්ණ I මගින් NADH පරිභෝජනය සහ TCA චක්රයේ NADPH නිෂ්පාදනය අතර සමතුලිතතාවය) Nrf2-KO සෛලවල ඒවායේ WT සගයන් හා සැසඳීමේ දී සැලකිය යුතු ලෙස අඩු වන අතර තව දුරටත්, සංචිතවල ප්රතිජනන අනුපාත NADH සහ FADH2 සංකීර්ණ IV නිෂේධනය කිරීමෙන් පසු (NaCN භාවිතයෙන්) විකෘති සෛල තුළ මන්දගාමී වේ.
Murine මොළයෙන් සහ අක්මාවෙන් හුදකලා වූ මයිටොකොන්ඩ්රියා වලදී, සංකීර්ණ I හෝ සංකීර්ණ II සඳහා උපස්ථර පරිපූරණය කිරීම Nrf2 සක්රිය වූ විට ඔක්සිජන් පරිභෝජන වේගය වඩාත් ප්රබල ලෙස වැඩි කරන අතර Nrf2 බාධා වූ විට අඩු කාර්යක්ෂම වේ [35]. මේ අනුව, WT හා සසඳන විට Malate Keap1-KD හි ඔක්සිජන් පරිභෝජනයේ ඉහළ අනුපාතයක් ඇති කරයි, නමුත් එහි බලපෑම Nrf2-KO මයිටොකොන්ඩ්රියා හි දුර්වල වේ. ඒ හා සමානව, රොටෙනෝන් ඉදිරියේ (සංකීර්ණ I නිෂේධනය වූ විට), succinate WT හා සසඳන විට Keap1-KD හි ඔක්සිජන් පරිභෝජනය වැඩි ප්රමාණයකට සක්රීය කරයි, නමුත් Nrf2-KO මයිටොකොන්ඩ්රියා හි ප්රතිචාරය අඩු වේ. මීට අමතරව, Nrf2-KO ප්රාථමික නියුරෝන සංස්කෘතීන් සහ මීයන් සංකීර්ණ II නිෂේධක 3-නයිට්රොප්රොපියොනික් අම්ලය සහ මැලෝනේට් වල විෂ සහිත බව කෙරෙහි වඩාත් සංවේදී වන අතර Nrf2-අධික ලෙස ප්රකාශ කරන තාරකා සෛල අභ්යන්තර බද්ධ කිරීම ආරක්ෂිත වේ [48], [49]. ඒ හා සමානව, Nrf2-KO මීයන් වඩාත් සංවේදී වන අතර, Nrf2 හි ජානමය හෝ ඖෂධීය සක්රීය කිරීම 1-මෙතිල්-4-ෆීනයිල්-1 හි ඇති සංකීර්ණ I නිෂේධක 4-මෙතිල්-1,2,3,6-ෆීනයිල්පිරිඩිනියම් අයන මගින් ඇති කරන නියුරෝටොක්සිසිටි වලට එරෙහිව ආරක්ෂිත බලපෑම් ඇති කරයි. පාකින්සන් රෝගයේ 49-ටෙට්රාහයිඩ්රොපිරිඩින් සත්ව ආකෘතිය [50], [51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [XNUMX].
ශ්වසන පාලන අනුපාතය (RCR), ප්රාන්ත 3 (ADP-උත්තේජනය) සහ ප්රාන්ත 4 ශ්වසනය (ADP නොමැත) අනුපාතය Nrf2 නොමැති විට අඩු වේ, නමුත් RCR Keap1-KD සහ WT මයිටොකොන්ඩ්රියා [35] අතර සමාන වේ. ]. RCR යනු මයිටොකොන්ඩ්රිය ස්වසන දාමයේ ක්රියාකාරිත්වය ඔක්සිකාරක පොස්පරීකරණයට සම්බන්ධ වීමේ ප්රමාණය පිළිබඳ ඇඟවීමක් වන බැවින්, මෙම සොයාගැනීමෙන් පෙන්නුම් කරන්නේ Keap1-KD මයිටොකොන්ඩ්රියාවේ ඉහළ ශ්වසන වේගය ඔක්සිකාරක පොස්පරීකරණය විසන්ධි කිරීම නිසා නොවන බවයි. එය තවදුරටත් යෝජනා කරන්නේ Nrf2 සක්රිය කළ විට ඔක්සිකාරක පොස්පරීකරණය වඩාත් කාර්යක්ෂම වන බවයි. Keap1-KD මයිටොකොන්ඩ්රියා හි ඉහළ ශ්වසන වේගය මයිටොකොන්ඩ්රියල් ROS නිෂ්පාදනයේ ඉහළ මට්ටම්වලට අනුකූල වේ [38] ඉහළ ශ්වසන වේගය ඉලෙක්ට්රෝන කාන්දු වීම වැඩි වීමට හේතු විය හැක. කෙසේ වෙතත්, ඔක්සිකාරක ආතතියේ තත්ත්වයන් යටතේ, වැඩි වූ ROS නිෂ්පාදනයට Nrf2 මත යැපෙන ප්රෝටීන් 3 (UCP3) හි ප්රතිනිර්මාණය කිරීම මගින් ප්රතික්රියා කරයි, එය මයිටොකොන්ඩ්රියල් අභ්යන්තර පටලයේ ප්රෝටෝන සන්නායකතාව වැඩි කරන අතර ප්රතිඵලයක් ලෙස සුපර් ඔක්සයිඩ් නිෂ්පාදනය අඩු කරයි [62]. ඉතා මෑතකදී, ලිපිඩ පෙරොක්සයිඩීකරණ නිෂ්පාදනය 4-හයිඩ්රොක්සි-2-නෝනෙනල් මගින් හෘද සෛලවල UCP2 හි Nrf3-රඳා පවතින නියාමනය සඳහා මැදිහත් වන බව පෙන්නුම් කරන ලදී; මෙය ඉෂ්මියා ප්රතිවර්තනය [63] වැනි ඔක්සිකාරක ආතති තත්වයන් යටතේ ආරක්ෂාව සඳහා විශේෂයෙන් වැදගත් විය හැක.
Nrf2 ඔක්සිකාරක පොස්පරීකරණයේ කාර්යක්ෂමතාවයට සහ ATP සංශ්ලේෂණයට බලපායි.
මොළයේ සහ අක්මාවේ මයිටොකොන්ඩ්රියාවේ Nrf2 හි බලපෑමට එකඟව, Nrf2 ඌනතාවයෙන් ඔක්සිකාරක පොස්පරීකරණයේ කාර්යක්ෂමතාව අඩු වේ (ATP සංශ්ලේෂණය සඳහා පරිභෝජනය කරන ADP ඔක්සිජන් අනුපාතය අනුව ඇස්තමේන්තු කර ඇති පරිදි), Nrf2 සක්රීය කිරීම (Keap1) -KD) ප්රතිවිරුද්ධ බලපෑමක් ඇත [35]. WT හා සසඳන විට, ATP මට්ටම් Nrf2 හි සාංදෘෂ්ටික නියාමනය සහිත සෛලවල සැලකිය යුතු ලෙස වැඩි වන අතර Nrf2 කඩා වැටුණු විට [64] හෝ කඩාකප්පල් වූ විට [35] අඩු වේ. තවද, ඔක්සිකාරක පොස්පරීකරණය (ඔලිගොමිසින්) හෝ ග්ලයිකොලිසිස් (අයෝඩොඇසිටික් අම්ලය) නිෂේධක භාවිතය මගින් Nrf2 සෛල ATP නිපදවන ආකාරය වෙනස් කරන බව අනාවරණය වී ඇත. මේ අනුව, WT නියුරෝන වල, oligomycin ATP හි සම්පූර්ණ පහත වැටීමක් ඇති කරන අතර iodoacetic අම්ලය තවදුරටත් බලපෑමක් ඇති නොකරයි. කැපී පෙනෙන ලෙස, Nrf2-KO සෛල තුළ, oligomycin ATP මට්ටම් වැඩි කරයි, පසුව සෙමින්, නමුත් සම්පූර්ණයෙන්ම, iodoacetic අම්ලය මගින් ක්ෂය වේ, Nrf2 නොමැති විට, ග්ලයිකොලිසිස්, සහ ඔක්සිකාරක පොස්පරීකරණය නොවන බව, ATP නිෂ්පාදනයේ ප්රධාන මූලාශ්රය බව පෙන්නුම් කරයි. සිත්ගන්නා කරුණ නම්, Keap1-KD සෛලවල ඔක්සිකාරක පොස්පරීකරණයේ වැඩි කාර්යක්ෂමතාව තිබියදීත්, ඔලිගොමිසින් එකතු කිරීම ATP මට්ටම්වල ~80% අඩුවීමට හේතු වන අතර අයඩෝඇසිටික් අම්ලය තවත් ~20% අඩුවීමට හේතු වේ. මේ අනුව, Nrf2 ඌනතාවය හෝ එහි සංඝටක සක්රීය කිරීම ඔක්සිකාරක පොස්පරීකරණයේ දායකත්වය අඩු කරන අතර ATP සංශ්ලේෂණය සඳහා ග්ලයිකොලිසිස් වල දායකත්වය වැඩි කරයි. Nrf2 නොමැති විට සහ මාධ්යයේ [35] ග්ලූකෝස් පැවතීම මත ??m මත යැපීම සහ ග්ලයිකොලිටික් අතරමැදි මට්ටම් වැඩි වීම (G-6-P, F-6-P) සමඟ අනුකූල වන විට මෙම බලපෑම විශේෂයෙන් ප්රකාශ වේ. , ඩයිහයිඩ්රොක්සිසෙටෝන් පොස්පේට්, පයිරුවේට් සහ ලැක්ටේට්) Nrf2 [24] තට්ටු කිරීමෙන් පසුව.
oligomycin මගින් F1F0-ATPase නිෂේධනය කිරීමෙන් පසු ATP මට්ටම් වැඩි වීම පෙන්නුම් කරන්නේ Nrf2 නොමැති විට F1F0-ATPase ATPase ලෙස ක්රියා කරන අතර ATP සංස්ලේෂණයක් ලෙස නොවේ, එනම් එය ප්රතිලෝමව ක්රියා කරයි. ක්රියාකාරීත්වයේ එවැනි ප්රතිවර්තනය බොහෝ විට මෙම ඉන්ද්රියයේ ක්රියාකාරී අඛණ්ඩතාව සඳහා තීරණාත්මක වන ??m පවත්වා ගැනීමට උත්සාහ කිරීමේදී අභ්යන්තර මයිටොකොන්ඩ්රියල් පටලය හරහා ප්රෝටෝන පොම්ප කිරීමේ අවශ්යතාවය පිළිබිඹු කරයි. F1F0-ATPase හි ක්රියාකාරීත්වයේ ප්රතිවර්තනය Nrf2-KO සෛල වෙත ඔලිගොමයිසින් පරිපාලනය මත නිරීක්ෂණය කරන ලද මයිටොකොන්ඩ්රියල් විධ්රැවීකරණය මගින් ද සාක්ෂි දරයි, එය ඔවුන්ගේ WT හෝ Keap1-අඩුපාඩු සහිත සගයන් [35] තුළ සිදුවන අධිධ්රැවීකරණයට තියුනු ලෙස වෙනස් වේ. සමස්තයක් වශයෙන්, Nrf2 ඌනතාවයේ කොන්දේසි යටතේ ATP ප්රධාන වශයෙන් ග්ලයිකොලිසිස් වලදී නිපදවන බව පෙනේ, මෙම ATP පසුව F1F0-ATPase විසින් ??m නඩත්තු කිරීමට අර්ධ වශයෙන් භාවිතා කරයි.
Nrf2 මයිටොකොන්ඩ්රියල් මේද අම්ල ඔක්සිකරණය වැඩි දියුණු කරයි
??m මත Nrf2 ඌනතාවයේ බලපෑම විශේෂයෙන් ප්රකාශ වන්නේ සෛල ග්ලූකෝස් නොමැතිව මධ්යයේ ඉන්කියුබේෂන් කරන විට වන අතර, WT සෛලවලට සාපේක්ෂව ??m Nrf50-KO හි ~2% අඩුය [35]. ග්ලූකෝස් ඌනතාවයේ තත්වයන් යටතේ, මයිටොකොන්ඩ්රියල් මේද අම්ල ඔක්සිකරණය (FAO) යනු ශ්වසනය සහ ඔක්සිකාරක පොස්පරීකරණය සඳහා උපස්ථර සපයන ප්රධාන සැපයුම්කරුවෙකු වන අතර, Nrf2 FAO ට බලපෑම් කළ හැකි බව යෝජනා කරයි. ඇත්ත වශයෙන්ම, දිගු දාම (C16:0) සංතෘප්ත මේද අම්ල පැල්මිටික් අම්ලය සහ කෙටි දාම (C6:0) හෙක්සැනොයික් අම්ලය යන දෙකටම FAO හි කාර්යක්ෂමතාවය Keap1-KO MEFs සහ හුදකලා වූ හෘදය සහ අක්මා මයිටොකොන්ඩ්රියාවේ ඒවාට වඩා වැඩිය. WT සගයන්, නමුත් එය Nrf2-KO සෛල සහ මයිටොකොන්ඩ්රියා [65] වල අඩුය. මෙම බලපෑම් මිනිසුන්ට ද බෙහෙවින් අදාළ වේ: ඇත්ත වශයෙන්ම, TCA චක්රයේ ක්රියාකාරිත්වය සමඟ FAO වඩා හොඳින් ඒකාබද්ධ වීම පෙන්නුම් කරන පරිවෘත්තීය වෙනස්කම් සම්භාව්ය Nrf2 සක්රියකාරක සල්ෆොරපේන් හි පූර්වගාමියා වන ග්ලූකෝරෆනින් පොහොසත් ආහාර සමඟ මානව මැදිහත්වීම් අධ්යයනයන්හි වාර්තා වී ඇත. 66].
මයිටකොන්ඩ්රියල් FAO හි පළමු පියවරේදී, ?-කාබනයේ ප්රෝ-ආර් හයිඩ්රජන් හයිඩ්රයිඩ් ලෙස පිටත් වන අතර එමඟින් FAD cofactor FADH2 දක්වා අඩු කරයි, එමඟින් ඉලෙක්ට්රෝන ශ්වසන දාමයේ ubiquinone (UbQ) වෙත මාරු කරයි, අවසානයේ ATP නිෂ්පාදනයට දායක වේ. . ග්ලූකෝස් නොමැති විට palmitoylcarnitine මගින් FAO උත්තේජනය කිරීම WT සහ Keap1-KO සෛලවල ATP මට්ටම්වල අපේක්ෂිත වැඩිවීමට හේතු වන අතර, Keap1-KO සෛලවල ATP ඉහළ යාම වේගවත් වන අතර, සමාන ප්රතිකාරය Nrf2-KO හි ATP වෙනස්කම් ඇති නොකරයි. MEFs [65]. මෙම අත්හදා බැලීම පෙන්නුම් කරන්නේ, Nrf2 නොමැති විට, FAO යටපත් කර ඇති අතර, තව දුරටත්, Nrf2 ඌනතාවයේ [35], [64] තත්වයන් යටතේ ATP මට්ටම් අඩු වීමට එක් හේතුවක් ලෙස FAO මර්දනය කිරීම ඇඟවුම් කරයි.
සැලකිය යුතු ලෙස, Nrf293 නිශ්ශබ්ද කර ඇති මානව 2 T සෛලවල CPT1 සහ CPT2[67] අඩු ප්රකාශනයක් ඇත, මයිටොකොන්ඩ්රියල් FAO හි අනුපාත සීමා කරන එන්සයිමය වන carnitine palmitoyltransferase (CPT) සමස්ථානික දෙකක්. එකඟතාවයකට අනුව, WT මීයන්ට සාපේක්ෂව Cpt1 හි mRNA මට්ටම Nrf2-KO හි අක්මා වල අඩුය [68]. CPT මගින් දිගු දාම මේද අම්ල-CoA හි ඇසිල් කාණ්ඩය coenzyme A සිට l-carnitine දක්වා මාරු කිරීම උත්ප්රේරණය කරන අතර එමගින් සයිටොප්ලාස්මයේ සිට mitochondria තුළට acylcarnitine ආනයනය කිරීමට අවසර දෙයි. මෙය අද දක්වා පරීක්ෂා කර නොමැති නමුත්, CPT1 ප්රකාශනයට පිටපත් කිරීමේ බලපෑම් වලට අමතරව, Nrf2 එහි ප්රධාන ඇලෝස්ටෙරික් නිෂේධකය වන malonyl-CoA මට්ටම් පාලනය කිරීමෙන් මෙම එන්සයිමයේ ක්රියාකාරිත්වයට ද බලපෑම් කළ හැකිය. මක්නිසාද යත්, දැනට අපැහැදිලි යාන්ත්රණයක් මගින්, Nrf2 විසින් stearoyl CoA desaturase (SCD) [69] සහ citrate lyase (CL) [69], [70] ප්රකාශනය ඍණාත්මක ලෙස නියාමනය කරයි. කුතුහලයට කරුණක් නම්, SCD තට්ටු කිරීම හෝ නිෂේධනය කිරීම මගින් AMP-සක්රීය ප්රෝටීන් කයිනාස් (AMPK) [71], [72], [73] ෆොස්ෆොරයිලීකරණය සහ සක්රිය කිරීම වැඩි කිරීමට හේතු වන අතර, Nrf2 නොමැති විට, SCD මට්ටම් බව අනුමාන කළ හැක. වැඩි වනු ඇත, අනෙක් අතට AMPK ක්රියාකාරකම් අඩු කරයි. Nrf2-KO මීයන්ගේ අක්මාවේ [68] නිරීක්ෂණය කරන ලද AMPK හි අඩු ප්රෝටීන් මට්ටම් මගින් මෙය තවදුරටත් සංකලනය විය හැක, එය Keap1-KD හි අක්මාවේ වාර්තා වී ඇති AMPK මට්ටම් වැඩි වීම සමඟ සමීප එකඟතාවයකින් යුක්ත වේ. මීයන් [74]. AMPK ක්රියාකාරකම් අඩුවීමේ එක් ප්රතිවිපාකයක් වන්නේ එහි ඇසිටිල්-CoA කාබොක්සිලේස් (ACC) [79] හි නිෂේධනීය පොස්පරීකරණයේ (Ser75 හි) සහනයයි, එය Nrf2 සක්රීය කිරීම [2] මගින් පහත හෙලන බැවින් Nrf70 නොමැති විට තවදුරටත් පිටපත් කිරීමේ ලෙස ඉහළ නැංවිය හැකිය. ]. ACC සඳහා උපස්ථරය වන acetyl-CoA නිෂ්පාදනය වැඩි කරන ඉහළ නියාමනය කරන ලද CL ප්රකාශනය සමඟ ඒකාබද්ධව ඉහළ ACC ක්රියාකාරකම්, අවසානයේදී ACC නිෂ්පාදනය වන malonyl-CoA මට්ටම් වැඩි කළ හැක. malonyl-CoA හි ඉහළ මට්ටම් CPT වලක්වනු ඇත, එමගින් මේද අම්ල මයිටොකොන්ඩ්රියාවට ප්රවාහනය කිරීම අඩු කරයි. අවසාන වශයෙන්, Nrf2 CD36 [76] හි ප්රකාශනය ධනාත්මකව නියාමනය කරයි, එය ප්ලාස්මා සහ මයිටොකොන්ඩ්රියල් පටල හරහා මේද අම්ල ආනයනය කරයි. මේ අනුව, මයිටොකොන්ඩ්රියා FAO හි කාර්යක්ෂමතාවයට Nrf2 බලපෑම් කළ හැකි එක් යාන්ත්රණයක් වන්නේ මයිටොකොන්ඩ්රියා තුළට දිගු දාම මේද අම්ල ආනයනය නියාමනය කිරීමයි.
සෘජු පිටපත් කිරීමේ නියාමනයට අමතරව, Nrf2 සෛලීය රෙඩොක්ස් පරිවෘත්තීය කෙරෙහි එහි බලපෑම මගින් මයිටොකොන්ඩ්රියල් FAO හි කාර්යක්ෂමතාව ද වෙනස් කළ හැකිය. Nrf2 ක්රියාකාරකම් අඩු හෝ නොමැති විට, සෛලීය රෙඩොක්ස් තත්ත්වය ඔක්සිකරණය වූ තත්ත්වයට මාරු කරන තත්ත්වයන් ඇති විට මෙය විශේෂයෙන් අදාළ විය හැක. ඇත්ත වශයෙන්ම, FAO එන්සයිම කිහිපයක් රෙඩොක්ස් වෙනස්කම් වලට සංවේදී බව හඳුනාගෙන ඇත. එවැනි එක් එන්සයිමයක් වන්නේ ඉතා දිගු දාම acyl-CoA dehydrogenase (VLCAD) වන අතර එය මිනිස් පටක වල palmitoyl-CoA dehydrogenation ක්රියාකාරකම් සඳහා 80% කට වඩා දායක වේ [77]. සිත්ගන්නා කරුණ නම්, හර්ඩ් සහ අල්. [78] VLCAD හි සිස්ටීන් අපද්රව්ය අඩංගු වන බව පෙන්වා දී ඇති අතර එය හුදකලා වූ මී හෘද මයිටොකොන්ඩ්රියා H2O2 වෙත නිරාවරණය වීමෙන් ඒවායේ රෙඩොක්ස් තත්ත්වය සැලකිය යුතු ලෙස වෙනස් කරයි. මීට අමතරව, Cys238 හි ඇති murine hepatic VLCAD හි S-නයිට්රොසිලේෂන් එන්සයිමයේ උත්ප්රේරක කාර්යක්ෂමතාව වැඩි දියුණු කරයි [79], සහ එම සයිස්ටීන් ඔක්සිකරණය ප්රතිවිරුද්ධ බලපෑමක් ඇති කිරීමට ඉඩ ඇති අතර අවසානයේ මයිටොකොන්ඩ්රියල් FAO හි කාර්යක්ෂමතාව අඩු කරයි. එබැවින්, WT, Nrf2-KO, හෝ Keap1-KO MEFs [65] හි VLCAD හි ප්රකාශන මට්ටම් සැලකිය යුතු ලෙස වෙනස් නොවූවත්, ඉහළ මට්ටම් හේතුවෙන් Nrf2 නොමැති විට VLCAD හි එන්සයිම ක්රියාකාරිත්වය අඩු විය හැක. ROS හි.
මෙම සියලු සොයාගැනීම් මත පදනම්ව, එය යෝජනා කළ හැකිය (රූපය 3): Nrf2 නොමැති විට, ME1, IDH1, G6PD, සහ PGD හි ප්රකාශනය අඩු වීම හේතුවෙන් NADPH මට්ටම් අඩු වේ. එහි ජෛව සංස්ලේෂණයට සහ ප්රතිජනනයට සහභාගී වන එන්සයිමවල ප්රකාශනය අඩු වීම සහ ඔක්සිකරණය වූ ග්ලූටතයෝන් අඩු කළ ආකාරය බවට පරිවර්තනය කිරීම සඳහා අවශ්ය වන NADPH හි පහළ මට්ටම් හේතුවෙන් අඩු වූ ග්ලූටතයෝන් මට්ටම ද අඩු වේ. ME1 හි අඩු ප්රකාශනය මයිටොකොන්ඩ්රියාවට ඇතුළු වන පයිරුවේට් සංචිතය අඩු කරයි, ග්ලයිකොලිසිස් පයිරුවේට් වල ප්රධාන ප්රභවය බවට පත්වේ. NADH උත්පාදනය මන්දගාමී වන අතර, සංකීර්ණ I හි ක්රියාකාරිත්වය අඩාල වීමට සහ මයිටොකොන්ඩ්රියල් ROS නිෂ්පාදනය වැඩි කිරීමට හේතු වේ. FAD සිට FADH2 දක්වා අඩු කිරීම ද මන්දගාමී වේ, අඩුම වශයෙන් අඩු කාර්යක්ෂම මේද අම්ල ඔක්සිකරණය හේතුවෙන්, FADH2 සිට UbQ දක්වා සහ සංකීර්ණ III දක්වා ඉලෙක්ට්රෝන ප්රවාහය සම්මුතියට පත් කරයි. UbQH2 යනු succinate dehydrogenase [80] සක්රියකාරකයක් වන බැවින්, එය සෑදීම ප්රමාද කිරීම succinate dehydrogenase හි එන්සයිම ක්රියාකාරිත්වය අඩු කළ හැක. සුපර් ඔක්සයිඩ් සහ හයිඩ්රජන් පෙරොක්සයිඩ් මට්ටම් වැඩි වීම සංකීර්ණ II ක්රියාකාරකම් තවදුරටත් වළක්වයි [81]. මේද අම්ල ඔක්සිකරණයේ අඩු කාර්යක්ෂමතාව මයිටොකොන්ඩ්රියල් ශ්වසනය සහ ඔක්සිකාරක පොස්පරීකරණයේදී ATP නිෂ්පාදනය සඳහා උපස්ථර ලබා ගැනීමේ අඩුවීමට දායක වේ. වන්දි යාන්ත්රණයක් ලෙස, glycolysis වැඩි දියුණු කර ඇත. ATP සින්තේස් ක්රියා කරන්නේ ප්රතිලෝමව, ATPase එකක් ලෙස, ??m පවත්වා ගැනීමට උත්සාහ කිරීමෙනි.
Nrf2 සහ මයිටොකොන්ඩ්රියල් ජෛව උත්පාදනය
WT හා සසඳන විට Nrf2-KO මීයන්ගේ අක්මාවෙහි අඩු මයිටොකොන්ඩ්රියල් අන්තර්ගතයක් ඇති බව වාර්තා වී ඇත (මයිටොකොන්ඩ්රියල් සහ න්යෂ්ටික DNA අනුපාතය අනුව තීරණය වන පරිදි); WT සහ Nrf24-KO මීයන් දෙකෙහිම පැය 2 ක වේගයෙන් මෙය තවදුරටත් අඩු වේ; ඊට ප්රතිවිරුද්ධව, සාමාන්ය පෝෂණ තත්ව යටතේ WT ට වඩා වෙනස් නොවුවද, ඉහළ Nrf2 ක්රියාකාරකම් සහිත මීයන්ගේ මයිටොකොන්ඩ්රියල් අන්තර්ගතය නිරාහාරව සිටීමෙන් බල නොපායි [82]. සිත්ගන්නා කරුණ නම්, Nrf2 සක්රියකාරකය (R)-?-lipoic අම්ලය සමඟ පරිපූරණය කිරීම [83], [84], [85] 3T3-L1 adipocytes [86] තුළ මයිටොකොන්ඩ්රියල් ජෛව උත්පාදනය ප්රවර්ධනය කරයි. මයිටොකොන්ඩ්රිය ජෛව උත්පාදනයේදී න්යෂ්ටික පිටපත් කිරීමේ නියාමක පන්ති දෙකක් තීරණාත්මක කාර්යභාරයක් ඉටු කරයි. පළමු පන්තිය වන්නේ න්යෂ්ටික ශ්වසන සාධක11 සහ 2 වැනි පිටපත් කිරීමේ සාධක වන අතර, එය ශ්වසන සංකීර්ණ පහේ ජාන කේතීකරණ උප ඒකක, මයිටොකොන්ඩ්රියල් පරිවර්තන සංරචක සහ මයිටොකොන්ඩ්රියල් අනුකෘතියට ස්ථානගත කර ඇති හේමේ ජෛව සංස්ලේෂක එන්සයිම වල ප්රකාශනය පාලනය කරයි [88]. Piantadosi et al. [89] පෙන්වා දී ඇත්තේ න්යෂ්ටික ශ්වසන සාධකය 2 හි Nrf1 මත යැපෙන පිටපත් කිරීමේ ඉහළ නියාමනය මයිටොකොන්ඩ්රියල් ජෛව උත්පාදනය ප්රවර්ධනය කරන අතර කාඩියෝටොක්සික් ඇන්ත්රාසයික්ලයින් රසායනික චිකිත්සක කාරක ඩොක්සොරුබිසින් හි සයිටොටොක්සිසිටි භාවයෙන් ආරක්ෂා කරන බවයි. ඊට වෙනස්ව, Zhang et al. [82] Nrf2 හි ජාන සක්රීය කිරීම මුරීන් අක්මාවේ න්යෂ්ටික ශ්වසන සාධකය 1 හි බාසල් mRNA ප්රකාශනයට බලපාන්නේ නැති බව වාර්තා කර ඇත.
මයිටොකොන්ඩ්රිය ජෛව උත්පාදනයේ තීරණාත්මක ක්රියාකාරකම් සහිත න්යෂ්ටික පිටපත් කිරීමේ නියාමකයන්ගේ දෙවන පන්තිය වන්නේ පෙරොක්සිසෝම් ප්රෝලිෆරේටර්-සක්රීය ප්රතිග්රාහක වැනි පිටපත් කිරීමේ කෝක්ටිවේටර් ද? coactivators (PGC)1? සහ 1?, පිටපත් කිරීමේ සාධක, බාසල් පිටපත් කිරීමේ සහ RNA-බෙදීමේ යන්ත්රෝපකරණ සහ histone-modifying enzymes [88], [90], [91] සමඟ අන්තර්ක්රියා කරයි. PGC1 පවුලේ කෝක්ටිවේටර් වල ප්රකාශනය බොහෝ පාරිසරික සංඥා මගින් බලපායි. Nrf2 සක්රියකාරක සල්ෆෝරාපේන් සමඟ මානව ෆයිබ්රොබ්ලාස්ට් ප්රතිකාර කිරීම මයිටොකොන්ඩ්රියල් ස්කන්ධයේ වැඩි වීමක් සහ PGC1 ප්රේරණයට හේතු වේද? සහ PGC1? [92], මෙම අධ්යයනයේදී Nrf2 මත විභව යැපීම පරීක්ෂා කර නොතිබුණද. කෙසේ වෙතත්, දියවැඩියා මීයන් තුළ Nrf2 Keap1 ජාන hypomorphic knockdown (db/db:Keap1flox/?:Nrf2+/+) හෝ කඩාකප්පල් වූ (db/db:Keap1flox/?:Nrf2?/?) මගින් සක්රිය කර ඇති අතර අඩු රක්තපාත PGC1 තිබේද? පාලන සතුන්ට වඩා ප්රකාශන මට්ටම් (db/db:Keap1flox/+:Nrf2+/+) [93]. PGC1 සඳහා mRNA මට්ටම්වල වෙනසක් නැද්ද? WT හෝ Nrf2-KO වන දියවැඩියා නොවන මීයන්ගේ අක්මාවේ දක්නට ලැබේ, නමුත් Nrf2-අධික ප්රකාශන (Keap1-KD සහ අක්මාව-විශේෂිත Keap1-KO) සතුන් තුළ මෙම මට්ටම් අඩුය [82]. සැලකිය යුතු කරුණක් නම්, පැය 24 ක උපවාසයක් PGC1 මට්ටම් වැඩි කරයිද? සියලුම ප්රවේණි වර්ගවල මීයන්ගේ අක්මාවේ mRNA, නමුත් වැඩි වීම WT හෝ Nrf2-අධික ප්රකාශන මීයන් හා සසඳන විට Nrf2-KO අක්මාවේ සැලකිය යුතු ලෙස වැඩි වේ. WT හා සසඳන විට, Nrf2-KO මීයන් සෙප්ටික් ආසාදනයක් හෝ ආසාදනය හේතුවෙන් උග්ර පෙනහළු තුවාලයක් අත්විඳින අතර, න්යෂ්ටික ශ්වසන සාධකය 1 සහ PGC1 හි දුර්වල වූ පිටපත් කිරීමේ ඉහළ නැංවීමක් පෙන්නුම් කරයිද? [94], [95]. එකට, මෙම නිරීක්ෂණ යෝජනා කරන්නේ න්යෂ්ටික ශ්වසන සාධකය 2 සහ PGC1 යන දෙකෙහිම මට්ටම් පවත්වා ගැනීම සඳහා Nrf1 හි කාර්යභාරය බවයි? සංකීර්ණ වන අතර ආතති තත්වයන් යටතේ වඩාත් කැපී පෙනේ.
මයිටොකොන්ඩ්රිය ප්රෝටීන කේතනය කරන ජාන ප්රකාශනයට අමතරව, මයිටොකොන්ඩ්රිය ජෛව උත්පාදනය සඳහා නියුක්ලියෝටයිඩ සංශ්ලේෂණය අවශ්ය වේ. Nrf2 ප්රවේණික සක්රීය කිරීම පෙන්ටෝස් පොස්පේට් මාර්ගය සහ ෆෝලේට් සහ ග්ලූටමින් වල පරිවෘත්තීය නියාමනය කිරීම මගින් පියුරීන් ජෛව සංස්ලේෂණය වැඩි දියුණු කරයි, විශේෂයෙන් ශීඝ්රයෙන් පැතිරෙන සෛලවල (රූපය 2) [24]. මයිටොකොන්ඩ්රියල් සෙරීන්/ත්රෙයොනීන් ප්රෝටීන් kinase PTEN-induced putative kinase 1 (PINK1) සඳහා විකෘති ඩ්රොසෝෆිලා හි පිටපත් කිරීම විශ්ලේෂණය කිරීමෙන් පෙන්නුම් කර ඇත්තේ මයිටොකොන්ඩ්රියල් අක්රියතාව ජානමය ක්රියාවිරහිතභාවය වැඩි දියුණු කිරීමට හේතු වන බවයි. PINK96 ඌනතාවයේ ස්නායු විෂ සහිත ප්රතිවිපාකවලට එරෙහිව ආරක්ෂාව සඳහා යාන්ත්රණයක් නියෝජනය කරයි. Nrf1 මගින් ෆොස්ෆොරිබොසයිල් පයිරොපොස්පේට් ඇමිඩොට්රාන්ස්ෆෙරේස් (PPAT) ප්රකාශනය නියාමනය කරයි, එය de novo purine nucleotide biosynthetic මාර්ගයට ඇතුළුවීම උත්ප්රේරණය කරයි, සහ mitochondrial methylenetetrahydrofolate dehydrogenase 2 (MTHFD2) (රූපය 2). දෙවැන්න ඩිහයිඩ්රොජිනේස් සහ සයික්ලොහයිඩ්රොලේස් ක්රියාකාරකම් සහිත ද්වික්රියාකාරී එන්සයිමයක් වන අතර එය වේගයෙන් වර්ධනය වන සෛලවල පියුරීන් ජෛව සංස්ලේෂණය සඳහා එක් කාබන් ඒකකවල ප්රභවයන් ලෙස ග්ලයිසීන් සහ ෆෝමේට් යන දෙකම සැපයීමේදී ඉතා වැදගත් වේ [2]. එබැවින් Nrf97 සක්රිය කිරීම ආරක්ෂිත විය හැකි අතර PINK2 ඌනතාවයේ මයිටොකොන්ඩ්රියල් අක්රිය වීම ආපසු හැරවිය හැක. ඇත්ත වශයෙන්ම, සල්ෆෝරාපේන් හෝ ට්රයිටර්පෙනොයිඩ් RTA-1 මගින් Nrf2 හි ඖෂධීය සක්රීය කිරීම, ??m ප්රතිසාධනය කරන අතර ඩොපමයින් විෂ වීමෙන් PINK408-අඩු සෛල ආරක්ෂා කරයි [1]. යටින් පවතින යාන්ත්රණයන් සංකීර්ණ බව පෙනුනද, මෙම සොයාගැනීම්වලින් පෙන්නුම් කරන්නේ Nrf98 ක්රියාකාරකම් විවේචනාත්මක පිටපත් කිරීමේ සාධක සහ කෝක්ටිවේටර්වල ප්රකාශන මට්ටම්වලට බලපෑම් කිරීමෙන් මෙන්ම නියුක්ලියෝටයිඩ ජෛව සංස්ලේෂණය වැඩි දියුණු කිරීමෙන් මයිටොකොන්ඩ්රියල් ජෛව උත්පාදනයට බලපෑ හැකි බවයි.
Nrf2 සහ මයිටොකොන්ඩ්රියල් අඛණ්ඩතාව
සෘජු සාක්ෂි සෑම විටම ලබා ගත නොහැකි වුවද, විශේෂයෙන්ම ඔක්සිකාරක ආතතියේ තත්වයන් යටතේ මයිටොකොන්ඩ්රියල් අඛණ්ඩතාව සඳහා Nrf2 වැදගත් වන බවට ප්රබල ඇඟවීම් තිබේ. Nrf2 සක්රියකාරක sulforaphane හි තනි මාත්රාවක් ලබා දුන් මීයන්ගේ මොළයෙන් සහ අක්මාවෙන් හුදකලා වූ මයිටොකොන්ඩ්රියා ඔක්සිකාරක ටෙර්ට්-බියුටයිල්හයිඩ්රොපෙරොක්සයිඩ් [99], [100] මගින් ඇති කරන ලද මයිටොකොන්ඩ්රිය පාරගම්ය සංක්රාන්ති සිදුර (mPTP) විවෘත කිරීමට ප්රතිරෝධී වේ. මයිටොකොන්ඩ්රිය අභ්යන්තර පටලය Da 1500 දක්වා ස්කන්ධ සහිත අණු වලට පාරගම්ය වීමට ඉඩ සලසන සංකීර්ණයක් වන mPTP, F0F1-ATP සින්තේස් [101] ඩිමර් වලින් සෑදෙන බව මෑතකදී හඳුනා ගන්නා ලදී. mPTP විවෘත කිරීමට සල්ෆෝරාපේන්-මැදිහත් වූ ප්රතිරෝධය වැඩි ප්රතිඔක්සිකාරක ආරක්ෂණ සමඟ සහසම්බන්ධ වන අතර මයිටොකොන්ඩ්රියල් GSH මට්ටම, ග්ලූටතයෝන් පෙරොක්සිඩේස් 1, මැලික් එන්සයිම 3, සහ තයෝරෙඩොක්සින් 2 යන සියල්ල මයිටොකොන්ඩ්රියල් භාගවලින් හුදකලා කර ඇත.
මයිටොකොන්ඩ්රියල් ප්රෝටීන් හානිය සහ ඉලෙක්ට්රොෆිලික් ලිපිඩ පෙරොක්සයිඩ් නිෂ්පාදන 4-හයිඩ්රොක්සි-2-නොනොනල් මගින් ඇතිවන ශ්වසන ආබාධ, සල්ෆෝරාපේන්-ප්රතිකාර කළ මීයන්ගේ මස්තිෂ්ක බාහිකයෙන් හුදකලා වූ මයිටොකොන්ඩ්රියාවේ දුර්වල වේ [102]. මීයන්ගේ වකුගඩු එපිටිලියල් සෛලවල සහ වකුගඩු වල, සල්ෆෝරාපේන් සිස්ප්ලැටින් සහ ජෙන්ටාමිසින්-ප්රේරිත විෂ වීම සහ ??m[103], [104] අහිමි වීමෙන් ආරක්ෂා කරයි. ඔක්සිකාරක (සුපිරි ඔක්සයිඩ්, හයිඩ්රජන් පෙරොක්සයිඩ්, පෙරොක්සිනයිට්රයිට්) සහ ඉලෙක්ට්රොෆයිල්ස් (4-හයිඩ්රොක්සි-2-නොනෙනල් සහ ඇක්රොලීන්) පුවරුවකින් ආරක්ෂා වීම සහ මයිටොකොන්ඩ්රියල් ප්රතිඔක්සිකාරක ආරක්ෂණවල වැඩි වීමක් ද සල්ෆෝරාපේන් සමඟ මී ඇරෝටික් සිනිඳු මාංශ පේශි සෛලවලට ප්රතිකාර කිරීමේදී නිරීක්ෂණය වී ඇත. ]. පරස්පර-ප්රේරිත උග්ර වකුගඩු ආබාධ ආකෘතියක් තුළ, GSK105 නිෂේධනයට ප්රතිඵලයක් ලෙස Nrf2 සක්රීය කිරීම මගින් mPTP විවෘත කිරීම සහ මයිටොකොන්ඩ්රිය ඉදිමීම ඇතුළුව ආරක්ෂිත බලපෑම් ඇති බව අත් පා රක්තපාත පූර්වාවශ්යතාව මෑතකදී පෙන්නුම් කරන ලදී. [3].
ක්රියා විරහිත මයිටොකොන්ඩ්රියා ස්වයංක්රීයව වරණාත්මකව ගිල්වා සෛලය මගින් පිරිහීමට සහ ප්රතිචක්රීකරණය කිරීමට ලයිසොසෝම වෙත ලබා දෙන ක්රියාවලිය වන Mitophagy [107], [108] සඳහා අත්යවශ්ය වේ. Nrf2 සහ mitophagy අතර කිසිදු රෝග කාරක සම්බන්ධයක් තහවුරු වී නොමැති අතර, mitophagy හි කාර්යභාරයක් ඉටු කරමින් මයිටොකොන්ඩ්රීය තත්ත්ව පාලනයේදී පිටපත් කිරීමේ සාධකය වැදගත් විය හැකි බවට සාක්ෂි තිබේ. ඔක්සිකාරක ආතතියේ තත්වයන් යටතේ මෙය විශේෂයෙන් කැපී පෙනේ. මේ අනුව, sepsis ආකෘතියක, ස්වයංක්රීය මාර්කර් MAP1 ආලෝක දාමයේ 3-II (LC3-II) මට්ටම්වල වැඩි වීම සහ පැය 62 ක පසු ආසාදනයකදී භාණ්ඩ ප්රෝටීන් p24 WT මීයන්ට සාපේක්ෂව Nrf2-KO හි යටපත් වේ [109] . මයිටොෆාගිහි කුඩා අණු ප්රේරකයක් (p62-මැදිහත් වූ මයිටොෆාගි ප්රේරකය, PMI ලෙස හැඳින්වේ) මෑතකදී සොයා ගන්නා ලදී; මෙම 1,4-ඩයිෆීනයිල්-1,2,3-ට්රයිසෝල් සංයෝගය මුලින් නිර්මාණය කර ඇත්තේ Keap2 [1] සමඟ පිටපත් කිරීමේ සාධකයේ අන්තර් ක්රියාකාරිත්වයට බාධා කරන Nrf110 සක්රියකාරකයක් ලෙසය. Nrf2 ජානමය වශයෙන් නියාමනය කර ඇති සෛල වලට සමාන (Keap1-KD හෝ Keap1-KO), PMI වලට නිරාවරණය වන සෛල වලට වැඩි විවේකයක් ඇත ??m. වැදගත් කරුණක් නම්, WT සෛලවල PMI ප්රතිකාරයෙන් පසුව නිරීක්ෂණය වන මයිටොකොන්ඩ්රියල් LC3 ප්රාදේශීයකරණයේ වැඩි වීම Nrf2-KO සෛල තුළ සිදු නොවන අතර, Nrf2 හි සම්බන්ධය යෝජනා කරයි.
අවසාන වශයෙන්, අක්මා කොටස්වල අති ව්යුහාත්මක විශ්ලේෂණයෙන් හෙළි වී ඇත්තේ සති 2 ක් තිස්සේ අධික මේද සහිත ආහාර ලබා දුන් මීයන් නොව, Nrf24-KO හි හෙපටෝසයිටවල ක්රිස්ටා සහ බාධා වූ පටල සහිත ඉදිමුණු මයිටොකොන්ඩ්රියා ඇති බව ය; විශේෂයෙන්, මෙම අක්මාව ඔක්සිකාරක ආතතිය සහ දැවිල්ල [68] පිළිබඳ පැහැදිලි සාක්ෂි පෙන්වයි. ඔක්සිකාරක සහ ගිනි අවුලුවන ආතති තත්වයන් යටතේ මයිටොකොන්ඩ්රියල් අඛණ්ඩතාව පවත්වා ගැනීම සඳහා Nrf2 තීරණාත්මක කාර්යභාරයක් ඉටු කරන බව නිගමනය කළ හැකිය.
සල්ෆෝරාපේන් සහ පිළිකා, මරණ, වයස්ගත වීම, මොළය සහ හැසිරීම, හෘද රෝග සහ තවත් දේ කෙරෙහි එහි බලපෑම්
Isothiocyanates යනු ඔබේ ආහාර වේලට ලබා ගත හැකි වැදගත්ම ශාක සංයෝග කිහිපයකි. මෙම වීඩියෝවෙන් මම ඔවුන් සඳහා මෙතෙක් කර ඇති වඩාත්ම සවිස්තරාත්මක නඩුව ඉදිරිපත් කරමි. කෙටි අවධානයක්? පහත කාල ලක්ෂ්යවලින් එකක් ක්ලික් කිරීමෙන් ඔබේ ප්රියතම මාතෘකාව වෙත යන්න. සම්පූර්ණ කාලසටහන පහතින්.
ප්රධාන කොටස්:
- 00:01:14 - පිළිකා සහ මරණ
- 00:19:04 - වයසට යාම
- 00:26:30 - මොළය සහ හැසිරීම
- 00:38:06 - අවසාන නැවත බැලීම
- 00:40:27 - මාත්රාව
සම්පූර්ණ කාලරේඛාව:
- 00:00:34 - වීඩියෝවේ ප්රධාන අවධානයක් වන සල්ෆෝරාපේන් හඳුන්වාදීම.
- 00:01:14 - කුරුස එළවළු පරිභෝජනය සහ සියලු හේතු මරණ අනුපාතය අඩු කිරීම.
- 00:02:12 - පුරස්ථි පිළිකා අවදානම.
- 00:02:23 - මුත්රාශයේ පිළිකා අවදානම.
- 00:02:34 - දුම් පානය කරන්නන්ගේ පෙනහළු පිළිකා අවදානම.
- 00:02:48 - පියයුරු පිළිකා අවදානම.
- 00:03:13 - උපකල්පිත: ඔබට දැනටමත් පිළිකාවක් ඇත්නම් කුමක් කළ යුතුද? (මැදිහත්වීමේ)
- 00:03:35 - පිළිකා සහ මරණ අනුබද්ධ දත්ත මෙහෙයවන පිළිගත හැකි යාන්ත්රණය.
- 00:04:38 - Sulforaphane සහ පිළිකා.
- 00:05:32 - මීයන්ගේ මුත්රාශයේ ගෙඩි වර්ධනයට බ්රොකොලි පැළ නිස්සාරණයේ ප්රබල බලපෑමක් පෙන්නුම් කරන සත්ව සාක්ෂි.
- 00:06:06 - පුරස්ථි ග්රන්ථියේ පිළිකා රෝගීන් සඳහා සල්ෆෝරාපේන් සෘජුවම ලබා දීමේ බලපෑම.
- 00:07:09 - සැබෑ පියයුරු පටක වල isothiocyanate පරිවෘත්තීය ජෛව සමුච්චනය.
- 00:08:32 - පියයුරු පිළිකා ප්රාථමික සෛල නිෂේධනය කිරීම.
- 00:08:53 - ඉතිහාස පාඩම: පුරාණ රෝමයේ පවා බ්රැසිකා සෞඛ්ය ගුණාංග ඇති බව තහවුරු විය.
- 00:09:16 - පිළිකා කාරක බැහැර කිරීම (බෙන්සීන්, ඇක්රොලීන්) වැඩි දියුණු කිරීමට සල්ෆෝරාපේන්ගේ හැකියාව.
- 00:09:51 - NRF2 ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය හරහා ජානමය ස්විචයක් ලෙස.
- 00:10:10 - NRF2 සක්රිය කිරීම glutathione-S-conjugates හරහා පිළිකා කාරක පිටකිරීම වැඩි දියුණු කරන ආකාරය.
- 00:10:34 - Brussels sprouts glutathione-S-transferase වැඩි කරන අතර DNA හානි අඩු කරයි.
- 00:11:20 - Broccoli sprout පානය බෙන්සීන් බැහැර කිරීම 61% කින් වැඩි කරයි.
- 00:13:31 – Broccoli sprout homogenate ඉහළ ශ්වසන මාර්ගයේ ප්රතිඔක්සිකාරක එන්සයිම වැඩි කරයි.
- 00:15:45 - කුරුස එළවළු පරිභෝජනය සහ හෘද රෝග මරණ.
- 00:16:55 - බ්රොකොලි පැළ කුඩු 2 වර්ගයේ දියවැඩියා රෝගීන්ගේ රුධිර ලිපිඩ සහ සමස්ත හෘද රෝග අවදානම වැඩි දියුණු කරයි.
- 00:19:04 - වයසට යාමේ අංශයේ ආරම්භය.
- 00:19:21 - සල්ෆෝරාපේන් බහුල ආහාර කුරුමිණියන්ගේ ආයු කාලය 15 සිට 30% දක්වා වැඩි කරයි (ඇතැම් තත්වයන් යටතේ).
- 00:20:34 - දිගුකාලීන පැවැත්ම සඳහා අඩු දැවිල්ලක වැදගත්කම.
- 00:22:05 - කුරුස එළවළු සහ බ්රොකොලි පැළ කුඩු මිනිසුන් තුළ විවිධාකාර ගිනි අවුලුවන සලකුණු අඩු කරන බව පෙනේ.
- 00:23:40 - මැද-වීඩියෝ නැවත බැලීම: පිළිකා, වයස්ගත කොටස්
- 00:24:14 - මවුස් අධ්යයනයන් යෝජනා කරන්නේ සල්ෆෝරාපේන් මහලු වියේදී අනුවර්තන ප්රතිශක්තිකරණ ක්රියාකාරිත්වය වැඩි දියුණු කළ හැකි බවයි.
- 00:25:18 - සල්ෆෝරාපේන් තට්ටය දැමීමේ මූසික ආකෘතියක හිසකෙස් වර්ධනය වැඩි දියුණු කළේය. පින්තූරය 00:26:10 ට.
- 00:26:30 - මොළයේ සහ හැසිරීම් අංශයේ ආරම්භය.
- 00:27:18 - ඔටිසම් මත බ්රොකොලි පැළ සාරය බලපෑම.
- 00:27:48 - භින්නෝන්මාදය මත ග්ලූකෝරෆනින් වල බලපෑම.
- 00:28:17 - අවපාත සාකච්ඡාවේ ආරම්භය (පිළිගත හැකි යාන්ත්රණය සහ අධ්යයන).
- 00:31:21 – ආතති-ප්රේරිත මානසික අවපීඩනයේ විවිධ මාදිලි 10 ක් භාවිතා කරමින් මූසික අධ්යයනය සල්ෆෝරාපේන් ෆ්ලෝක්සෙටීන් (ප්රෝසාක්) හා සමානව ඵලදායී බව පෙන්වයි.
- 00:32:00 - අධ්යයනයෙන් පෙන්නුම් කරන්නේ මීයන් තුළ ග්ලූකෝරෆනින් සෘජුවම ශරීරගත වීම සමාජ පරාජයේ ආතති ආකෘතියෙන් මානසික අවපීඩනය වැළැක්වීමට සමානව ඵලදායී බවයි.
- 00:33:01 - neurodegeneration අංශයේ ආරම්භය.
- 00:33:30 - සල්ෆෝරාපේන් සහ ඇල්සයිමර් රෝගය.
- 00:33:44 - සල්ෆෝරාපේන් සහ පාකින්සන් රෝගය.
- 00:33:51 - Sulforaphane සහ Hungtington's රෝගය.
- 00:34:13 - Sulforaphane තාප කම්පන ප්රෝටීන වැඩි කරයි.
- 00:34:43 - කම්පන සහගත මොළයේ තුවාල අංශයේ ආරම්භය.
- 00:35:01 - TBI මතකය වැඩි දියුණු කළ වහාම Sulforaphane එන්නත් කිරීම (මූසික අධ්යයනය).
- 00:35:55 - Sulforaphane සහ නියුරෝන ප්ලාස්ටික්.
- 00:36:32 - සල්ෆෝරාපේන් මීයන් තුළ II වර්ගයේ දියවැඩියා ආකෘතියේ ඉගෙනීම වැඩි දියුණු කරයි.
- 00:37:19 - Sulforaphane සහ duchenne මස්කියුලර් ඩිස්ට්රොෆි.
- 00:37:44 - මාංශ පේශි චන්ද්රිකා සෛලවල Myostatin නිෂේධනය (in vitro).
- 00:38:06 - ප්රමාද වීඩියෝ පුනරුච්චාරණය: මරණ සහ පිළිකා, DNA හානි, ඔක්සිකාරක ආතතිය සහ දැවිල්ල, බෙන්සීන් බැහැර කිරීම, හෘද වාහිනී රෝග, දෙවන වර්ගයේ දියවැඩියාව, මොළයට බලපෑම් (මානසික අවපීඩනය, ඔටිසම්, භින්නෝන්මාදය, ස්නායු විකෘති වීම), NRF2 මාර්ගය.
- 00:40:27 - බ්රොකොලි පැළ හෝ සල්ෆෝරාපේන් මාත්රාවක් සොයා ගැනීම පිළිබඳ සිතුවිලි.
- 00:41:01 - නිවසේ පැළවීම පිළිබඳ කථා.
- 00:43:14 - පිසීමේ උෂ්ණත්වය සහ සල්ෆෝරාපේන් ක්රියාකාරිත්වය මත.
- 00:43:45 - ග්ලූකෝරෆනින් වලින් සල්ෆෝරාපේන් බඩවැල් බැක්ටීරියාව පරිවර්තනය කිරීම.
- 00:44:24 - එළවළු වලින් සක්රීය මයිරොසිනේස් සමඟ සංයෝජිතව ඇති විට අතිරේක හොඳින් ක්රියා කරයි.
- 00:44:56 - පිසීමේ ශිල්පීය ක්රම සහ කුරුස එළවළු.
- 00:46:06 - Goitrogens ලෙස Isothiocyanates.

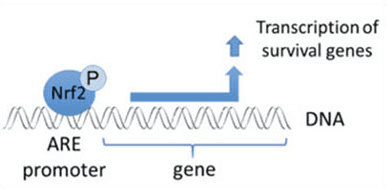
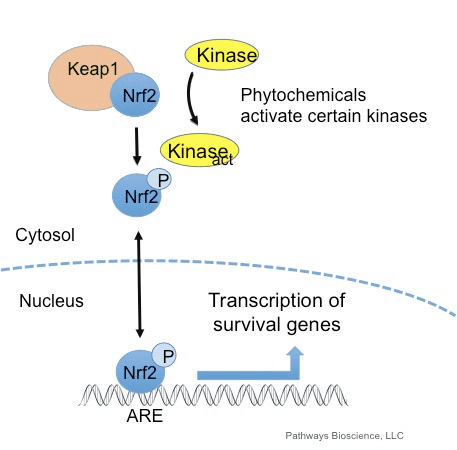
Nrf2 යනු මිනිස් සිරුරේ සෛලීය ප්රතිඔක්සිකාරක ආරක්ෂක පද්ධතියේ වැදගත් කාර්යභාරයක් ඉටු කරන පිටපත් කිරීමේ සාධකයකි. ප්රතිඔක්සිකාරක ප්රතිචාරාත්මක මූලද්රව්ය නොහොත් ARE යනු ජානවල නියාමන යාන්ත්රණයකි. බොහෝ පර්යේෂණ අධ්යයනයන් මගින් පෙන්නුම් කර ඇත්තේ Nrf2, හෝ NF-E2-ආශ්රිත සාධකය 2, සෛල වර්ග කිහිපයක් පුරා ARE-ධාවනය කරන ලද ජාන රාශියක් නියාමනය කරන බවයි. Nrf2 සෛලීය ආරක්ෂණය සහ පිළිකා නාශක කාරකය සඳහා අත්යවශ්ය කාර්යභාරයක් ඉටු කරන බව සොයා ගන්නා ලදී, එයින් පෙන්නුම් කරන්නේ Nrf2 ඔක්සිකාරක ආතතිය නිසා ඇති වන ස්නායු විකෘතිතා රෝග සහ පිළිකා කළමනාකරණය සඳහා ඵලදායී ප්රතිකාරයක් විය හැකි බවයි. ආචාර්ය ඇලෙක්ස් ජිමිනෙස් ඩීසී, සීසීඑස්ටී ඉන්සයිට්
සමාප්ති සටහන්
බොහෝ ප්රශ්න තවමත් විවෘතව පවතින නමුත්, පවතින පර්යේෂණාත්මක සාක්ෂි පැහැදිලිව පෙන්නුම් කරන්නේ මයිටොකොන්ඩ්රියල් හෝමියස්ටැසිස් සහ ව්යුහාත්මක අඛණ්ඩතාව පවත්වා ගැනීම සඳහා Nrf2 වැදගත් ක්රීඩකයෙකු බවයි. Nrf2-මැදිහත් වූ සයිටොප්රොටෙක්ටිව් ප්රතිචාර ඉහළ නැංවීමේ හැකියාව සෛලයේ සහ ජීවියාගේ සමස්ත සෞඛ්යයට සහ පැවැත්මට බලපාන විට ඔක්සිකාරක, විද්යුත් භෞතික සහ ගිනි අවුලුවන ආතතිය යටතේ මෙම භූමිකාව විශේෂයෙන් තීරණාත්මක වේ. මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වයේ Nrf2 හි කාර්යභාරය මෙම පිටපත් කිරීමේ සාධකය මගින් සංවිධානය කරන ලද පුළුල් සයිටොප්රොටෙක්ටිව් යාන්ත්රණවල තවත් ස්ථරයක් නියෝජනය කරයි. බොහෝ මානව ව්යාධිජනක තත්වයන් ඔක්සිකාරක ආතතිය, දැවිල්ල සහ මයිටොකොන්ඩ්රියල් අක්රියතාව ඒවායේ ව්යාධිජනකයේ අත්යවශ්ය සංරචක වන බැවින්, Nrf2 හි ඖෂධීය සක්රීය කිරීම රෝග වැළැක්වීම සහ ප්රතිකාර සඳහා පොරොන්දුවක් දරයි. Nrf2 මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වයට බලපාන නිශ්චිත යාන්ත්රණයන් පිළිබඳ සවිස්තරාත්මක අවබෝධයක් අනාගත සායනික අත්හදා බැලීම් තාර්කිකව සැලසුම් කිරීම සඳහා අත්යවශ්ය වන අතර චිකිත්සක කාර්යක්ෂමතාව නිරීක්ෂණය කිරීම සඳහා නව ජෛව සලකුණු ඉදිරිපත් කළ හැකිය.
අනුමත කර
Sciencedirect.com/science/article/pii/S0891584915002129
ඉහත ලිපියේ අරමුණ වූයේ මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වයේ Nrf2 හි මතුවෙමින් පවතින භූමිකාව සාකච්ඡා කිරීම මෙන්ම ප්රදර්ශනය කිරීමයි. Nrf2, හෝ න්යෂ්ටික සාධකය එරිත්රොයිඩ් 2 ආශ්රිත සාධකය, ඔක්සිකාරක ආතතියට දායක විය හැකි ඔක්සිකාරක වලට සෛලීය ප්රතිරෝධයේ නැගී එන නියාමකය වන අතර එය සෛලීය ක්රියාකාරිත්වයට බලපාන අතර විෂ වීම, නිදන්ගත රෝග සහ පිළිකා පවා වර්ධනය වීමට තුඩු දෙයි. මිනිස් සිරුරේ ඔක්සිකාරක නිෂ්පාදනය සෛල බෙදීම, දැවිල්ල, ප්රතිශක්තිකරණ ක්රියාකාරිත්වය, ස්වයංක්රීයකරණය සහ ආතති ප්රතිචාරය ඇතුළු විවිධ අරමුණු සඳහා සේවය කළ හැකි නමුත් සෞඛ්ය ගැටලු වළක්වා ගැනීම සඳහා ඒවායේ අධික නිෂ්පාදනය පාලනය කිරීම අත්යවශ්ය වේ. අපගේ තොරතුරු වල විෂය පථය චිරොක්ට්රැක්ටික් සහ කොඳු ඇට පෙළේ සෞඛ්ය ගැටළු වලට සීමා වේ. විෂය කරුණු සාකච්ඡා කිරීමට, කරුණාකර වෛද්ය ජිමිනෙස්ගෙන් විමසීමට හෝ අපව අමතන්න915-850-0900 .
ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස් විසින් පාලනය කරන ලදී
යොමු කර ඇත්තේ: Sciencedirect.com
අතිරේක මාතෘකා සාකච්ඡාව: උග්ර පිටුපස වේදනාව
ආපහු වේදනාවආබාධිතභාවයට සහ ලොව පුරා වැඩ කරන දින මග හැරීමට වඩාත් පොදු හේතුවකි. වෛද්ය කාර්යාල චාරිකා සඳහා දෙවන වඩාත් පොදු හේතුව පිටුපස වේදනාව ආරෝපණය කරයි, ඉහළ ශ්වසන ආසාදනවලින් පමණක් වැඩි වේ. ජනගහනයෙන් ආසන්න වශයෙන් සියයට 80 ක් පමණ ඔවුන්ගේ ජීවිත කාලය පුරාම අවම වශයෙන් එක් වරක්වත් කොන්දේ වේදනාව අත්විඳිනු ඇත. කොඳු ඇට පෙළ යනු අනෙකුත් මෘදු පටක අතර අස්ථි, සන්ධි, බන්ධන සහ මාංශ පේශි වලින් සමන්විත සංකීර්ණ ව්යුහයකි. මේ නිසා, තුවාල සහ/හෝ උග්ර වූ තත්වයන්, වැනිහර්නිටීස් තැටි, අවසානයේ පිටුපස වේදනාවේ රෝග ලක්ෂණ ඇති විය හැක. ක්රීඩා තුවාල හෝ මෝටර් රථ අනතුරු තුවාල බොහෝ විට පිටුපස වේදනාව සඳහා නිතර නිතර හේතුව වේ, කෙසේ වෙතත්, සමහර විට සරලම චලනයන් වේදනාකාරී ප්රතිඵල ඇති විය හැක. වාසනාවකට මෙන්, චිරොක්ට්රැක්ටික් සත්කාර වැනි විකල්ප ප්රතිකාර විකල්පයන්, කොඳු ඇට පෙළ ගැලපීම් සහ අතින් හැසිරවීම් භාවිතයෙන් පිටුපස වේදනාව සමනය කිරීමට උපකාරී වන අතර අවසානයේ වේදනාව සහන වැඩි දියුණු කරයි. �
***
by ආචාර්ය ඇලෙක්ස් ජිමිනෙස් | නිදන්ගත වේදනාව, විෂාදිය, ක්රියාකාරී වෛද්ය විද්යාව, සෞඛ්යය, බෙහෙත් වෛද්ය විද්යාව, ඔක්සිකාරක ආතතිය, පිළියම්, පර්යේෂණ අධ්යයන, ප්රතිකාර, සුවතාව
Nrf2 ඇල්සයිමර් රෝගය වැනි ඔක්සිකාරක ආතතිය වැඩි වීම හා සම්බන්ධ සෞඛ්ය ගැටළු වල බලපෑමෙන් මිනිස් සිරුර ආරක්ෂා කරන ප්රතිඔක්සිකාරක සහ ඩෙටොක්සිෆයිං එන්සයිම සහ ජාන සමූහයක් සක්රීය කිරීමට සහාය වේ. Nrf2 මාර්ගය සක්රීය කිරීම සඳහා විවිධ ස්වාභාවික ද්රව්ය ප්රදර්ශනය කර ඇත, එය ස්නායු විකෘති රෝග වල රෝග ලක්ෂණ කළමනාකරණය කිරීමට උපකාරී වේ. පහත ලිපියේ අරමුණ වන්නේ නිදන්ගත දැවිල්ල නිසා ඇති වන Nrf2 හි ප්රධාන භූමිකාව සාකච්ඡා කිරීමයි.
වියුක්ත
පිළිකා කාරකයේ තීරණාත්මක භූමිකාවන් ඉටු කරන අතරම, බොහෝ නිදන්ගත රෝග සහ සංකූලතා වල වඩාත් පොදු ලක්ෂණය වන්නේ දැවිල්ලයි. ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්යය (ARE) හරහා ගිනි අවුලුවන සෛල බඳවා ගැනීම සහ ජාන ප්රකාශනය නියාමනය කිරීම මගින් Nrf2 ප්රති-ගිනි අවුලුවන ක්රියාවලියට දායක වන බව අධ්යයන කිහිපයක් පෙන්නුම් කර ඇත. Keap1 (Kelch වැනි ECH-ආශ්රිත ප්රෝටීන්)/Nrf2 (NF-E2 p45-ආශ්රිත සාධකය 2)/ARE සංඥා මාර්ගය ප්රධාන වශයෙන් ප්රති-ගිනි අවුලුවන ජාන ප්රකාශනය නියාමනය කරන අතර ප්රදාහයේ ප්රගතිය වළක්වයි. එබැවින් නව Nrf2 මත යැපෙන ප්රති-ගිනි අවුලුවන ශාක රසායන හඳුනා ගැනීම ඖෂධ සොයාගැනීමේ ප්රධාන කරුණක් බවට පත්ව ඇත. මෙම සමාලෝචනයේදී, අපි Keap1/Nrf2/ARE සංඥා මාර්ගයෙහි සාමාජිකයන් සහ එහි පහළ ප්රවාහයේ ජාන, ගිනි අවුලුවන රෝග පිළිබඳ සත්ව ආකෘතීන් මත මෙම මාර්ගයෙහි බලපෑම සහ NF-?B මාර්ගය සමඟ හරස් කථා සාකච්ඡා කරමු. ඊට අමතරව NRf3 මගින් NLRP2 ගිනි අවුලුවන නියාමනය ගැන ද අපි සාකච්ඡා කරමු. මෙයට අමතරව, Nrf2/ARE සංඥා මාර්ගයට මැදිහත් වන ප්රති-ගිනි අවුලුවන ෆයිටොකෙමිකල් සහ අනෙකුත් සංවර්ධනයේ වර්තමාන තත්ත්වය අපි සාරාංශ කරමු.
ප්රධාන වචන: Nrf2, Keap1, ARE, දැවිල්ල, ඔක්සිකාරක ආතතිය, ශාක රසායන
කෙටි යෙදුම්
Sciencedirect.com/science/article/pii/S0925443916302861#t0005
හැදින්වීම
ප්රදාහය යනු ව්යාධිජනක, හානි හෝ කුපිත කිරීම් වැනි හානිකර උත්තේජක මගින් පටක ආසාදනය වූ විට හෝ තුවාල වූ විට ඇතිවන සංකීර්ණ ක්රියාවලියකි. ප්රතිශක්තිකරණ සෛල, රුධිර නාල සහ අණුක මැදිහත්කරුවන් මෙම ආරක්ෂිත ප්රතිචාරයට සම්බන්ධ වේ [1]. ප්රදාහය යනු ප්රධාන වශයෙන් භෞතික, රසායනික, ජීව විද්යාත්මක සහ මනෝවිද්යාත්මක සාධක මගින් ප්රේරණය වන විවිධ රෝග තත්ත්වයන් සමඟ සම්බන්ධ වූ ව්යාධිජනක සංසිද්ධියකි. දැවිල්ලේ අරමුන වන්නේ සෛලීය හානිවලට හේතු සීමා කිරීම සහ ඉවත් කිරීම, නික්රෝටික් සෛල සහ පටක පිරිසිදු කිරීම සහ/හෝ අවශෝෂණය කිරීම සහ පටක අලුත්වැඩියාව ආරම්භ කිරීමයි. දැවිල්ලෙහි විවිධ ආකාර දෙකක් වෙන්කර හඳුනාගත හැකිය: උග්ර සහ නිදන්ගත. උග්ර ප්රදාහය ස්වයං-සීමාකාරී වන අතර ධාරකයාට ප්රයෝජනවත් වේ, නමුත් දිගුකාලීන නිදන්ගත දැවිල්ල බොහෝ නිදන්ගත රෝග සහ සංකූලතා වල පොදු ලක්ෂණයකි. මොනොසයිට්, මැක්රෝෆේජ්, ලිම්ෆොසයිට් සහ ප්ලාස්මා සෛල වැනි බොහෝ ඒක න්යෂ්ටික ප්රතිශක්තිකරණ සෛල සෘජුව ඇතුල් වීම මෙන්ම ගිනි අවුලුවන සයිටොකයින් නිපදවීම නිදන්ගත දැවිල්ලට හේතු වේ. පිළිකා කාරකය තුළ නිදන්ගත දැවිල්ල තීරණාත්මක කාර්යභාරයක් ඉටු කරන බව හඳුනාගෙන ඇත [2]. සාමාන්යයෙන්, ප්රෝ- සහ ප්රති-ගිනි අවුලුවන සංඥා මාර්ග දෙකම සාමාන්ය ගිනි අවුලුවන ක්රියාවලිය තුළ අන්තර් ක්රියා කරයි.
ව්යාධිජනක ගිනි අවුලුවන ක්රියාවලියේදී, මාස්ට් සෛල, මොනොසයිට්, මැක්රෝෆේජ්, ලිම්ෆොසයිට් සහ අනෙකුත් ප්රතිශක්තිකරණ සෛල මුලින්ම ක්රියාත්මක වේ. එවිට සෛල තුවාල වූ ස්ථානයට බඳවා ගනු ලැබේ, එහි ප්රතිඵලයක් ලෙස DNA ඇතුළු සාර්ව අණු වලට හානි කරන ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ (ROS) ජනනය වේ. ඒ අතරම, මෙම ගිනි අවුලුවන සෛල සයිටොකයින්, කෙමොකයින් සහ ප්රොස්ටැග්ලැන්ඩින් වැනි ගිනි අවුලුවන මැදිහත්කරුවන් විශාල ප්රමාණයක් නිෂ්පාදනය කරයි. මෙම මැදිහත්කරුවන් තවදුරටත් ප්රදාහය ඇති ස්ථාන වෙත මැක්රෝෆේජ් බඳවා ගන්නා අතර දැවිල්ලට සම්බන්ධ බහු සංඥා සම්ප්රේෂණ කඳුරැල්ල සහ පිටපත් කිරීමේ සාධක සෘජුවම සක්රීය කරයි. NF-?B (න්යෂ්ටික සාධකය kappa B), MAPK (mitogen-activated protein kinase), සහ JAK (janus kinase)-STAT (සංඥා පරිවර්තක සහ පිටපත් කිරීමේ සක්රියකාරක) සංඥා මාර්ග දැවිල්ලේ සම්භාව්ය මාර්ගය වර්ධනයට සම්බන්ධ වේ. [3], [4], [5]. පිටපත් කිරීමේ සාධකය Nrf2 (NF-E2 p45-අදාළ සාධකය 2) NADPH, NAD(P)H ක්විනෝන් ඔක්සිඩෝඩෙක්ටේස් 1, ග්ලූටතයෝන් පෙරොක්සිඩේස්, ෆෙරිටින්, හේම් ඔක්සිජන්-1 ඇතුළුව II අදියර විෂහරණ එන්සයිමවල ප්රකාශනය නියාමනය කරන බව පෙර අධ්යයනයන් මගින් අනාවරණය කර ඇත. -1), සහ ඒවායේ ප්රති-ගිනි අවුලුවන බලපෑම් හරහා විවිධ තුවාල වලින් සෛල ආරක්ෂා කරන ප්රතිඔක්සිකාරක ජාන, එමඟින් රෝගයේ ගමන් මගට බලපෑම් කරයි [6], [7], [8].
මෙම කැපී පෙනෙන සොයාගැනීම් සැලකිල්ලට ගනිමින්, සංඥා මාර්ග හරහා ගිනි අවුලුවන රෝග සඳහා ඉලක්කගත චිකිත්සක ඖෂධ සංවර්ධනය කිරීම මෑත වසරවල වැඩි උනන්දුවක් ඇති කර ඇත. මෙම සමාලෝචනයේදී, අපි Keap1 (Kelch වැනි ECH ආශ්රිත ප්රෝටීන්)/Nrf2 (NF-E2 p45-ආශ්රිත සාධකය 2)/ARE (ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය) දැවිල්ලේ සංඥා මාර්ගය පිළිබඳ පර්යේෂණ සාරාංශ කරමු.
Nrf2 හි ව්යුහය සහ නියාමනය
Keap1-යැපෙන Nrf2 නියාමනය
Nrf2 Cap né Collar (CNC) උප පවුලට අයත් වන අතර, Neh (Nrf2-ECH homology) 1 සිට Neh7 [9], [10] දක්වා ක්රියාකාරී වසම් හතකින් සමන්විත වේ. Neh1 යනු CNC-bZIP වසමකි, එය Nrf2 හට කුඩා musculoaponeurotic fibrosarcoma (Maf) ප්රෝටීන්, DNA, සහ අනෙකුත් පිටපත් කිරීමේ හවුල්කරුවන් සමඟ විෂමකරණය කිරීමට මෙන්ම ubiquitin-conjugating enzyme UbcM2 [11] සමඟ න්යෂ්ටික සංකීර්ණයක් සෑදීමට ඉඩ සලසයි. Neh12 හි DLG සහ ETGE ලෙස හැඳින්වෙන වැදගත් මෝස්තර දෙකක් අඩංගු වන අතර ඒවා Nrf2 සහ එහි සෘණ නියාමක Keap2 [1], [13] අතර අන්තර්ක්රියා සඳහා අත්යවශ්ය වේ.
Keap1 යනු කූලින් මත පදනම් වූ E3 ubiquitin ligase සඳහා උපස්ථර ඇඩැප්ටරයකි, එය සාමාන්ය තත්ත්වයන් යටතේ [2], [15], [16] සෑම තැනකම පැතිරීම සහ ප්රෝටීසෝමල් ක්ෂය වීම හරහා Nrf17 හි පිටපත් කිරීමේ ක්රියාකාරකම් වළක්වයි. Keap1 homodimer හි KELCH වසම් සයිටොසෝල් හි Nrf2-Neh2 වසමෙහි DLG සහ ETGE මෝස්තර සමඟ බන්ධනය වේ, එහිදී ETGE ඉහළ බැඳීමක් සහිත hinge එකක් ලෙස ක්රියා කරන අතර DLG අගුලක් ලෙස ක්රියා කරයි [18]. ඔක්සිකාරක ආතතිය යටතේ හෝ Nrf2 සක්රියකාරකවලට නිරාවරණය වීමේදී, Keap2 cysteine අපද්රව්යවල තයෝල් වෙනස් කිරීම හේතුවෙන් Nrf1 Keap1 බන්ධනයෙන් විඝටනය වන අතර එය අවසානයේ Nrf2 සර්වප්රකාර වීම සහ ප්රෝටීසෝම පරිහානිය වළක්වයි [19]. එවිට Nrf2 න්යෂ්ටිය තුළට පරිවර්තනය කරයි, කුඩා Maf ප්රෝටීන සමඟ විෂමකරණය කරයි, සහ ජානවල ARE බැටරියක් පරිවර්තන කරයි (රූපය 1A). Neh3 හි කාබොක්සි-පර්යන්තය CHD6 (chromo-ATPase/helicase DNA බන්ධන ප්රෝටීනය) [20] ලෙස හඳුන්වන පිටපත් කිරීමේ සම-සක්රියකාරකය සමඟ අන්තර්ක්රියා කිරීමෙන් පරිවර්තන වසමක් ලෙස ක්රියා කරයි. Neh4 සහ Neh5 ද පරිවර්තන වසම් ලෙස ක්රියා කරයි, නමුත් CBP (cAMP-ප්රතිචාර-මූලද්රව්ය-බන්ධන ප්රෝටීන්-බන්ධන ප්රෝටීන්) ලෙස හඳුන්වන වෙනත් පිටපත් කිරීමේ සම-සක්රියකාරකයකට බැඳී ඇත [21]. එපමනක් නොව, Neh4 සහ Neh5 න්යෂ්ටික සහකාරක RAC3/AIB1/SRC-3 සමඟ අන්තර් ක්රියා කරයි, එය වැඩිදියුණු කරන ලද Nrf2-ඉලක්කගත ARE ජාන ප්රකාශනයට [22] මග පාදයි. Neh5 සතුව රෙඩොක්ස්-සංවේදී න්යෂ්ටික අපනයන සංඥාවක් ඇති අතර එය Nrf2 [23] නියාමනය සහ සෛලීය ස්ථානගත කිරීම සඳහා තීරණාත්මක වේ.
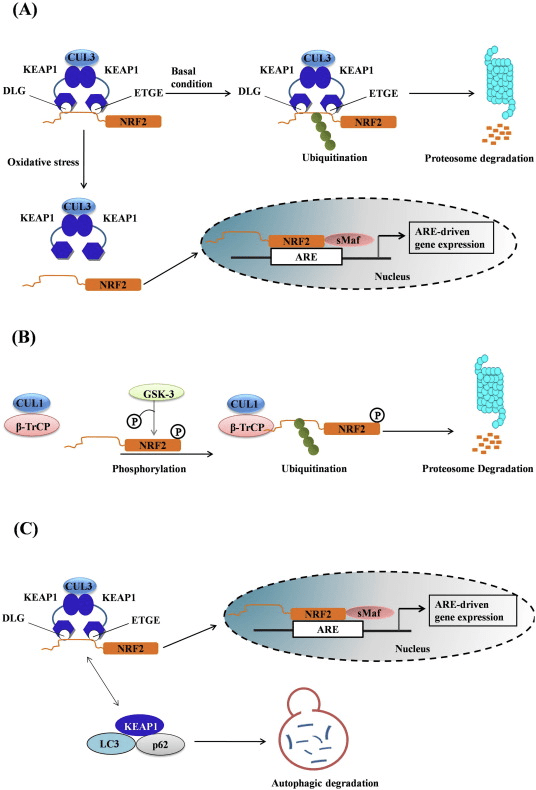 රූපය 1 Keap1 මත රඳා පවතින සහ Nrf2 හි ස්වාධීන නියාමනය. (A) මූලික තත්ත්වයන් යටතේ, Nrf2 එහි motifs දෙක (ETGE සහ DLG) මගින් Keap1 සමඟ වෙන් කර ඇති අතර එය CUL3-මැදිහත් වූ සර්ව ව්යාප්තියට පසුව ප්රෝටේසෝම පරිහානියට මග පාදයි. ඔක්සිකාරක ආතතිය යටතේ, Nrf2 Keap1 වෙතින් විඝටනය වී, න්යෂ්ටිය වෙත මාරු වී ARE-ජාන බැටරිය සක්රීය කරයි. (B) GSK3 ෆොස්ෆොරයිලේට් Nrf2 වන අතර මෙය CUL2-මැදිහත් වූ සර්වජනනය සහ පසුව ප්රෝටීසෝම පරිහානිය සඳහා ?-TrCP මගින් Nrf1 හඳුනාගැනීම පහසු කරයි. (C) p62 Keap1 සමඟ වෙන් කර ඇති අතර, එහි ස්වයංක්රීය පරිහානියට, Nrf2 මුදා හැරීමට සහ Nrf2 සංඥා වැඩි කිරීමට හේතු වේ.
රූපය 1 Keap1 මත රඳා පවතින සහ Nrf2 හි ස්වාධීන නියාමනය. (A) මූලික තත්ත්වයන් යටතේ, Nrf2 එහි motifs දෙක (ETGE සහ DLG) මගින් Keap1 සමඟ වෙන් කර ඇති අතර එය CUL3-මැදිහත් වූ සර්ව ව්යාප්තියට පසුව ප්රෝටේසෝම පරිහානියට මග පාදයි. ඔක්සිකාරක ආතතිය යටතේ, Nrf2 Keap1 වෙතින් විඝටනය වී, න්යෂ්ටිය වෙත මාරු වී ARE-ජාන බැටරිය සක්රීය කරයි. (B) GSK3 ෆොස්ෆොරයිලේට් Nrf2 වන අතර මෙය CUL2-මැදිහත් වූ සර්වජනනය සහ පසුව ප්රෝටීසෝම පරිහානිය සඳහා ?-TrCP මගින් Nrf1 හඳුනාගැනීම පහසු කරයි. (C) p62 Keap1 සමඟ වෙන් කර ඇති අතර, එහි ස්වයංක්රීය පරිහානියට, Nrf2 මුදා හැරීමට සහ Nrf2 සංඥා වැඩි කිරීමට හේතු වේ.
Keap1-ස්වාධීන Nrf2 නියාමනය
නැගී එන සාක්ෂි මගින් Keap2 න් ස්වාධීන වන Nrf1 නියාමනයේ නව යාන්ත්රණයක් අනාවරණය කර ඇත. Nrf6 හි සෙරීන්-පොහොසත් Neh2 වසම එහි motifs දෙක (DSGIS සහ DSAPGS) සමඟ ?-transducin repeat-containing protein (?-TrCP) වෙත බැඳීමෙන් තීරණාත්මක කාර්යභාරයක් ඉටු කරයි [24]. ?-TrCP යනු Skp1′Cul1′Rbx1/Roc1 ubiquitin ligase සංකීර්ණය සඳහා වන උපස්ථර ප්රතිග්රාහකයක් වන අතර එය Nrf2 සෑම තැනකම පැතිරීම සහ ප්රෝටීසෝම පරිහානිය සඳහා ඉලක්ක කරයි. Glycogen synthase kinase-3 යනු Keap1-ස්වාධීන Nrf2 ස්ථායීකරණය සහ නියාමනය සඳහා සම්බන්ධ වන තීරණාත්මක ප්රෝටීනයකි; එය ?-TrCP මගින් Nrf2 හඳුනාගැනීම පහසු කිරීම සඳහා Neh6 වසම තුළ Nrf2 පොස්පරීකරණය කරයි [25] (රූපය 1B).
අනෙකුත් Nrf2 නියාමකයින්
තවත් සාක්ෂි මාලාවක් මගින් p62 මත රඳා පවතින Nrf2 සක්රීය කිරීමේ කැනොනිකල් නොවන මාර්ගයක් අනාවරණය කර ඇත 62], [1] (රූපය 2C).
Nrf2 ක්රියාකාරකම් නියාමනය කිරීමේදී miRNA කිහිපයක් වැදගත් කාර්යභාරයක් ඉටු කරන බව සාක්ෂි සමුච්චය කරයි [30]. සංගෝකෝයා සහ අල්. [31] miR-144 සෘජුවම ලිම්ෆොබ්ලාස්ට් K2 සෛල රේඛාව, ප්රාථමික මානව එරිත්රොයිඩ් ප්රජනක සෛල සහ දෑකැති සෛල රෝග රෙටිකුලෝසයිට් වල Nrf562 ක්රියාකාරිත්වය අඩු කරන බව පෙන්නුම් කරයි. මිනිස් පියයුරු එපිටිලියල් සෛල පිළිබඳ තවත් රසවත් අධ්යයනයකින් පෙන්නුම් කළේ miR-28 Keap2-ස්වාධීන යාන්ත්රණයක් හරහා Nrf1 වළක්වන බවයි [32]. ඒ හා සමානව, miR-153, miR-27a, miR-142-5p, සහ miR144 වැනි miRNAs නියුරෝන SH-SY2Y සෛල රේඛාවේ Nrf5 ප්රකාශනය අඩු කරයි [33]. සිං සහ අල්. [34] ක්ෂීරපායී පිළිකා කාරකයේ 93?-estradiol (E2)-ප්රේරිත මී ආකෘතියක් තුළ miR-17 හි ectopic ප්රකාශනය Nrf2-නියාමනය කරන ලද ජානවල ප්රකාශනය අඩු කරන බව පෙන්නුම් කරයි.
අපගේ විද්යාගාරයේ මෑත සොයාගැනීමක් රෙටිනොයික් X ප්රතිග්රාහක ඇල්ෆා (RXR?) ලෙස හඳුන්වන Nrf2 හි ආවේණික නිෂේධනයක් හඳුනාගෙන ඇත. RXR? න්යෂ්ටික ප්රතිග්රාහකයක් වන අතර, එහි DNA බන්ධන වසම (DBD) හරහා Nrf7 (ඇමයිනෝ-අම්ල අපද්රව්ය 2–209) හි Neh316 වසම සමඟ අන්තර්ක්රියා කරයි, සහ න්යෂ්ටියේ Nrf2 ක්රියාකාරකම් විශේෂයෙන් වළක්වයි. එපමනක් නොව, පෙරොක්සිසෝම් ප්රොලිෆෙරේටර්-සක්රීය ප්රතිග්රාහක-?, ඊආර්?, එස්ට්රොජන් ආශ්රිත ප්රතිග්රාහක-?, සහ ග්ලූකෝකෝටිකොයිඩ් ප්රතිග්රාහක වැනි අනෙකුත් න්යෂ්ටික ප්රතිග්රාහක ද Nrf2 ක්රියාකාරකම් වල ආවේණික නිෂේධක ලෙස වාර්තා වී ඇත [9], [10].
Nrf2/HO-1 අක්ෂයේ ප්රති-ගිනි අවුලුවන භූමිකාව
HO-1 යනු ප්රේරක සමස්ථානික සහ අනුපාත සීමා කරන එන්සයිමය වන අතර එය හීම් කාබන් මොනොක්සයිඩ් (CO) සහ නිදහස් යකඩ බවට හා බිලිවර්ඩින් බිලිරුබින් බවට හායනය උත්ප්රේරණය කරයි. ප්රෝ-ගිනි අවුලුවන නිදහස් හීම් වල එන්සයිම පරිහානිය මෙන්ම CO සහ bilirubin වැනි ප්රති-ගිනි අවුලුවන සංයෝග නිෂ්පාදනය HO-1 හි ආරක්ෂිත බලපෑම් පවත්වා ගැනීම සඳහා ප්රධාන කාර්යභාරයක් ඉටු කරයි (රූපය 2).
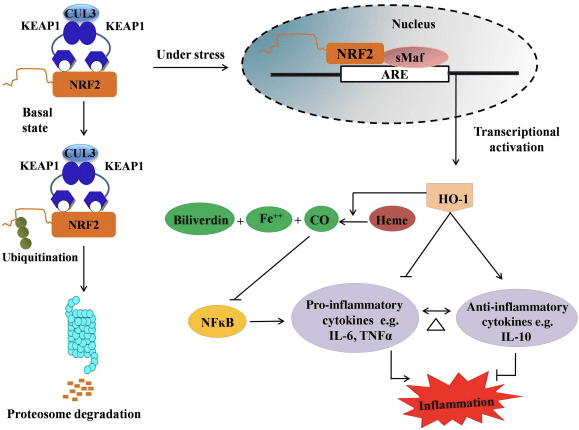 රූපය 2 Nrf2/HO-1 මාර්ගය පිළිබඳ දළ විශ්ලේෂණය. මූලික තත්ත්වයන් යටතේ, Nrf2 එහි repressor Keap1 සමඟ බන්ධනය වන අතර එමඟින් ප්රෝටීසෝම පරිහානියට සහ සර්ව ව්යාප්තියට මග පාදයි. ඔක්සිකාරක ආතතිය අතරතුර, නිදහස් Nrf2 න්යෂ්ටිය වෙත මාරු වන අතර එහිදී එය කුඩා Maf පවුලේ සාමාජිකයන් සමඟ dimerize වන අතර HO-1 වැනි ARE ජානවලට බන්ධනය වේ. නියාමනය කරන ලද HO-1 හීම් CO, bilirubin සහ නිදහස් යකඩ බවට උත්ප්රේරණය කරයි. CO NF-?B මාර්ගයේ නිෂේධකයක් ලෙස ක්රියා කරන අතර එය ප්රෝ-ගිනි අවුලුවන සයිටොකයිනවල ප්රකාශනය අඩුවීමට තුඩු දෙන අතර බිලිරුබින් ප්රතිඔක්සිකාරකයක් ලෙසද ක්රියා කරයි. තවද, HO-1 මගින් ප්රදාහකාරී සයිටොකයින් සෘජුවම වළක්වන අතරම ප්රති-ගිනි අවුලුවන සයිටොකයින් සක්රීය කරයි, එමඟින් ගිනි අවුලුවන ක්රියාවලිය සමතුලිත කිරීමට හේතු වේ.
රූපය 2 Nrf2/HO-1 මාර්ගය පිළිබඳ දළ විශ්ලේෂණය. මූලික තත්ත්වයන් යටතේ, Nrf2 එහි repressor Keap1 සමඟ බන්ධනය වන අතර එමඟින් ප්රෝටීසෝම පරිහානියට සහ සර්ව ව්යාප්තියට මග පාදයි. ඔක්සිකාරක ආතතිය අතරතුර, නිදහස් Nrf2 න්යෂ්ටිය වෙත මාරු වන අතර එහිදී එය කුඩා Maf පවුලේ සාමාජිකයන් සමඟ dimerize වන අතර HO-1 වැනි ARE ජානවලට බන්ධනය වේ. නියාමනය කරන ලද HO-1 හීම් CO, bilirubin සහ නිදහස් යකඩ බවට උත්ප්රේරණය කරයි. CO NF-?B මාර්ගයේ නිෂේධකයක් ලෙස ක්රියා කරන අතර එය ප්රෝ-ගිනි අවුලුවන සයිටොකයිනවල ප්රකාශනය අඩුවීමට තුඩු දෙන අතර බිලිරුබින් ප්රතිඔක්සිකාරකයක් ලෙසද ක්රියා කරයි. තවද, HO-1 මගින් ප්රදාහකාරී සයිටොකයින් සෘජුවම වළක්වන අතරම ප්රති-ගිනි අවුලුවන සයිටොකයින් සක්රීය කරයි, එමඟින් ගිනි අවුලුවන ක්රියාවලිය සමතුලිත කිරීමට හේතු වේ.
Nrf2 mRNA සහ ප්රෝටීන් ප්රකාශනය වැඩි කිරීමෙන් HO-1 ජානය ප්රේරණය කරන අතර එය vitro සහ vivo අධ්යයනයන්හි බහුලව භාවිතා වන සම්භාව්ය Nrf2 නියාමනය කරන ලද ජාන වලින් එකකි. HO-1 සහ එහි පරිවෘත්තීය Nrf2 මගින් මැදිහත් වන සැලකිය යුතු ප්රති-ගිනි අවුලුවන බලපෑම් ඇති බව අධ්යයන කිහිපයකින් පෙන්නුම් කර ඇත. සක්රිය Nrf1 මගින් මැදිහත් වන HO-2 ප්රකාශනය ඉහළ නැංවීම NF?B සංඥාව නිෂේධනය කිරීමට තුඩු දෙයි, පිරිමි Sprague-Dawley මීයන්ගේ අක්මාව බද්ධ කිරීමේ ආකෘතියේ [35] බඩවැල්වල ශ්ලේෂ්මල තුවාල සහ තද-හන්දි අක්රියතාව අඩු කරයි. Nrf2-රඳා පවතින HO-1 ප්රකාශනය ඉහළ නැංවීම මගින් මූසිකයෙන් ලබාගත් C2C12 myoblasts H2O2 සයිටොටොක්සිසිටි [36] වලින් ආරක්ෂා කළ හැක. Nrf2 මත යැපෙන HO-1 RAW264.7- හෝ මවුස් peritoneal macrophage-ව්යුත්පන්න ෆෝම් සෛල macrophages හි lipopolysaccharide (LPS)-මැදිහත් ගිනි අවුලුවන ප්රතිචාර මත බලපෑමක් ඇත. Nrf2 ක්රියාකාරකම් පෙන සෛල මැක්රෝෆේජස් සංසිද්ධිය අවශෝෂණ කරන අතර මැක්රෝෆේජ්වල මධ්යස්ථ ප්රදාහය වළක්වයි, ඒවා ධමනි සිහින් වීමෙහි ප්රගතියෙහි වැදගත් කාර්යභාරයක් ඉටු කරයි [37]. Nrf2/HO-1 අක්ෂය LPS ප්රේරිත මූසික BV2 මයික්රොග්ලියල් සෛල සහ මවුස් හිපොකැම්පල් HT22 සෛල වලට බලපාන අතර, ස්නායු ප්රදාහයට බලපෑම් කරයි. මූසික හිපොකැම්පල් HT1 සෛලවල සෛල මරණය ආරක්ෂා කරන මූසික BV2 මයික්රොග්ලියල් සෛල තුළ Nrf2 මාර්ගය හරහා HO-22 ප්රකාශනය ඉහළ නැංවීම [38]. තවද, කාබන් මොනොක්සයිඩ් (CO) මුදාහරින්නෙකු සමඟ Nrf2 ප්රේරකයක් ඒකාබද්ධ කරන කොබෝල්ට් මත පදනම් වූ දෙමුහුන් අණු (HYCOs) Nrf2/HO-1 ප්රකාශනය වැඩි කරයි, CO නිදහස් කරයි සහ vitro තුළ ප්රති-ගිනි අවුලුවන ක්රියාකාරකම් සිදු කරයි. HYCOs ද පටක HO-1 ඉහළ නියාමනය කරයි සහ vivo තුළ පරිපාලනයෙන් පසු රුධිරයේ CO ලබා දෙයි, ගිනි අවුලුවන තත්වයන්ට එරෙහිව ඒවායේ විභව භාවිතයට සහාය වේ [39]. Nrf2/HO-1 නියාමනය ටෝරීන් ක්ලෝරමයින් සමඟ ප්රතිකාර කරන මුරීන් මැක්රෝෆේජ් වල එෆෙරොසයිටික් ක්රියාකාරිත්වය වැඩි කිරීමෙන් දැවිල්ල අඩු කරයි [40]. සමස්තයක් වශයෙන්, ඉහත-පැහැදිලි කරන ලද පර්යේෂණාත්මක ආකෘති මගින් Nrf2/HO-1 අක්ෂය ප්රති-ගිනි අවුලුවන ක්රියාකාරිත්වයේ ප්රධාන කාර්යභාරයක් ඉටු කරන බව හෙළි කරන ලදී, Nrf2 යනු දැවිල්ල ආශ්රිත රෝග සඳහා චිකිත්සක ඉලක්කයක් බව යෝජනා කරයි.
මීට අමතරව, HO-1 හි අතුරු නිෂ්පාදන වන CO, bilirubin, ඔක්සිකාරක ආතතිය සහ සෛල හානිවලදී බලගතු ප්රතිඔක්සිකාරකයක් ලෙස ක්රියා කරයි [41], [42]; එය autoimmune encephalomyelitis සහ hepatitis [43], [44] මර්දනය කරයි; එය iNOS සහ NO [45], [46], [47] උත්පාදනය වැළැක්වීම මගින් එන්ඩොටොක්සික් කම්පනයට එරෙහිව මීයන් සහ මීයන් ආරක්ෂා කරයි. තවද, බිලිරුබින් එන්ඩොතලියම් සක්රීය කිරීම සහ අක්රිය වීම අඩු කරයි [48]. සිත්ගන්නා කරුණ නම්, bilirubin adhesion molecule-1 හරහා endothelial leukocytes සම්ප්රේෂණය වීම අඩු කරයි [49]. HO-1 ප්රබල ප්රති-ගිනි අවුලුවන කාරකයක් ලෙස පමණක් නොව එහි පරිවෘත්තීය ද ක්රියා කරන බව මෙම විශේෂිත යොමු දක්වයි.
Nrf2 මගින් නිෂේධනය කරන ලද ගිනි අවුලුවන මැදිහත්කරුවන් සහ එන්සයිම
සයිටොකයින් සහ කෙමොකයින්
සයිටොකයින් යනු විවිධ සෛල මගින් ස්රාවය වන අඩු අණුක බර ප්රෝටීන සහ පොලිපෙප්ටයිඩ වේ; ඔවුන් සෛල වර්ධනය, අවකලනය සහ ප්රතිශක්තිකරණ ක්රියාකාරිත්වය නියාමනය කරන අතර දැවිල්ල හා තුවාල සුව කිරීමට සම්බන්ධ වේ. සයිටොකයින් වලට ඉන්ටර්ලියුකින් (ILs), ඉන්ටර්ෆෙරෝන්, tumor necrosis factor (TNF), ජනපද උත්තේජක සාධකය, කෙමොකයින් සහ වර්ධන සාධක ඇතුළත් වේ. සමහර සයිටොකයින් ගිනි අවුලුවන මැදිහත්කරුවන් ලෙස සලකනු ලබන අතර අනෙක් ඒවාට ප්රති-ගිනි අවුලුවන ක්රියාකාරකම් ඇත. ඔක්සිකාරක ආතතියට නිරාවරණය වීම නිසා ඉලක්කගත සෛලවල ඔක්සිකාරක ආතතිය ඇති කරන සයිටොකයින් අධික ලෙස නිෂ්පාදනය වේ. ඔක්සිකාරක ආතතියෙන් NF-?B සක්රිය වූ විට ගිනි අවුලුවන සයිටොකයින් කිහිපයක් අධික ලෙස නිෂ්පාදනය වේ. තවද, ප්රෝ-ගිනි අවුලුවන ඔක්සිකාරක ආතතිය NF-?B තවදුරටත් සක්රිය කිරීමට සහ සයිටොකයින් අධික ලෙස නිපදවීමට හේතු වේ. Nrf2/ARE පද්ධතිය සක්රිය කිරීම මෙම චක්රය කඩාකප්පල් කිරීමේදී වැදගත් කාර්යභාරයක් ඉටු කරයි. Chemokines යනු කුඩා සයිටොකයින් පවුලකි, එහි ප්රධාන කාර්යභාරය වන්නේ ගිනි අවුලුවන සෛල සංක්රමණයට මග පෙන්වීමයි. ඒවා ප්රධාන වශයෙන් ලියුකෝසයිට්, මොනොසයිට්, නියුට්රොෆිල් සහ අනෙකුත් ප්රයෝගික සෛල සඳහා රසායනික ද්රව්ය ලෙස ක්රියා කරයි.
Nrf2 සක්රිය කිරීම IL-6 සහ IL-1 ඇතුළුව, ප්රදාහකාරී සයිටොකයින් වල LPS-ප්රේරිත පිටපත් කිරීමේ නියාමනය වළක්වන බව වාර්තා වී තිබේද? [50]. IL-1? සහ IL-6 නිෂ්පාදනය Nrf2 හි ද වැඩි වේ?/? ඩෙක්ස්ට්රාන් සල්ෆේට්-ප්රේරිත කොලිටස් සහිත මීයන් [51], [52]. Nrf2 පහළ IL-17 සහ අනෙකුත් ගිනි අවුලුවන සාධක Th1 සහ Th17 නිෂ්පාදනය වළක්වයි, සහ බහු ස්ක්ලේරෝසිස්, ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලයිටිස් [53] හි පර්යේෂණාත්මක ආකෘතියක් තුළ රෝග ක්රියාවලිය මර්දනය කරයි. Nrf2 මත යැපෙන ප්රතිඔක්සිකාරක ජාන HO-1, NQO-1, Gclc, සහ Gclm block TNF-?, IL-6, monocyte chemo attractant protein-1 (MCP1), macrophage inflammatory protein-2 (MIP2) සහ ගිනි අවුලුවන මැදිහත්කරුවන්. නමුත් Nrf2-knockout මීයන් සම්බන්ධයෙන්, ප්රති-ගිනි අවුලුවන බලපෑම සිදු නොවේ [54]. LPS සමඟ ප්රතිකාර කරන Nrf2-knockout මීයන්ගේ පෙරිටෝනියල් නියුට්රොෆිල්ස් වල වල්-වර්ගයේ (WT) සෛලවලට වඩා සැලකිය යුතු මට්ටමකින් සයිටොකයින් (TNF-? සහ IL-6) සහ කෙමොකයින් (MCP1 සහ MIP2) ඉහළ මට්ටමක පවතී [54]. vitro තුළ, Nrf2 ජානය මානව සහ හාවා aortic සිනිඳු මාංශ පේශි සෛල වෙත මාරු කිරීම MCP1 [8], [55] හි ස්රාවය මැඩපවත්වයි, සහ Nrf2 මත යැපෙන HO-1 ප්රකාශනය TNF-?-උත්තේජනය කරන ලද NF-?B සහ MCP-1 මර්දනය කරයි. මිනිස් පෙකණි නහර එන්ඩොතලියම් සෛල තුළ ස්රාවය වීම [56]. මෙම සොයාගැනීම්වලින් ඇඟවෙන්නේ, ගිනි අවුලුවන උත්තේජකවලට ප්රතිචාර වශයෙන්, Nrf2 සංඥා නියාමනය කිරීම මගින් ගිනි අවුලුවන සයිටොකයින් සහ කෙමොකයින් අධික ලෙස නිෂ්පාදනය වීම වළක්වන අතර NF-?B සක්රීය කිරීම සීමා කරන බවයි.
සෛල ඇලවුම් අණු
සෛල ඇලවුම් අණු (CAMs) යනු සෛල සමඟ හෝ බාහිර සෛල අනුකෘතිය සමඟ බන්ධනය වන ප්රෝටීන වේ. සෛල මතුපිට පිහිටා ඇති අතර, ඒවා සෛල හඳුනාගැනීම, සෛල සක්රිය කිරීම, සංඥා සම්ප්රේෂණය, ප්රගුණනය සහ අවකලනය සඳහා සම්බන්ධ වේ. CAM අතර, ICAM-1 සහ VCAM-1 immunoglobulin superfamily හි වැදගත් සාමාජිකයන් වේ. ICAM-1 leukocyte සහ endothelial සෛල පටලවල අඩු සාන්ද්රණයක පවතී. සයිටොකයින් උත්තේජනය මත, සාන්ද්රණය සැලකිය යුතු ලෙස වැඩි වේ. ICAM-1 IL-1 සහ TNF මගින් ප්රේරණය කළ හැකි අතර සනාල එන්ඩොතලියම්, මැක්රෝෆේජ් සහ ලිම්ෆොසයිට් මගින් ප්රකාශ වේ. එය ඉන්ටෙග්රීන් සඳහා ලිගන්ඩ්, ලියුකෝසයිට් මත ඇති ප්රතිග්රාහකයකි. ICAM-1-integrin පාලම සක්රිය වූ විට, ලියුකෝසයිට් එන්ඩොතලියල් සෛලවලට බන්ධනය වන අතර පසුව උප එන්ඩොතලියල් පටකවලට සංක්රමණය වේ [57]. VCAM-1 මගින් ලිම්ෆොසයිට්, මොනොසයිට්, ඊසිනොෆිල්ස් සහ බැසෝෆිල්ස් සනාල එන්ඩොතලියම් වලට ඇලවීම මැදිහත් වන අතර අවසානයේ ඔක්සිකාරක ආතතිය හේතුවෙන් පටක හානි වීමට තුඩු දෙන ලියුකෝසයිට් බඳවා ගැනීමට දායක වේ. Nrf2 VCAM-1 [58] හි ප්රවර්ධක ක්රියාකාරකම් වළක්වයි. Nrf2-නියාමනය කරන ලද පහළ ප්රවාහ ජානය HO-1 E-selectin සහ VCAM-1 ප්රකාශනයට බලපෑ හැකිය, එන්ඩොතලියල් සෛල සමඟ සම්බන්ධ වූ ඇලවුම් අණු [59]. CD-14, TREM1, SELE, SELP, සහ VCAM-1 වැනි CAM කිහිපයක පුඵ්ඵුසීය ප්රකාශනය Nrf2?/? Nrf2+/+ මීයන්ට වඩා මීයන් [60]. මානව aortic endothelial සෛලවල Nrf2 TNF-?-induced VCAM-1 ප්රකාශනය මර්දනය කරන අතර TNF-?-ප්රේරිත මොනොසයිටික් U937 සෛල ඇලීමට බාධා කරයි [8]. Nrf2 හි අධි ප්රකාශනය මානව ක්ෂුද්ර වාහිනී එන්ඩොතලියල් සෛල තුළ TNF-?-ප්රේරිත VCAM-1 ජාන ප්රකාශනය ද වළක්වයි [61]. ස්වභාවිකව ඇතිවන ප්රතිඔක්සිකාරක 3-hydroxyanthranilic අම්ලය (HA), ප්රදාහය හෝ ආසාදනය අතරතුර kynurenine මාර්ගය ලෙස හඳුන්වන පරිවෘත්තීය මාර්ගය ඔස්සේ vivo තුළ සාදන ලද l-tryptophan පරිවෘත්තීය වලින් එකක්, HO-1 ප්රකාශනය ඇති කිරීමට සහ මානව පෙකණි වල Nrf2 උත්තේජනය කිරීමට සොයාගෙන ඇත. vein endothelial සෛල (HUVECs). HA විසින් ප්රේරණය කරන ලද Nrf2-රඳා පවතින HO-1 ප්රකාශනය MCP-1 ස්රාවය, VCAM-1 ප්රකාශනය සහ රුධිර නාලවල තුවාල හා දැවිල්ල සමඟ සම්බන්ධ NF-kB සක්රීය කිරීම වළක්වයි [56]. ප්රජනන විරෝධී සහ ප්රති-ගිනි අවුලුවන කෘතිම chalcon ව්යුත්පන්න 2?,4?,6?-tris (methoxymethoxy) chalcone ICAM-1, ප්රෝ-ගිනි අවුලුවන සයිටොකයින් IL-1?, සහ TNF-? ට්රයිනිට්රොබෙන්සීන් සල්ෆොනික් අම්ලය සමඟ ප්රතිකාර කරන මීයන්ගෙන් කොලනික් පටක වල ප්රකාශනය [62]. Nrf2 නියාමනය කිරීම ලයිකොපීන් සමඟ ප්රතිකාර කරන ලද මානව දෘෂ්ටි විතානයේ වර්ණක එපිටිලියල් සෛලවල TNF-?-ප්රේරිත ICAM-1 ප්රකාශනය වළක්වයි [63]. මෙම සියලු අධ්යයනවලින් පෙනී යන්නේ ගිනි අවුලුවන සෛල ගිනි අවුලුවන පටක වලට සංක්රමණය වීම සහ ආක්රමණය කිරීම නියාමනය කිරීම මගින් Nrf2 ගිනි අවුලුවන ක්රියාවලියේ ප්රධාන කාර්යභාරයක් ඉටු කරන බවයි.
Matrix Metalloproteinases (MMPs)
MMPs බාහිර සෛලීය අනුකෘතියේ බහුලව පවතින අතර සෛල ප්රගුණනය, සංක්රමණය, අවකලනය, තුවාල-සුව කිරීම, ඇන්ජියෝජෙනසිස්, ඇපොප්ටෝසිස් සහ පිළිකා පරිවෘත්තීය වැනි කායික හා ව්යාධි ක්රියාවලීන්ට සම්බන්ධ වේ. Nrf2/HO-1 අක්ෂය මැක්රෝෆේජ් වල MMP-9 සහ මානව ආන්ත්රික එපිටිලියල් සෛලවල MMP-7 නිෂේධනය කරන බව වාර්තා වී ඇති අතර, මෙය ගිනි අවුලුවන බඩවැල් රෝගයට ප්රතිකාර කිරීමේදී ප්රයෝජනවත් වේ [62], [64]. UV ප්රකිරණයෙන් ඇතිවන සමේ හානිය WT මීයන්ට වඩා Nrf2-knockout හි වඩාත් දරුණු වන අතර MMP-9 මට්ටම සැලකිය යුතු ලෙස ඉහළ ය, Nrf2 MMP-9 ප්රකාශනය අඩු කරන බව පෙන්නුම් කරයි. එබැවින්, Nrf2 UV විකිරණයට එරෙහිව ආරක්ෂිත ලෙස සැලකේ [65]. තවත් අධ්යයනයක් වාර්තා කළේ පිළිකා සෛල ආක්රමණය සහ දැවිල්ල වලදී MMP-9 හි නියාමනය නොකළ පිටපත් කිරීමේ ක්රියාකාරිත්වය NF-kB සංඥා මාර්ගය නිෂේධනය කිරීම හරහා නියාමනය කරන බවයි [66]. කම්පන සහගත සුෂුම්නාව තුවාල වීමේදී, NF-kB සංඥා මාර්ගය MMP-9 [67] හි mRNA මට්ටම් නියාමනය කිරීමට ද සහභාගී වේ. එබැවින්, ප්රදාහයේ දී MMPs නියාමනය Nrf2 මාර්ගයෙන් සෘජුව හෝ Nrf2-බලපෑම NF-?B මාර්ගය හරහා වක්රව බලපායි.
Cyclooxygenase-2 (COX2) සහ Inducible Nitric Oxide Synthase (INOS)
Nrf2-knockout මීයන් පිළිබඳ අත්හදා බැලීම් මාලාවක් මගින් දැවිල්ල සහ COX-2 සහ iNOS වැනි ගිනි අවුලුවන ජාන නියාමනය කිරීමේදී එහි තීරණාත්මක කාර්යභාරය පෙන්නුම් කර ඇත. පළමු වතාවට, Khor et al. Nrf2 හි මහා බඩවැලේ පටක වල COX-2 සහ iNOS වැනි ගිනි අවුලුවන සයිටොකයින් වල ප්රකාශනය වැඩි වී ඇති බව වාර්තා විය. මීයන් WT Nrf2+/+ මීයන් සමඟ සසඳන විට, Nrf2 ඔවුන්ගේ ක්රියාකාරකම් යටපත් කරන බව පෙන්නුම් කරයි [51]. කුරුස එළවළු වල ඇති සුප්රසිද්ධ Nrf2 සක්රියකාරක වලින් එකක් වන sulforaphane සමඟ පූර්ව ප්රතිකාර කිරීම පිළිබඳ තවත් වාර්තාවක්, mRNA දෙකෙහිම TNF-?, IL-1?, COX-2 සහ iNOS වල ප්රකාශනය වැළැක්වීමේ එහි ප්රති-ගිනි අවුලුවන බලපෑම පෙන්නුම් කරයි. සහ ප්රාථමික පෙරිටෝනියල් මැක්රෝෆේජ් වල ප්රෝටීන් මට්ටම් Nrf2+/+ මීයන්ගෙන් Nrf2?/ සමඟ සසඳන විට? මීයන් [68]. ඒ හා සමානව, LPS-ප්රේරිත දැවිල්ල සහිත Nrf2-knockout මීයන්ගේ hippocampus ද iNOS, IL-6 සහ TNF- වැනි දැවිල්ල සලකුණු වල ඉහළ ප්රකාශනයක් පෙන්නුම් කරයි. WT මීයන්ට වඩා [69]. එලෙසම, Nrf2-knockout මීයන් 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine මගින් ඇතිවන ඔක්සිකාරක ආතතියට මෙන්ම COX-2, iNOS වැනි දැවිල්ල සලකුණු වල mRNA සහ ප්රෝටීන් මට්ටම් වැඩි වීම පෙන්නුම් කරයි. , IL-6, සහ TNF-? [70]. එපමනක් නොව, Nrf2 වෙතින් අක්මාව?/? මෙතියොනීන් සහ කොලීන් ඌනතා සහිත ආහාර වේලක් සමඟ අභියෝගයට ලක් වූ මීයන්ට Cox5 හි mRNA ප්රකාශනය ~ 2 ගුණයකින් වැඩි වන අතර iNOS එකම ආහාර වේලෙහි සිටින WT මීයන්ගේ ඒවාට වඩා, Nrf2 හි ප්රති-ගිනි අවුලුවන භූමිකාවක් යෝජනා කරයි [71]. මෑතකදී, කිම් සහ අල්. BV2 සෛල තුළ Nrf2 සංඥා හරහා iNOS හි ප්රකාශනය අඩු කිරීමෙන් ශාක රසායනික එතිල් පයිරුවේට් එහි ප්රති-ගිනි අවුලුවන සහ ප්රති-ඔක්සිකාරක බලපෑම් ඇති කරන බව පෙන්නුම් කරයි. ඔවුන් පෙන්වා දුන්නේ එතිල් පයිරුවේට් Nrf2 හි න්යෂ්ටික සංක්රාන්තිය ප්රේරණය කරන බවත්, එය අවසානයේ p65 සහ p300 අතර අන්තර්ක්රියා වළක්වන බවත්, iNOS ප්රකාශනය අඩුවීමට තුඩු දෙන බවත්ය. තවද, කාබසෝල් ප්රතිසමය LCY-72-CHO Nrf2 සක්රීය කර එහි න්යෂ්ටික ස්ථාන මාරුව ඇති කරයි, මී ඇරෝටික සනාල සිනිඳු මාංශ පේශි සෛල තුළ COX2 සහ iNOS ප්රකාශනය [2] මර්දනය කිරීමට තුඩු දෙයි.
NLRP2 iIflammasome ක්රියාකාරකම් නියාමනය කිරීමේදී Nrf3 හි පරස්පර භූමිකාව
NLR පවුල, 3 (NLRP3) දැවිල්ල අඩංගු pyrin domain යනු රෝග කාරක හඳුනාගැනීමේ ප්රතිග්රාහකයක් (PRR) ලෙස ක්රියා කරන බහු ප්රෝටීන් සංකීර්ණයක් වන අතර රෝග කාරක ආශ්රිත අණුක රටා (PAMPs), හානි වැනි ක්ෂුද්රජීවී, ඔක්සිකාරක ආතති සංඥා පුළුල් පරාසයක් හඳුනා ගනී. ආශ්රිත අණුක රටා අණු (DAMPs) සහ ROS [74]. සක්රිය NLRP3 ගිනි අවුලුවන කැස්පේස්-1 හි බෙදීම සහ ප්රෝ-ගිනි අවුලුවන සයිටොකයින් ඉන්ටර්ලියුකින්-1 ස්රාවය කරයි? (IL-1?) එය අවසානයේ සෛල මිය යාමේ ක්රියාවලිය ප්රේරණය කරන පයිරොප්ටෝසිස් ලෙස හැඳින්වේ, එය පුළුල් පරාසයක රෝග කාරක වලට එරෙහිව ධාරක ආරක්ෂා කරයි [75]. කෙසේ වෙතත්, ප්රදාහය අසාමාන්ය ලෙස ක්රියාත්මක වීම සම්ප්රේෂණය කළ හැකි ස්පොන්ජිෆෝම් එන්සෙෆලෝපති, ඇල්සයිමර් රෝගය, පාකින්සන් රෝගය සහ දෙවන වර්ගයේ දියවැඩියාව [2], පිළිකා [76], රක්තවාතය සහ ධමනි සිහින් වීම [77] වැනි ප්රෝටීන වැරදි ලෙස නැමීමේ රෝග සමඟ සම්බන්ධ වේ.
Rong Hu සමූහයේ මෑත කාලීන නිරීක්ෂණයකින් Nrf2 ආශ්රිතව සිදු කරන ලද නිරීක්ෂණයකින් හෙළි වූයේ Nrf2 NLRP1 ගිනි අවුලුවන සක්රීය කිරීම, කැස්පේස්-3 ක්ලේවේජ් සහ IL-1 නිෂේධනයට තුඩු දෙන NQO1 ප්රකාශනය ප්රේරණය කරන බවයි? මැක්රෝෆේජ් වල පරම්පරාව. තවද, සුප්රසිද්ධ Nrf2 සක්රියකාරකයක්, tert-butylhydroquinone (tBHQ) NRf3 මත යැපෙන ආකාරයෙන් ARE සක්රිය කිරීමෙන් NLRP2 පිටපත් කිරීම සෘණාත්මකව නියාමනය කරන ලදී [79]. ඉහත නිරීක්ෂණයට අමතරව, Nrf2 න්යෂ්ටික සංක්රමණයට සහ NLRP2 ගිනි අවුලුවන එකලස් කිරීම නිෂේධනය කිරීමට සම්බන්ධ වන Nrf3 සංඥා මාර්ගය සක්රීය කිරීම හරහා ඩයිමෙතිල් ෆුමරේට් (DMF) DSS-ප්රේරිත කොලිටස් වළක්වන බව ද එම කණ්ඩායමම අනාවරණය කර ඇත.
ස්වාභාවික හා කෘතිම සංයෝග භාවිතා කරමින් කරන ලද පර්යේෂණ මාලාවක් මගින් NLRP2 ගිනි අවුලුවන සක්රිය කිරීම මත Nrf3 හි නිෂේධනීය බලපෑම ද අනාවරණය කර ඇත. නිදසුනක් ලෙස, lupus nephritis මීයන්ගේ epigallocatechin-3-gallate (EGCG) ප්රතිකාරය Nrf3 සංඥා මාර්ගය මගින් මැදිහත් වන වකුගඩු NLRP2 ගිනි අවුලුවන ක්රියාකාරීත්වය අඩු වන බව පෙන්වා දී ඇත [81]. එසේම, Citral (3,7-dimethyl-2,6-octadienal), චීන ඖෂධීය ඖෂධයක් වන Litsea cubeba හි ප්රධාන සක්රීය සංයෝගයක්, වේගවත් සහ දරුණු ලූපස් නෙෆ්රයිටිස් (ASLN) මූසිකයේ Nrf3 ප්රතිඔක්සිකාරක සංඥා මාර්ගය හරහා NLRP2 ගිනි අවුලුවන සක්රිය කිරීම වළක්වයි. [82]. ඒ හා සමානව, Nrf2 මාර්ගය සක්රිය කිරීමෙන් සහ පිරිමි BALB/c මීයන් තුළ NLRP3 ගිනි අවුලුවන සක්රිය කිරීම වළක්වමින් biochanin LPS/GalN-ප්රේරිත අක්මා තුවාල වලින් ආරක්ෂා විය [83]. තවද, මැන්ගිෆෙරින් මාත්රාව මත යැපෙන ආකාරයෙන් Nrf2 සහ HO-1 ප්රකාශනය ඉහළ-නියාමනය කරන බව පෙන්වා දී ඇති අතර LPS/D-GalN-ප්රේරිත හෙපටික NLRP3, ASC, caspase-1, IL-1 නිෂේධනය කරන ලදී. සහ TNF-? ප්රකාශනය [84].
Nrf3 මගින් NLRP2 සෘණාත්මක නියාමනය තිබියදීත්, එය NLRP3 සහ AIM2 ගිනි අවුලුවන ශ්රිතය ද සක්රීය කරයි. Haitao Wen සහ සගයන් එය සොයා ගත්තා, Nrf2 ?/? mouse macrophages මගින් NLRP3 සහ AIM2 Inflammasome වල දෝෂ සහිත සක්රිය බව පෙන්නුම් කර ඇති නමුත් NLRC4 ගිනි අවුලුවන [85] නොවේ. සිත්ගන්නා කරුණ නම්, මෙම නිරීක්ෂණය මගින් දැවිල්ල ආශ්රිත රෝග සන්දර්භය තුළ Nrf2 හි නොදන්නා ක්රියාකාරකම් නිරූපණය කරයි; එබැවින් Nrf2 එය චිකිත්සක ඉලක්කයක් ලෙස සැලකීමට පෙර ගිනි අවුලුවන ශ්රිතය සක්රීය කරන යාන්ත්රණය හෙළිදරව් කිරීම සඳහා වැඩිදුර අධ්යයනය කිරීම ඉතා වැදගත් වේ.
Nrf2 මගින් ප්රෝ-ගිනි අවුලුවන සයිටොකයින් පිටපත් කිරීම මර්දනය කිරීම
chromatin immunoprecipitation (ChIP)-seq සහ ChIP-qPCR මත පදනම් වූ ඉතා මෑත කාලීන පරීක්ෂණයකින් මූසික මැක්රෝෆේජ්වල ප්රතිඵලයක් ලෙස Nrf2 IL-6 සහ IL-1 වැනි ප්රදාහකාරී සයිටොකයින්වල ප්රවර්ධක කලාපවලට බන්ධනය වන බව අනාවරණය විය? සහ RNA Pol II බඳවා ගැනීම වළක්වයි. එහි ප්රතිඵලයක් වශයෙන්, RNA Pol II හට IL-6 සහ IL-1 හි පිටපත් කිරීමේ ක්රියාකාරීත්වය සැකසීමට නොහැකි වී තිබේද? එය අවසානයේ ජාන ප්රකාශනය අවහිර කිරීමට හේතු වේ. පළමු වතාවට, Masayuki Yamamoto ගේ කණ්ඩායම විසින් Nrf2 විසින් ARE හරහා එහි පහළ ප්රවාහයේ ජාන සක්රිය කරනවා පමණක් නොව, RNA Pol II [50] බඳවා ගැනීම වැළැක්වීම හරහා ARE සහිත හෝ රහිතව නිශ්චිත ජානවල පිටපත් කිරීමේ සක්රිය කිරීම යටපත් කරන නව යාන්ත්රණය හෙළිදරව් කරන ලදී.
Nrf2 සහ NF-?B මාර්ග අතර Crosstalk
NF-?B යනු DNA පිටපත් කිරීම සඳහා වගකිව යුතු ප්රෝටීන් සංකීර්ණයක් වන අතර එය සෑම වර්ගයකම සත්ව සෛලවල පාහේ දක්නට ලැබෙන අතර දැවිල්ල, ඇපොප්ටෝසිස්, ප්රතිශක්තිකරණ ප්රතිචාරය, සෛල වර්ධනය සහ සංවර්ධනය වැනි විවිධ ක්රියාවලීන්ට සම්බන්ධ වේ. p65, NF-?B පවුලේ Rel ප්රෝටීනයක්, පරිවර්තන වසමක් ඇති අතර p50 සතුව නොමැති අතර පිටපත් කිරීම සක්රිය කිරීමට Rel ප්රෝටීන් සමඟ විෂමකරණය අවශ්ය වේ. ඔක්සිකාරක ආතතිය අතරතුර, I?B kinase (IKK) සක්රිය කර I?B හි පොස්පරීකරණය ඇති කරයි, එහි ප්රතිඵලයක් ලෙස NF-?B මුදා හැරීම සහ න්යෂ්ටික ස්ථානගත කිරීම සිදුවේ. NF-?B මගින් IL-6, TNF-?, iNOS, IL-1, සහ අන්තර් සෛලීය ඇලවුම් COX-2 වැනි ප්රෝ-ගිනි අවුලුවන මැදිහත්කරුවන්ගේ පිටපත් කිරීමට හේතු වේ.
NF-?B හි අසාමාන්ය නියාමනය රූමැටොයිඩ් ආතරයිටිස්, ඇදුම, ගිනි අවුලුවන බඩවැල් රෝග සහ හෙලිකොබැක්ටර් පයිලෝරි ආසාදනය හේතුවෙන් ඇතිවන ගැස්ට්රයිටිස් [86] සමඟ සම්බන්ධ වී ඇත. NF-kB ක්රියාකාරකම් Keapl/Nrf2/ARE සංඥා මාර්ගයට ප්රධාන වශයෙන් අංශ තුනකින් බලපෑම් කරන බව දැනට සලකනු ලැබේ: පළමුව, Keap1 IKK අඩු කරයිද? සෑම තැනකම පැතිරීම හරහා, NF-?B [87] හි ක්රියාකාරිත්වය වළක්වයි. දෙවනුව, ගිනි අවුලුවන ක්රියාවලිය මගින් cyclopentenone prostaglandin 2d-PGJ15 වෙතින් ව්යුත්පන්න කරන ලද COX2 වැනි ගිනි අවුලුවන මැදිහත්කරුවන් ප්රේරණය කරයි, එය Keap1 සමඟ ප්රතික්රියා කරන සහ Nrf2 සක්රීය කරන ප්රබල ඉලෙක්ට්රොෆයිලයක් වන අතර එමඟින් ජාන පිටපත් කිරීම ආරම්භ කරයි [58] රූපය 88 A, B). තෙවනුව, NF-?B තරඟකාරී Nrf3 පිටපත් කිරීමේ සම-ක්රියාකාරී CBP [2], [89] (රූපය 90 C, D) සමඟ ඒකාබද්ධ කළ හැක.
 රූපය 3 Nrf2 සහ NF-?B මාර්ග අතර හරස්කඩ. (A) Keap1 විසින් IKK CUL3-මැදිහත්වීම සහ ප්රෝටීසෝම පරිහානිය වෙත යොමු කරන අතර එය අවසානයේ NF-?B පොස්පරීකරණය නිෂේධනය කිරීමට හේතු වන අතර මෙම යාන්ත්රණය Keap2 සමඟ Nrf1 සහ IKK තරඟකාරී බන්ධනයක් ලෙසද ක්රියා කරයි. (B) ඔක්සිකාරක ආතතිය IKK සක්රීය කරන අතර එය NF-?B ෆොස්ෆොරයිලේට් කරයි, එය න්යෂ්ටිය තුළට සංක්රමණය වීමට සහ COX-2 වැනි ප්රදාහ සයිටොකයින් සක්රීය කිරීමට හේතු වේ. 2d-PGJ15 ලෙස හඳුන්වන COX-2 හි පර්යන්ත නිෂ්පාදනය Nrf2 හි ප්රේරකයක් ලෙස ක්රියා කරන අතර එය අවසානයේ ඔක්සිකාරක ආතතිය මර්දනය කිරීමට හේතු වේ. (C) Nrf2 ARE-ධාවන ජාන ප්රකාශනය ආරම්භ කිරීම සඳහා කුඩා Maf සහ අනෙකුත් පිටපත් කිරීමේ යන්ත්රෝපකරණ සමඟ එහි පිටපත් කිරීමේ cofactor CBP සමඟ බන්ධනය වේ. (D) NF-?B CBP සමඟ තරඟකාරී ලෙස බැඳෙන විට, එය Nrf2 සමඟ CBP බැඳීම වළක්වයි, එය Nrf2 පරිවර්තන නිෂේධනයට මග පාදයි.
රූපය 3 Nrf2 සහ NF-?B මාර්ග අතර හරස්කඩ. (A) Keap1 විසින් IKK CUL3-මැදිහත්වීම සහ ප්රෝටීසෝම පරිහානිය වෙත යොමු කරන අතර එය අවසානයේ NF-?B පොස්පරීකරණය නිෂේධනය කිරීමට හේතු වන අතර මෙම යාන්ත්රණය Keap2 සමඟ Nrf1 සහ IKK තරඟකාරී බන්ධනයක් ලෙසද ක්රියා කරයි. (B) ඔක්සිකාරක ආතතිය IKK සක්රීය කරන අතර එය NF-?B ෆොස්ෆොරයිලේට් කරයි, එය න්යෂ්ටිය තුළට සංක්රමණය වීමට සහ COX-2 වැනි ප්රදාහ සයිටොකයින් සක්රීය කිරීමට හේතු වේ. 2d-PGJ15 ලෙස හඳුන්වන COX-2 හි පර්යන්ත නිෂ්පාදනය Nrf2 හි ප්රේරකයක් ලෙස ක්රියා කරන අතර එය අවසානයේ ඔක්සිකාරක ආතතිය මර්දනය කිරීමට හේතු වේ. (C) Nrf2 ARE-ධාවන ජාන ප්රකාශනය ආරම්භ කිරීම සඳහා කුඩා Maf සහ අනෙකුත් පිටපත් කිරීමේ යන්ත්රෝපකරණ සමඟ එහි පිටපත් කිරීමේ cofactor CBP සමඟ බන්ධනය වේ. (D) NF-?B CBP සමඟ තරඟකාරී ලෙස බැඳෙන විට, එය Nrf2 සමඟ CBP බැඳීම වළක්වයි, එය Nrf2 පරිවර්තන නිෂේධනයට මග පාදයි.
Nrf2 සහ NF-?B සංඥා මාර්ග පහළ ඉලක්ක ප්රෝටීන වල පිටපත් කිරීම හෝ ක්රියාකාරිත්වය පාලනය කිරීම සඳහා අන්තර්ක්රියා කරන බව උපකල්පනය කෙරේ. මෙම උපකල්පනය සාධාරණීකරණය කිරීමේදී බොහෝ උදාහරණ පෙන්නුම් කරන්නේ Nrf2 සහ NF-?B මාර්ගවල සාමාජිකයින් අතර සෘජු හෝ වක්ර ක්රියාකාරීත්වය සහ නිෂේධනය සිදුවන බවයි (රූපය 4). LPS වලට ප්රතිචාර වශයෙන්, Nrf2 knockdown සැලකිය යුතු ලෙස NF-?B පිටපත් කිරීමේ ක්රියාකාරකම් සහ NF-?B-ආදාරණ ජාන පිටපත් කිරීම වැඩි කරයි, Nrf2 NF-?B ක්රියාකාරකම් වලට බාධා කරන බව පෙන්වයි [60], [91]. මීට අමතරව, Nrf2 මත යැපෙන පහළ HO-1 හි ප්රකාශනය වැඩි වීම NF-?B ක්රියාකාරකම් වළක්වයි. පුරස්ථි ග්රන්ථියේ පිළිකා සෛල කෙටියෙන් ?-tochopheryl succinate වෙත නිරාවරණය වන විට, විටමින් E ව්යුත්පන්නයක්, HO-1 ප්රකාශනය වැඩි දියුණු වේ. HO-1 හි අවසාන නිශ්පාදන NF-?B [92] හි න්යෂ්ටික ස්ථාන මාරුව වළක්වයි. මෙම vivo අධ්යයනවලින් පෙනී යන්නේ Nrf2 NF-kB සංඥා මාර්ගය සෘණාත්මකව නියාමනය කරන බවයි. LPS NF-?B DNA බන්ධන ක්රියාකාරකම් උත්තේජනය කරන අතර NF-?B හි p65 අනු ඒකකයේ මට්ටම Nrf2 ගේ පෙනහළුවලින් න්යෂ්ටික නිස්සාරණවල සැලකිය යුතු ලෙස ඉහළ මට්ටමක පවතී. WT මීයන්ගෙන් වඩා, NF-?B සක්රිය කිරීමේදී Nrf2 හි සෘණාත්මක භූමිකාවක් යෝජනා කරයි. එපමණක් නොව, Nrf2?/? මූසික කළල ෆයිබ්රොබ්ලාස්ට් LPS සහ TNF සමඟ ප්රතිකාර කළාද? IKK සක්රිය කිරීම සහ I?B- නිසා ඇති වූ වඩාත් කැපී පෙනෙන NF-?B සක්රිය කිරීම පෙන්වන්න? පිරිහීම [60]. NRf2 හි NF-?B DNA බන්ධන ක්රියාකාරකම් වැඩි වන අතර ශ්වසන සමමුහුර්ත වෛරස් නිෂ්කාශනය සැලකිය යුතු ලෙස අඩු වේ. WT මීයන් සමඟ සසඳන විට මීයන් [93]. Nrf2?/ සල්ෆෝරාපේන් සමඟ එක්ව ප්රතිකාර කරන ලද මීයන්ට දරුණු වකුගඩු හානි සහ ව්යාධිමය වෙනස්කම් මෙන්ම iNOS ප්රකාශනය සහ NF-?B සක්රීය කිරීම WT හා සසඳන විට ඉහළ ගොස් ඇත, NRf2 NF-?B සංඥා මාර්ගය නිෂේධනය කිරීමෙන් සහ ROS ඉවත් කිරීමෙන් lupus nephritis වැඩි දියුණු කරන බව යෝජනා කරයි. ]. NF-?B ක්රියාකාරකම් ද සිදු වන්නේ සෛල LPS සහ TNF-? සමඟ Nrf2 ප්රේරකයක් සමඟ ප්රතිකාර කළ විටය. නිදසුනක් ලෙස, කෘතිම චල්කෝන් ව්යුත්පන්නයක් මගින් TNF-?-ප්රේරිත NF-?B සක්රිය කිරීම සෘජුව සහ වක්රව සහ අර්ධ වශයෙන් මානව ආන්ත්රික එපිටිලියල් HT-1 සෛල තුළ HO-29 ප්රකාශනය ප්රේරණය කිරීම හරහා වළක්වයි [62]. F344 මීයන් 3H-1,2-dithiole-3-thione (D3T) [95] සමඟ ප්රතිකාර කළ විට NF-?B translocation සහ DNA-බන්ධන ක්රියාකාරකම් මර්දනය කිරීම මෙන්ම hepatocytes හි iNOS ප්රකාශනය මර්දනය කිරීම ද දක්නට ලැබේ. sulforaphane සහ LPS සමඟ සම-ප්රතිකාර කිරීමෙන් පසුව, iNOS, COX-2 සහ TNF- හි LPS-ප්රේරිත ප්රකාශනය? Raw 264.7 macrophages හි නියාමනය අඩු කර ඇති අතර, NF-?B DNA බන්ධනය නිෂේධනය කිරීම හරහා සල්ෆෝරාපේන් ප්රති-ගිනි අවුලුවන ක්රියාකාරකම් ඇති බව යෝජනා කරයි [96]. Nrf2 සහ NF-?B මාර්ග අතර සම්බන්ධය පැහැදිලි කිරීම සඳහා පර්යේෂණාත්මක අධ්යයනයන් කිහිපයක් සිදු කර ඇතත්, පරස්පර ප්රතිඵල පවතී. Nrf2 සහ NF-kB [97] අතර ධනාත්මක සහ සෘණ රෙගුලාසි දෙකම වාර්තා වී ඇත. සාමාන්යයෙන්, රසායනික නිවාරක ඉලෙක්ට්රොෆිල්ස් 3H-1,2-dithiole-3-thione, sulforaphane සහ Triterpenoid CDDO-Me NF-kB සහ එහි අඩු නියාමනය කළ ජාන [2], [98], [99] නිෂේධනය කිරීමෙන් Nrf100 සක්රීය කරයි. ඊට ප්රතිවිරුද්ධව, ROS, LPS, ප්රවාහ කැපුම් ආතතිය, ඔක්සිකරණය වූ LDL සහ සිගරට් දුම වැනි නියෝජිතයන් හෝ කොන්දේසි කිහිපයක් Nrf2 සහ NF-kB ක්රියාකාරකම් දෙකම වැඩි කරන බව පෙන්වා දී ඇත [97]. මීට අමතරව, vivo අධ්යයනයන්හි දී හෙළි වී ඇත්තේ Nrf2 වෙතින් හුදකලා වූ අක්මා වල NF-kB ක්රියාකාරිත්වය අඩු වන බවයි. මීයන් සහ NF-?B බන්ධන ක්රියාකාරකම් Nrf2 හි අඩුද?/? Nrf2+/+ මීයන්ට වඩා [101]. කෙසේ වෙතත්, ඇඩිනෝ වයිරස් දෛශික Nrf2 සමඟ ප්රතිකාර කරන මානව aortic endothelial සෛල NF-?B හි ක්රියාකාරීත්වයට බලපෑමක් නොකර NF-?B පහළ ප්රවාහ ජාන වලක්වයි [8].
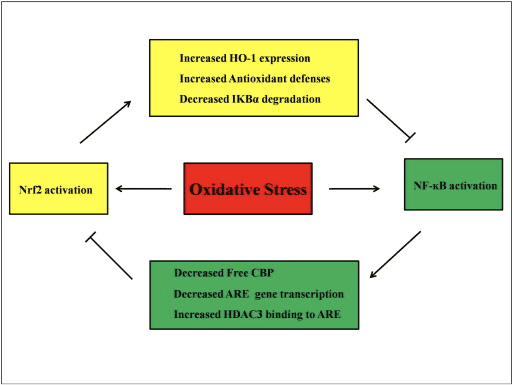 රූපය 4 Nrf2 සහ NF-?B හි නියාමන පුඩුව. Nrf2 මාර්ගය NF-?B සක්රිය කිරීම I?B- හි පිරිහීම වැළැක්වීම මගින් වළක්වයි? HO-1 ප්රකාශනය සහ ROS උදාසීන කරන සහ විෂ හරණ රසායනික ද්රව්ය ප්රතිඔක්සිකාරක ආරක්ෂාව වැඩි කිරීම. එහි ප්රතිඵලයක් ලෙස, ROS ආශ්රිත NF-?B සක්රිය කිරීම යටපත් වේ. එලෙසම, NF-?B-මැදිහත් වූ පිටපත් කිරීම Nrf2 සක්රිය කිරීම අඩු කිරීමෙන් අඩු කරයිඒCBP සඳහා Nrf2 සමඟ තරඟ කිරීමෙන් ජාන පිටපත් කිරීම සහ නොමිලේ CREB බන්ධන ප්රෝටීන්. එපමනක් නොව, NF-?B මගින් ARE කලාපයට histone deacetylase (HDAC3) බඳවා ගැනීම වැඩි කරන අතර එම නිසා Nrf2 පිටපත් කිරීමේ සක්රිය වීම වලක්වනු ලැබේ.
රූපය 4 Nrf2 සහ NF-?B හි නියාමන පුඩුව. Nrf2 මාර්ගය NF-?B සක්රිය කිරීම I?B- හි පිරිහීම වැළැක්වීම මගින් වළක්වයි? HO-1 ප්රකාශනය සහ ROS උදාසීන කරන සහ විෂ හරණ රසායනික ද්රව්ය ප්රතිඔක්සිකාරක ආරක්ෂාව වැඩි කිරීම. එහි ප්රතිඵලයක් ලෙස, ROS ආශ්රිත NF-?B සක්රිය කිරීම යටපත් වේ. එලෙසම, NF-?B-මැදිහත් වූ පිටපත් කිරීම Nrf2 සක්රිය කිරීම අඩු කිරීමෙන් අඩු කරයිඒCBP සඳහා Nrf2 සමඟ තරඟ කිරීමෙන් ජාන පිටපත් කිරීම සහ නොමිලේ CREB බන්ධන ප්රෝටීන්. එපමනක් නොව, NF-?B මගින් ARE කලාපයට histone deacetylase (HDAC3) බඳවා ගැනීම වැඩි කරන අතර එම නිසා Nrf2 පිටපත් කිරීමේ සක්රිය වීම වලක්වනු ලැබේ.

Nrf2 සංඥා මාර්ගය සක්රීය කිරීම මිනිස් සිරුරේ සෛලවල ප්රතිඔක්සිකාරක ධාරිතාව වැඩි කිරීම මගින් ප්රතික්රියාශීලී ඔක්සිකාරකවල විෂහරණයට සම්බන්ධ එන්සයිම සහ ජානවල ප්රකාශනයේ ප්රධාන කාර්යභාරයක් ඉටු කරයි. අද වන විට බොහෝ පර්යේෂණ අධ්යයනයන් පවතින අතර, Nrf2 සක්රිය කිරීමේ නියාමන යාන්ත්රණයන් සම්පූර්ණයෙන් වටහාගෙන නොමැත. දැවිල්ලට ප්රතිකාර කිරීමේදී Nrf2 සංඥා මාර්ගයෙහි හැකි කාර්යභාරයක් ද සොයාගෙන ඇත. ආචාර්ය ඇලෙක්ස් ජිමිනෙස් ඩීසී, සීසීඑස්ටී ඉන්සයිට්
ගිනි අවුලුවන රෝග සඳහා Nrf2 හි කාර්යභාරය
විවිධ පද්ධතිවලට බලපාන ගිනි අවුලුවන රෝග සඳහා Nrf2 වැදගත් කාර්යභාරයක් ඉටු කරන බව vivo අධ්යයනයන්හි දී පෙන්වා දී ඇත. මේවාට ගැස්ට්රයිටිස්, කොලිටස්, ආතරයිටිස්, නියුමෝනියාව, අක්මා හානි, හෘද වාහිනී රෝග, ස්නායු විකෘතිතා රෝග සහ මොළයේ හානි ඇතුළත් වේ. මෙම අධ්යයනයන්හිදී, Nrf2?/? WT සතුන්ට වඩා සතුන් දැවිල්ල හා පටක හානිවල බරපතල රෝග ලක්ෂණ පෙන්නුම් කළේය. එබැවින්, ගිනි අවුලුවන රෝග සඳහා Nrf2 සංඥා මාර්ගය ආරක්ෂිත බලපෑමක් ඇති බව විශ්වාස කෙරේ. පෝර්සීන් අග්න්යාශයේ ඉලාස්ටේස් අභ්යන්තර අභ්යන්තර ස්ථාපනය නිදන්ගත බාධාකාරී පෙනහළු රෝග, විශේෂයෙන් එම්පිසීමාව ඇති කරයි. Nrf2-අඩුපාඩු සහිත මීයන් එම්පිසීමාවට බෙහෙවින් ගොදුරු වන අතර, HO-1, PrxI සහ SLPI ප්රතිප්රෝටීස් ජානයේ ප්රකාශනය අඩු වීම ඇල්වෙයෝලර් මැක්රෝෆේජ් තුළ සිදු වේ. Nrf2 පෙනහළු තුවාල වලට එරෙහිව මැක්රෝෆේජ් මධ්යස්ථ ආරක්ෂක පද්ධතියේ ප්රධාන නියාමකයෙකු ලෙස සැලකේ [102]. මාස 2ක් පුරා දුම්කොළ දුමාරයට නිරාවරණය වීමෙන් ඇතිවන එම්පිසීමාව සහිත Nrf6 ඌනතාවයෙන් යුත් මීයන් බ්රොන්කොල්වලර් දැවිල්ල වැඩි වීම, ඇල්වෙයෝලි වල ඔක්සිකාරක ආතති සලකුණු වල නියාමනය වීම සහ ඇල්වෙයෝලර් සෙප්ටල් සෛල ඇපොප්ටෝසිස් වැඩි වීම පෙන්නුම් කරයි. ජාන [2], [102]. Nrf2 කඩාකප්පල් වීමත් සමඟ, ovalbumin සංකීර්ණය භාවිතා කරන අසාත්මිකතා-මැදිහත් කරන ලද ශ්වසන මාර්ගයේ දැවිල්ල සහ ඇදුම මගින් වාතයේ දැවිල්ල වැඩි වීම, වාතයේ අධි-ප්රතික්රියාශීලීත්වය, ගොබ්ලට් සෛලවල හයිපර්ප්ලාසියාව සහ බ්රොන්කොඇල්වෙයෝලර් lavage සහ splenocytes හි Th2 ඉහළ මට්ටම් පෙන්නුම් කරයි, නමුත් Nrf2-මැදිහත් වූ සං signal ා මාර්ගය ශ්වසන මාර්ගය සීමා කරයි. , ශ්ලේෂ්මල අධි ස්රාවය, සහ වාතයේ අධි ප්රතික්රියාශීලීත්වය මෙන්ම ඇදුම වර්ධනය වීම වළක්වන බොහෝ ප්රතිඔක්සිකාරක ජාන ප්රේරණය කිරීම [104]. ප්ලූරල් කුහරයට කැරජිනන් එන්නත් කිරීම ප්ලූරිසි ඇති කරයි, සහ Nrf15 ගිනි අවුලුවන සෛල තුළ 2d-PGJ2 සමුච්චය වීම මූසික පෙරිටෝනියල් මැක්රෝෆේජ් වලට සීමා වේ. දැවිල්ලේ මුල් අවධියේදී, 15d-PGJ2 Nrf2 සක්රීය කරන අතර HO-1 සහ PrxI ප්රේරණය හරහා ගිනි අවුලුවන ක්රියාවලිය නියාමනය කරයි. 2d-PGJ15 [2] නිෂ්පාදනය මගින් මුල් අවධියේදී COX-105 ප්රති-ගිනි අවුලුවන බලපෑමක් ඇති කරන බව අධ්යයනයකින් ද යෝජනා විය. සති 1 ක් සඳහා 1% ඩෙක්ස්ට්රාන් සල්ෆේට් සෝඩියම් මුඛ පරිපාලනය මගින් ගුප්ත විද්යාත්මක වෙනස්වීම් හා සම්බන්ධ කොලිටස් ඇති කරයි. කොලිටස් තුළ බඩවැල් අඛණ්ඩතාව ආරක්ෂා කිරීම සඳහා, Nrf2 හට ප්රදාහකාරී සයිටොකයින් නියාමනය කිරීමෙන් සහ දෙවන අදියර ඩෙටොක්සිෆයි එන්සයිම ප්රේරණය කිරීමෙන් වැදගත් කාර්යභාරයක් ඉටු කළ හැකිය [51]. LPS-ප්රේරිත පුඵ්ඵුසීය sepsis හි Nrf2-knockout mouse ආකෘතියක් තුළ, NF-?B ක්රියාකාරකම් COX-2, IL-113, IL-6, සහ TNF වැනි ගිනි අවුලුවන සයිටොකයින් වල බලපෑම නියාමනය කරයි? දැවිල්ල ආරම්භ කිරීම සහ ප්රවර්ධනය කිරීම සඳහා අත්යවශ්ය වේ [60]. Nrf2 මෙම ගිනි අවුලුවන සාධක නියාමනය කිරීමෙන් ගිනි අවුලුවන හානිය අඩු කරයි. උග්ර ප්රදාහයේ මෙම ආකෘතිවලදී, Nrf2 සංඥා මාර්ගය මගින් ප්රතිඔක්සිකාරක එන්සයිම, ප්රෝ-ගිනි අවුලුවන සයිටොකයින් සහ මැදිහත්කරුවන් නියාමනය කිරීම WT සතුන් තුළ ගිනි අවුලුවන තුවාල අඩු කරයි. WT මීයන් හා සසඳන විට රෝග ලක්ෂණ කැපී පෙනෙන ලෙස උත්සන්න වන Nrf2-knockout මීයන් තුළද මෙය වාර්තා වී තිබීම සිත්ගන්නා කරුණකි.

Nrf2 - යැපෙන ප්රති-ගිනි අවුලුවන ඖෂධ පිළිබඳ පර්යේෂණ
සාරාංශයක් ලෙස, දැවිල්ල ඇති බොහෝ ක්ෂේත්රවල Nrf2 සංඥා මාර්ගය නියාමන කාර්යභාරයක් ඉටු කරන බව පෙන්වන පරීක්ෂණ අපි සාකච්ඡා කර ඇත, එබැවින් ගිනි අවුලුවන රෝග සඳහා ප්රතිකාර කිරීම සඳහා Nrf2 මත යැපෙන ප්රති-ගිනි අවුලුවන නියෝජිතයන් වැදගත් වේ.
ශාක Nrf2 පිටපත් කිරීමේ සාධකය සක්රීය කරන සංයෝගවල අසාමාන්ය ලෙස පොහොසත් ප්රභවයන් වන අතර එය සයිටොප්රොටෙක්ටිව් ජාන ඉහළ නියාමනය කිරීමට හේතු වේ. මෑතකදී, බොහෝ විට ශාක සම්භවයක් ඇති විවිධ ප්රති-ගිනි අවුලුවන කාරකයන්ගේ බලපෑම් විමර්ශනය කිරීම සඳහා අධ්යයන කිහිපයක් සිදු කරන ලදී. උදාහරණයක් ලෙස, curcumin යනු කහ වල සක්රීය ද්රව්යය වන අතර ඉඟුරු වල කුඩා ප්රමාණවලින් ද දක්නට ලැබේ; isothiocyanates, විශේෂයෙන් phenylisothiocyanates බ්රොකොලි, සැල්දිරි සහ අනෙකුත් එළවළු වලින්; සහ ඇන්තොසියානින් බෙරි සහ මිදි වලින් වේ [124]. අධ්යයනවලින් පෙන්නුම් කර ඇත්තේ මෙම සියලුම කාරක හොඳ ප්රතිඔක්සිකාරක පමණක් නොව Nrf2 ප්රේරණය [125], [126] හරහා ප්රබල ප්රති-ගිනි අවුලුවන බලපෑම් ඇති බවයි. එබැවින් ශාක නිස්සාරණයෙන් නව ප්රති-ගිනි අවුලුවන Nrf2 සක්රියකාරක සංවර්ධනය කිරීම වෛද්ය පර්යේෂණ කෙරෙහි වැඩි උනන්දුවක් ඇති කර තිබේ.
මෑත වසරවලදී, මෙම සංයෝගවල ක්රියාවන් තහවුරු කිරීම සඳහා බොහෝ සත්ව අත්හදා බැලීම් සිදු කර ඇත. Artesunate ප්රධාන වශයෙන් දරුණු මැලේරියාව, මස්තිෂ්ක මැලේරියාව සහ රූමැටික් ස්වයං ප්රතිශක්තිකරණ රෝග සඳහා භාවිතා වේ; එය සෙප්ටික් පෙනහළු තුවාල සඳහා ද ඵලදායී වේ. Artesunate Nrf2 සහ HO-1 ප්රකාශනය සක්රීය කරයි, සහ දෙවැන්න දැවිල්ල වැළැක්වීම සඳහා පටක වලට ප්රෝ-ගිනි අවුලුවන සයිටොකයින් සහ ලියුකෝසයිට් ගලා ඒම අඩු කරයි [127]. Isovitexin, Oryza sativa සහල් වල ලෙලි වලින් නිස්සාරණය කර ඇත, ප්රති-ගිනි අවුලුවන සහ ප්රතිඔක්සිකාරක ගුණ ඇති බව සැලකේ; එය Nrf2/HO-1 මාර්ගය සක්රිය කිරීමෙන් සහ MAPK සහ NF-?B [128] නිෂේධනය කිරීමෙන් LPS-ප්රේරිත උග්ර පෙනහළු ආබාධවලට එරෙහිව ආරක්ෂිත කාර්යභාරයක් ඉටු කරයි. රෙනින්-ඇන්ජියෝටෙන්සින් පද්ධතිය මත ක්රියා කරන අලුතින් ජනප්රිය ඇන්ජියෝටෙන්සින් II ප්රතිග්රාහක අවහිර කරන්නෙකු වන ෆිමසාර්ටන් රුධිර පීඩනය අඩු කරයි; ශල්යකර්මයෙන් ඇති කරන ලද ඒකපාර්ශ්වික මුත්රා අවහිරතා සහිත මීයන්ට ප්රතිකාර කිරීම සඳහා fimasartan භාවිතා කිරීම Nrf2 සහ ප්රතිඔක්සිකාරක මාර්ගය වැඩි දියුණු කිරීම සහ RAS සහ MAPK වලක්වාලීම හරහා ඔක්සිකාරක ආතතිය, දැවිල්ල සහ ෆයිබ්රෝසිස් අඩු කරයි [129]. Sappanone අග්නිදිග ආසියාවේ බහුලව ව්යාප්ත වී ඇති අතර, එය ප්රති-ඉන්ෆ්ලුවෙන්සා, ප්රති-ආසාත්මිකතා සහ ස්නායු ආරක්ෂණ ඖෂධයක් ලෙස භාවිතා කරයි; එය Nrf2 සක්රීය කරන අතර NF-?B වළක්වයි, එබැවින් Nrf2- සහ/හෝ NF-?B ආශ්රිත රෝග සඳහා ප්රතිකාර කිරීමේදී ප්රයෝජනවත් විය හැක [130]. Bixin orellana බීජ වලින් ලබාගත් Bixin මෙක්සිකෝවේ සහ දකුණු ඇමරිකාවේ බෝවන සහ ගිනි අවුලුවන රෝග සඳහා භාවිතා වේ; එය වාතාශ්රය-ප්රේරිත පෙනහළු තුවාල සමනය කිරීමට සහ සාමාන්ය පෙනහළු රූප විද්යාව ප්රතිස්ථාපනය කිරීමට Nrf2 මත යැපෙන ආකාරයෙන් ගිනි අවුලුවන මැදිහත්කරුවන්, ඇල්ටෙයෝලර් කේශනාලිකා කාන්දු වීම සහ ඔක්සිකාරක හානි අඩු කරයි [131]. Epigallocatechin gallate, sulforaphane, resveratrol, lycopene, සහ green tea extract වැනි අනෙකුත් ශාක සංයෝග Nrf2 සංඥා මාර්ගය [132], [133], [134] හරහා ගිනි අවුලුවන රෝග සඳහා චිකිත්සක බලපෑම් ඇති කරයි. පැඟිරි පලතුරු වල ඇති තවත් ෆයිටොකෙමිකල්, එරියෝඩික්ටියෝල්, Nrf2 නියාමනය කිරීම, NF-?B නිෂේධනය කිරීම සහ නිෂේධනය කිරීම මගින් cisplatin-induced වකුගඩු ආබාධ සහ sepsis-induced acute පෙනහළු තුවාල සඳහා ප්රති-ගිනි අවුලුවන සහ ප්රතිඔක්සිකාරක බලපෑම් ඇති බව වාර්තා වී ඇත. macrophages [135], [136] තුළ සයිටොකයින් ප්රකාශනය. කෙසේ වෙතත්, බොහෝ ශාක රසායනික ද්රව්ය විවිධ මානව රෝග වැළැක්වීම සහ ප්රතිකාර කිරීම සඳහා විශාල පොරොන්දුවක් පෙන්නුම් කරන අතර සමහර ඒවා දැනටමත් සායනික අත්හදා බැලීම් අදියරට පැමිණ ඇත (වගුව 2).
මෙම ශාක සංයෝග මගින් ප්රධාන වශයෙන් Keap2 හි සිස්ටීන් අපද්රව්ය වෙනස් කරන විද්යුත් ද්රව්ය ස්වරූපයෙන් Nrf1 සංඥා මාර්ගය සක්රීය කරයි, එය ARE සමඟ නිදහස් න්යෂ්ටික Nrf2 බන්ධනයට තුඩු දෙයි, ප්රතිඵලයක් ලෙස අනුරූප ජානයේ පිටපත් කිරීම සක්රීය වේ.
සල්ෆෝරාපේන් සහ පිළිකා, මරණ, වයස්ගත වීම, මොළය සහ හැසිරීම, හෘද රෝග සහ තවත් දේ කෙරෙහි එහි බලපෑම්
Isothiocyanates යනු ඔබේ ආහාර වේලට ලබා ගත හැකි වැදගත්ම ශාක සංයෝග කිහිපයකි. මෙම වීඩියෝවෙන් මම ඔවුන් සඳහා මෙතෙක් කර ඇති වඩාත්ම සවිස්තරාත්මක නඩුව ඉදිරිපත් කරමි. කෙටි අවධානයක්? පහත කාල ලක්ෂ්යවලින් එකක් ක්ලික් කිරීමෙන් ඔබේ ප්රියතම මාතෘකාව වෙත යන්න. සම්පූර්ණ කාලසටහන පහතින්.
ප්රධාන කොටස්:
- 00:01:14 - පිළිකා සහ මරණ
- 00:19:04 - වයසට යාම
- 00:26:30 - මොළය සහ හැසිරීම
- 00:38:06 - අවසාන නැවත බැලීම
- 00:40:27 - මාත්රාව
සම්පූර්ණ කාලරේඛාව:
- 00:00:34 - වීඩියෝවේ ප්රධාන අවධානයක් වන සල්ෆෝරාපේන් හඳුන්වාදීම.
- 00:01:14 - කුරුස එළවළු පරිභෝජනය සහ සියලු හේතු මරණ අනුපාතය අඩු කිරීම.
- 00:02:12 - පුරස්ථි පිළිකා අවදානම.
- 00:02:23 - මුත්රාශයේ පිළිකා අවදානම.
- 00:02:34 - දුම් පානය කරන්නන්ගේ පෙනහළු පිළිකා අවදානම.
- 00:02:48 - පියයුරු පිළිකා අවදානම.
- 00:03:13 - උපකල්පිත: ඔබට දැනටමත් පිළිකාවක් ඇත්නම් කුමක් කළ යුතුද? (මැදිහත්වීමේ)
- 00:03:35 - පිළිකා සහ මරණ අනුබද්ධ දත්ත මෙහෙයවන පිළිගත හැකි යාන්ත්රණය.
- 00:04:38 - Sulforaphane සහ පිළිකා.
- 00:05:32 - මීයන්ගේ මුත්රාශයේ ගෙඩි වර්ධනයට බ්රොකොලි පැළ නිස්සාරණයේ ප්රබල බලපෑමක් පෙන්නුම් කරන සත්ව සාක්ෂි.
- 00:06:06 - පුරස්ථි ග්රන්ථියේ පිළිකා රෝගීන් සඳහා සල්ෆෝරාපේන් සෘජුවම ලබා දීමේ බලපෑම.
- 00:07:09 - සැබෑ පියයුරු පටක වල isothiocyanate පරිවෘත්තීය ජෛව සමුච්චනය.
- 00:08:32 - පියයුරු පිළිකා ප්රාථමික සෛල නිෂේධනය කිරීම.
- 00:08:53 - ඉතිහාස පාඩම: පුරාණ රෝමයේ පවා බ්රැසිකා සෞඛ්ය ගුණාංග ඇති බව තහවුරු විය.
- 00:09:16 - පිළිකා කාරක බැහැර කිරීම (බෙන්සීන්, ඇක්රොලීන්) වැඩි දියුණු කිරීමට සල්ෆෝරාපේන්ගේ හැකියාව.
- 00:09:51 - NRF2 ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය හරහා ජානමය ස්විචයක් ලෙස.
- 00:10:10 - NRF2 සක්රිය කිරීම glutathione-S-conjugates හරහා පිළිකා කාරක පිටකිරීම වැඩි දියුණු කරන ආකාරය.
- 00:10:34 - Brussels sprouts glutathione-S-transferase වැඩි කරන අතර DNA හානි අඩු කරයි.
- 00:11:20 - Broccoli sprout පානය බෙන්සීන් බැහැර කිරීම 61% කින් වැඩි කරයි.
- 00:13:31 – Broccoli sprout homogenate ඉහළ ශ්වසන මාර්ගයේ ප්රතිඔක්සිකාරක එන්සයිම වැඩි කරයි.
- 00:15:45 - කුරුස එළවළු පරිභෝජනය සහ හෘද රෝග මරණ.
- 00:16:55 - බ්රොකොලි පැළ කුඩු 2 වර්ගයේ දියවැඩියා රෝගීන්ගේ රුධිර ලිපිඩ සහ සමස්ත හෘද රෝග අවදානම වැඩි දියුණු කරයි.
- 00:19:04 - වයසට යාමේ අංශයේ ආරම්භය.
- 00:19:21 - සල්ෆෝරාපේන් බහුල ආහාර කුරුමිණියන්ගේ ආයු කාලය 15 සිට 30% දක්වා වැඩි කරයි (ඇතැම් තත්වයන් යටතේ).
- 00:20:34 - දිගුකාලීන පැවැත්ම සඳහා අඩු දැවිල්ලක වැදගත්කම.
- 00:22:05 - කුරුස එළවළු සහ බ්රොකොලි පැළ කුඩු මිනිසුන් තුළ විවිධාකාර ගිනි අවුලුවන සලකුණු අඩු කරන බව පෙනේ.
- 00:23:40 - මැද-වීඩියෝ නැවත බැලීම: පිළිකා, වයස්ගත කොටස්
- 00:24:14 - මවුස් අධ්යයනයන් යෝජනා කරන්නේ සල්ෆෝරාපේන් මහලු වියේදී අනුවර්තන ප්රතිශක්තිකරණ ක්රියාකාරිත්වය වැඩි දියුණු කළ හැකි බවයි.
- 00:25:18 - සල්ෆෝරාපේන් තට්ටය දැමීමේ මූසික ආකෘතියක හිසකෙස් වර්ධනය වැඩි දියුණු කළේය. පින්තූරය 00:26:10 ට.
- 00:26:30 - මොළයේ සහ හැසිරීම් අංශයේ ආරම්භය.
- 00:27:18 - ඔටිසම් මත බ්රොකොලි පැළ සාරය බලපෑම.
- 00:27:48 - භින්නෝන්මාදය මත ග්ලූකෝරෆනින් වල බලපෑම.
- 00:28:17 - අවපාත සාකච්ඡාවේ ආරම්භය (පිළිගත හැකි යාන්ත්රණය සහ අධ්යයන).
- 00:31:21 – ආතති-ප්රේරිත මානසික අවපීඩනයේ විවිධ මාදිලි 10 ක් භාවිතා කරමින් මූසික අධ්යයනය සල්ෆෝරාපේන් ෆ්ලෝක්සෙටීන් (ප්රෝසාක්) හා සමානව ඵලදායී බව පෙන්වයි.
- 00:32:00 - අධ්යයනයෙන් පෙන්නුම් කරන්නේ මීයන් තුළ ග්ලූකෝරෆනින් සෘජුවම ශරීරගත වීම සමාජ පරාජයේ ආතති ආකෘතියෙන් මානසික අවපීඩනය වැළැක්වීමට සමානව ඵලදායී බවයි.
- 00:33:01 - neurodegeneration අංශයේ ආරම්භය.
- 00:33:30 - සල්ෆෝරාපේන් සහ ඇල්සයිමර් රෝගය.
- 00:33:44 - සල්ෆෝරාපේන් සහ පාකින්සන් රෝගය.
- 00:33:51 - Sulforaphane සහ Hungtington's රෝගය.
- 00:34:13 - Sulforaphane තාප කම්පන ප්රෝටීන වැඩි කරයි.
- 00:34:43 - කම්පන සහගත මොළයේ තුවාල අංශයේ ආරම්භය.
- 00:35:01 - TBI මතකය වැඩි දියුණු කළ වහාම Sulforaphane එන්නත් කිරීම (මූසික අධ්යයනය).
- 00:35:55 - Sulforaphane සහ නියුරෝන ප්ලාස්ටික්.
- 00:36:32 - සල්ෆෝරාපේන් මීයන් තුළ II වර්ගයේ දියවැඩියා ආකෘතියේ ඉගෙනීම වැඩි දියුණු කරයි.
- 00:37:19 - Sulforaphane සහ duchenne මස්කියුලර් ඩිස්ට්රොෆි.
- 00:37:44 - මාංශ පේශි චන්ද්රිකා සෛලවල Myostatin නිෂේධනය (in vitro).
- 00:38:06 - ප්රමාද වීඩියෝ පුනරුච්චාරණය: මරණ සහ පිළිකා, DNA හානි, ඔක්සිකාරක ආතතිය සහ දැවිල්ල, බෙන්සීන් බැහැර කිරීම, හෘද වාහිනී රෝග, දෙවන වර්ගයේ දියවැඩියාව, මොළයට බලපෑම් (මානසික අවපීඩනය, ඔටිසම්, භින්නෝන්මාදය, ස්නායු විකෘති වීම), NRF2 මාර්ගය.
- 00:40:27 - බ්රොකොලි පැළ හෝ සල්ෆෝරාපේන් මාත්රාවක් සොයා ගැනීම පිළිබඳ සිතුවිලි.
- 00:41:01 - නිවසේ පැළවීම පිළිබඳ කථා.
- 00:43:14 - පිසීමේ උෂ්ණත්වය සහ සල්ෆෝරාපේන් ක්රියාකාරිත්වය මත.
- 00:43:45 - ග්ලූකෝරෆනින් වලින් සල්ෆෝරාපේන් බඩවැල් බැක්ටීරියාව පරිවර්තනය කිරීම.
- 00:44:24 - එළවළු වලින් සක්රීය මයිරොසිනේස් සමඟ සංයෝජිතව ඇති විට අතිරේක හොඳින් ක්රියා කරයි.
- 00:44:56 - පිසීමේ ශිල්පීය ක්රම සහ කුරුස එළවළු.
- 00:46:06 - Goitrogens ලෙස Isothiocyanates.
නිගමන
දැනට, බොහෝ පර්යේෂණ Nrf2/Keap1/ARE සංඥ කිරීමේ මාර්ගයේ දැවිල්ලෙහි භූමිකාව කෙරෙහි අවධානය යොමු කර ඇත. Nrf2 මගින් නියාමනය කරන ලද එන්සයිම අතර, HO-1 නියෝජිත ආතති ප්රතිචාර එන්සයිම වලින් එකකි. HO-1 හි කැපී පෙනෙන ප්රති-ගිනි අවුලුවන සහ ප්රතිඔක්සිකාරක ගුණ ඇත. සාමාන්යයෙන්, Nrf2 සංඥා මාර්ගය සයිටොකයින්, කෙමොකයින් මුදා හැරීමේ සාධක, MMPs සහ අනෙකුත් ගිනි අවුලුවන මැදිහත්කරුවන් වන COX-2 සහ iNOS නිෂ්පාදනය නිෂේධාත්මකව නියාමනය කරයි, එය අදාළ NF-kB සහ MAPK මාර්ග සහ දැවිල්ල පාලනය කරන අනෙකුත් ජාල වලට සෘජුව හෝ වක්රව බලපායි. Nrf2 සහ NF-?B සංඥා මාර්ග පහළ ඉලක්ක ප්රෝටීන වල පිටපත් කිරීම හෝ ක්රියාකාරිත්වය නියාමනය කිරීම සඳහා අන්තර්ක්රියා කරන බව යෝජනා කෙරේ. NRf2 හරහා NF-?B-මැදිහත් වූ පිටපත් කිරීමේ ක්රියාකාරකම් මර්දනය කිරීම හෝ අක්රිය කිරීම බොහෝ විට සිදුවන්නේ දැවිල්ලේ මුල් අවධියේදී, NF-?B මගින් ගිනි අවුලුවන ගැති මැදිහත්කරුවන් සමූහයක de novo සංශ්ලේෂණය නියාමනය කරයි. කෙසේ වෙතත්, Nrf2 සහ JAK/STAT වැනි අනෙකුත් සංඥා මාර්ග අතර සම්බන්ධතා තිබේද යන්න, දැවිල්ල තුළ ස්වභාවික ශාක ප්රභවයන්ගෙන් ලබාගත් වත්මන් Nrf2 සක්රියකාරකවල වැදගත්කම සහ ජීව විද්යාත්මක ක්රියාකාරකම් වැඩිදියුණු කරන්නේ කෙසේද වැනි පර්යේෂණවල තවමත් යම් සීමාවන් තිබේ. සහ මෙම සංයෝග ඉලක්ක කිරීම වැඩි දියුණු කරන්න. මේවාට වැඩිදුර පර්යේෂණාත්මක තහවුරු කිරීමක් අවශ්ය වේ.
මීට අමතරව, Nrf2 සංඥා මාර්ගයට > ජාන 600 ක් [163] නියාමනය කළ හැකි අතර, ඉන් > 200 ක් සයිටොප්රොටෙක්ටිව් ප්රෝටීන [164] කේතනය කරයි, ඒවා ද දැවිල්ල, පිළිකා, ස්නායු විකෘති රෝග සහ අනෙකුත් ප්රධාන රෝග සමඟ සම්බන්ධ වේ [165]. Nrf2 සංඥා මාර්ගය බොහෝ පිළිකා වලදී නියාමනය කර නැති අතර, Nrf2 මත යැපෙන ජාන බැටරිය විකෘති ප්රකාශනයක් ඇති කරන බවට වර්ධනය වන සාක්ෂි යෝජනා කරයි. එපමනක් නොව, ඔක්සිකාරක ආතතිය ආශ්රිත රෝග සඳහා විශේෂයෙන් පිළිකා සඳහා දැවිල්ල ප්රධාන කාර්යභාරයක් ඉටු කරයි. ප්රදාහයට ප්රතිරෝධය දැක්වීම සඳහා Nrf2 සක්රියකාරක කිහිපයක් යෙදීමෙන් Nrf2 පහළ ප්රවාහයේ ජානවල විකෘති ප්රකාශනයක් ඇති විය හැකි අතර එමඟින් පිළිකා උත්පාදනය සහ රසායනික සහ/හෝ රේඩියෝ චිකිත්සාවට ප්රතිරෝධය ඇති කරයි. එබැවින්, එහි ප්ලෙයෝට්රොපික් බලපෑම් අවම කිරීම සඳහා Nrf2 හි ඉතා විශේෂිත සක්රියකාරක නිපදවිය හැක. Nrf2 හි සක්රියකාරක කිහිපයක් ඔක්සිකාරක ආතතිය ආශ්රිත රෝග වල ප්රති-ගිනි අවුලුවන ක්රියාකාරකම්වල සැලකිය යුතු දියුණුවක් පෙන්නුම් කර ඇත. FDA විසින් අනුමත කරන ලද Nrf2 සක්රියකාරකයේ හොඳම උදාහරණය සහ බහු ස්ක්ලෙරෝසිස් (MS) වැනි ගිනි අවුලුවන රෝග සඳහා ප්රතිකාර කිරීම සඳහා බහුලව භාවිතා වන්නේ ඩයිමෙතිල් ෆුමරේට් ය. ටෙක්ෆිඩෙරා (බයෝජන් විසින් ඩයිමීතයිල් ෆුමරේට් ලියාපදිංචි කරන ලද නම) රෝගීන් විශාල සංඛ්යාවක පුනරාවර්තන බහු ස්ක්ලේරෝසිස් ප්රතිකාර සඳහා ඵලදායී ලෙස භාවිතා කරයි [152]. කෙසේ වෙතත්, ගිනි අවුලුවන රෝග සඳහා ප්රතිකාර කිරීම සඳහා Nrf2 සක්රියකාරක භාවිතා කිරීමේ කාර්යක්ෂමතාවය Nrf2 හි හානිකර බලපෑම් වළක්වා ගැනීම සඳහා තවදුරටත් තහවුරු කිරීම අවශ්ය වේ. එබැවින්, Nrf2 මගින් මැදිහත් වූ ප්රති-ගිනි අවුලුවන ක්රියාකාරකම් සඳහා ප්රතිකාර ක්රම දියුණු කිරීම සැලකිය යුතු සායනික බලපෑමක් ඇති කළ හැකිය. ලොව පුරා Nrf2 සංඥා මාර්ගය පිළිබඳ අඛණ්ඩ අධ්යයනයන් දැවිල්ලේ රෝග ලක්ෂණ පාලනය කිරීමට සහ පිළිකා මෙන්ම ස්නායු විකෘතිතා සහ අනෙකුත් ප්රධාන රෝග වැළැක්වීම සහ ප්රතිකාර කිරීම සඳහා ඉහළ ඉලක්කගත චිකිත්සක නියෝජිතයන් සංවර්ධනය කිරීමට කැපවී ඇත.
අනුමත කර
Sciencedirect.com/science/article/pii/S0925443916302861#t0005
අවසාන වශයෙන්, Nrf2 මිනිස් සිරුරේ ඔක්සිකාරක ආතතියේ මට්ටම් සංවේදනය කරන අතර අවසානයේ ප්රතිඔක්සිකාරක සහ ඩෙටොක්සිං එන්සයිම සහ ජාන නියාමනය ප්රවර්ධනය කිරීමට උපකාරී වේ. ඔක්සිකාරක ආතතිය වැඩි වීම නිසා ඇතිවන නිදන්ගත දැවිල්ල ස්නායු විකෘතිතා රෝග සමඟ සම්බන්ධ වී ඇති බැවිනි. Nrf2 අත්යවශ්ය කාර්යභාරයක් ඉටු කළ හැකිය ඇල්සයිමර් රෝගය වැනි සෞඛ්ය ගැටලුවලට ප්රතිකාර කිරීමේදී. අපගේ තොරතුරු වල විෂය පථය චිරොක්ට්රැක්ටික් සහ කොඳු ඇට පෙළේ සෞඛ්ය ගැටළු වලට සීමා වේ. විෂය කරුණු සාකච්ඡා කිරීමට, කරුණාකර වෛද්ය ජිමිනෙස්ගෙන් විමසීමට හෝ අපව අමතන්න915-850-0900 .
ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස් විසින් පාලනය කරන ලදී
යොමු කර ඇත්තේ: Sciencedirect.com
අතිරේක මාතෘකා සාකච්ඡාව: ශල්යකර්මයකින් තොරව දණහිසේ වේදනාව සමනය කිරීම
දණහිසේ වේදනාව යනු දණහිස් තුවාල සහ/හෝ විවිධ තත්වයන් නිසා ඇතිවිය හැකි ප්රසිද්ධ රෝග ලක්ෂණයකි.ක්රීඩා තුවාල ලබා ඇත. දණහිස මිනිස් සිරුරේ වඩාත් සංකීර්ණ සන්ධිවලින් එකකි, එය අස්ථි හතරක්, බන්ධන හතරක්, විවිධ කණ්ඩරාවන්, මෙනිස්කි දෙකක් සහ කාටිලේජයේ ඡේදනය වීමෙන් සෑදී ඇත. පවුලේ වෛද්යවරුන්ගේ ඇමරිකානු ඇකඩමියට අනුව, දණහිසේ වේදනාවට වඩාත් පොදු හේතු වන්නේ පැටලර් උපලුක්සේෂන්, පැටලර් ටෙන්ඩිනයිටිස් හෝ ජම්පර්ගේ දණහිස සහ ඔස්ගුඩ්-ෂ්ලැටර් රෝගයයි. දණහිස් වේදනාව බොහෝ විට අවුරුදු 60 ට වැඩි පුද්ගලයින් තුළ ඇති වුවද, දණහිසේ වේදනාව ළමුන් හා නව යොවුන් වියේ දී ද ඇති විය හැක. දණහිසේ වේදනාව RICE ක්රම අනුගමනය කරමින් නිවසේදී ප්රතිකාර කළ හැක, කෙසේ වෙතත්, දරුණු දණහිස් තුවාල සඳහා චිරොක්ට්රැක්ටික් ප්රතිකාර ඇතුළුව වහාම වෛද්ය ප්රතිකාර අවශ්ය විය හැකිය. �
***
by ආචාර්ය ඇලෙක්ස් ජිමිනෙස් | විෂාදිය, ක්රියාකාරී වෛද්ය විද්යාව, සෞඛ්යය, බෙහෙත් වෛද්ය විද්යාව, ස්වභාවික සෞඛ්යය, පෝෂණ, ඔක්සිකාරක ආතතිය, පිළියම්, පර්යේෂණ අධ්යයන, ප්රතිකාර, සුවතාව
ඇල්සයිමර් රෝගය සහ පාකින්සන් රෝගය වැනි ස්නායු විකෘතිතා රෝග ලොව පුරා පුද්ගලයන් මිලියන ගණනකට බලපායි. ප්රතිඵල බොහෝ විට සීමිත වුවද ස්නායු විකෘතිතා රෝග කිහිපයක රෝග ලක්ෂණ වලට ප්රතිකාර කිරීම සඳහා විවිධ ප්රතිකාර විකල්ප තිබේ. අභ්යන්තර හා බාහිර සාධක මගින් ඇතිවන ඔක්සිකාරක ආතතිය ස්නායු විකෘතිතා රෝග වර්ධනයට හේතුවක් විය හැකි බව පර්යේෂණ අධ්යයනවලින් සොයාගෙන ඇත. එම පිටපත් කිරීමේ සාධකය, Nrf2, ඔක්සිකාරක ආතතියට එරෙහිව ප්රධාන ආරක්ෂක යාන්ත්රණයක් ලෙස ක්රියා කිරීමට තීරණය කර ඇත. පහත ලිපියේ අරමුණ වන්නේ එහි බලපෑම් පෙන්වීමයි ස්නායු විකෘතිතා රෝග පිළිබඳ Nrf2.
පිටපත් කිරීමේ සාධකය NRF2 මගින් ප්රෝටෝස්ටැසිස් මොඩියුලේෂන්
ස්නායු විකෘතිතා රෝග විශේෂිත ප්රෝටීන සමුච්චය සමඟ සම්බන්ධ වී ඇති අතර, තුවාල වූ මොළය සහ ප්රෝටෝස්ටැසිස් නැතිවීම අතර සමීප සම්බන්ධතාවයක් යෝජනා කරයි. Proteostasis යනු සංඥා මාර්ග, ජාන ප්රකාශනය සහ ප්රෝටීන් පිරිහීමේ පද්ධති නියාමනය කිරීම ඒකාබද්ධ කරන පුළුල් ජාලයකට ස්තූතිවන්ත වන පරිදි සෛල විසින් ප්රෝටියෝමයේ බහුලත්වය සහ නැමීම පාලනය කරන සියලුම ක්රියාවලීන් වෙත යොමු වේ. මෙම සමාලෝචනය පිටපත් කිරීමේ සාධකය NRF2 (න්යෂ්ටික සාධකය (එරිත්රොයිඩ්-ව්යුත්පන්න 2) වැනි 2) මගින් ක්රියාත්මක කරන ලද ප්රෝටෝස්ටැසිස් හි පිටපත් කිරීමේ මොඩියුලේෂන් පිළිබඳ වඩාත් අදාළ සොයාගැනීම් සාරාංශ කිරීමට උත්සාහ කරයි. NRF2 ප්රතිඔක්සිකාරක සෛල ප්රතිචාරයේ ප්රධාන නියාමකය ලෙස සම්භාව්යව සලකනු ලැබුවද, එය දැනට ප්රෝටෝස්ටැසිස් පවත්වා ගැනීම සඳහා සම්ප්රේෂණ යන්ත්රවල ප්රධාන අංගයක් ලෙස මතුවෙමින් පවතී. අප සාකච්ඡා කරන පරිදි, සම්බන්ධීකරණ සහ කල් පවතින පිටපත් කිරීමේ ප්රතිචාරයක් ගොඩනැගීම සඳහා වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය වීමෙන් ව්යුත්පන්න වූ හදිසි සංඥා සම්පාදනය කරන මධ්යස්ථානයක් ලෙස NRF2 අපේක්ෂා කළ හැකිය. මෙය සාක්ෂාත් කරගනු ලබන්නේ එන්ඩොප්ලාස්මික් රෙටිකුලම් කායික විද්යාව, ප්රෝටිසෝම සහ ස්වයංක්රීයව නඩත්තු කිරීම සඳහා සම්බන්ධ වන ජාන පාලනයට සම්බන්ධ NRF2 හි ක්රියාකාරකම් මගිනි.
ප්රධාන වචන: ස්නායු විකෘතිතා රෝග, දිග හැරුණු ප්රෝටීන් ප්රතිචාරය, ප්රෝටිසෝම, යූබික්විටින්, ස්වයංක්රීය, ඔක්සිකාරක ආතතිය
කෙටි යෙදුම්
Sciencedirect.com/science/article/pii/S2213231716304050
හැදින්වීම
න්යෂ්ටික සාධකය (එරිත්රොයිඩ්-ව්යුත්පන්න 2) වැනි 2 (NRF2) යනු මූලික-ලියුසීන්-සිපර් ප්රෝටීනයක් වන අතර එය වර්තමානයේ සෛලීය හෝමියස්ටැසිස් ප්රධාන නියාමකයෙකු ලෙස සැලකේ. එය ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය (ARE) [250], [1], [2], [3], [4] ලෙස හඳුන්වන සිස්-ක්රියාකාරී වර්ධකයක් පොදුවේ බෙදා ගන්නා ජාන 5 කට අධික සංඛ්යාවක මූලික සහ ආතතිය-ප්රේරණය කළ හැකි ප්රකාශනය පාලනය කරයි. මෙම ජාන I, II සහ III detoxification ප්රතික්රියා, glutathione සහ peroxiredoxin/thioredoxin පරිවෘත්තිය, පෙන්ටෝස් පොස්පේට් මාර්ගය හරහා NADPH නිෂ්පාදනය සහ මැලික් එන්සයිම, මේද අම්ල ඔක්සිකරණය, යකඩ පරිවෘත්තීය සහ ප්රෝටෝස්ටැසිස් [6] සඳහා සහභාගී වේ. මෙම පුළුල් සයිටොප්රොටෙක්ටිව් ක්රියාකාරකම් අනුව, NRF2 හි එක් ඖෂධීය පහරක් ඔක්සිකාරක, ගිනි අවුලුවන සහ ප්රෝටෝටොක්සික් ආතතිය ඇතුළු නිදන්ගත රෝගවල ප්රධාන වැරදිකරුවන්ගේ බලපෑම අවම කළ හැකිය. ප්රතිඔක්සිකාරක ආරක්ෂණයේ මොඩියුලේෂන් සහ දැවිල්ල නිරාකරණය කිරීමේදී NRF2 හි කාර්යභාරය බොහෝ අධ්යයනයන්හි දී ආමන්ත්රණය කර ඇත (සමාලෝචනය කරන ලද්දේ [7]). මෙහිදී, අපි ප්රෝටියෝස්ටැසිස් තුළ එහි භූමිකාව කෙරෙහි අවධානය යොමු කරමු, එනම් ප්රෝටීන් සංස්ලේෂණය, නැමීම, ජාවාරම් සහ ක්ෂය වීමේ හෝමියෝස්ටැටික් පාලනය. ස්නායු විකෘති රෝග පිළිබඳ සන්දර්භය තුළ උදාහරණ සපයනු ඇත.
ප්රෝටෝස්ටැසිස් නැතිවීම ස්නායු විකෘතිතා රෝග වලදී NRF2 ක්රියාකාරිත්වයට බලපායි
ස්නායු විකෘතිතා රෝග වල සාමාන්ය ලක්ෂණයක් වන්නේ සමහර ප්රෝටීන වල අපගමනය එකතු වීමයි. මේ අනුව, පාකින්සන් රෝගය (PD), ?-amyloid (A?) සමරු ඵලක සහ ඇල්සයිමර් රෝගයේ (AD), huntingtin (Htt) හි අධි-පොස්පරීකරණය කරන ලද TAU neurofibrillary tangles ?-synuclein (?-SYN) හි වැරදි ලෙස නැමුණු ප්රෝටීන් එකතුව දක්නට ලැබේ. හන්ටිංටන්ගේ රෝගය (HD), සුපර් ඔක්සයිඩ් ඩිස්මියුටේස් 1 (SOD1) සහ Amyotrophic lateral sclerosis (ALS) හි TAR DNA බන්ධන ප්රෝටීන් 43 (TDP-43), ස්පොන්ජිෆෝම් එන්සෙෆලෝපති වල ප්රියොන් ප්රෝටීන් (PrP) යනාදිය ප්රෝටීන් සමූහ කිහිපයක් කෙරෙහි බලපෑම් ඇති කළ හැකිය. සෛලීය මාර්ග, NRF2 මට්ටම් සහ ක්රියාකාරිත්වයට බලපානු ඇත.
නියාමනයේ විවිධ ස්ථර NRF2 ක්රියාකාරකම් දැඩි ලෙස පාලනය කරයි
කායික තත්වයන් යටතේ, සෛල එහි වේගවත් පිරිවැටුම නිසා අඩු NRF2 ප්රෝටීන් මට්ටම් ප්රදර්ශනය කරයි. විවිධ උත්තේජකවලට ප්රතිචාර වශයෙන්, NRF2 ප්රෝටීන් සමුච්චය වී, න්යෂ්ටියට ඇතුළු වන අතර ARE අඩංගු ජානවල පිටපත් කිරීම වැඩි කරයි. එබැවින්, NRF2 ප්රෝටීන් මට්ටම් කළමනාකරණය ධනාත්මක සහ සෘණ ආදාන සංඥා ඒකාබද්ධ කළ යුතු ප්රධාන කරුණකි. අපි තවදුරටත් සාකච්ඡා කරන පරිදි, වේගවත් හා කාර්යක්ෂම ප්රතිචාරයක් සැකසීම සඳහා NRF2 විවිධ අතිච්ඡාදනය වන යාන්ත්රණ මගින් සක්රිය කර ඇති නමුත් අනෙක් අතට NRF2 එහි ප්රතිචාරය ක්රියා විරහිත කිරීම සඳහා බොහෝ විට දෙවන අදියරේදී වළක්වා ගත හැකිය.
සම්භාව්ය දෘෂ්ටි කෝණයෙන්, NRF2 සක්රිය කිරීම ඔක්සිකාරක හෝ ඉලෙක්ට්රොෆිලික් සංයෝග සඳහා සෛලීය ප්රතිචාරයේ ප්රතිවිපාකයක් ලෙස සැලකේ. මේ සම්බන්ධයෙන්, ubiquitin E3 ligase ඇඩැප්ටරය Kelch වැනි ECH-ආශ්රිත ප්රෝටීන් 1 (KEAP1) තීරණාත්මක කාර්යභාරයක් ඉටු කරයි. අණුක විස්තර 4.1 වගන්තියේ තවදුරටත් ආමන්ත්රණය කෙරේ. කෙටියෙන් කිවහොත්, NRF1 සර්වජනනය සහ ප්රෝටිසෝම පරිහානියට තුඩු දෙන තීරණාත්මක සිස්ටීන් අපද්රව්ය හේතුවෙන් KEAP2 රෙඩොක්ස් සංවේදකයක් ලෙස ක්රියා කරයි. මෙම සම්භාව්ය මොඩියුලේෂන් වලට අමතරව, NRF2 සං signal ා සිදුවීම් මගින් ගැඹුරින් නියාමනය කරනු ලැබේ. ඇත්ත වශයෙන්ම, විවිධ කයිනේස් NRF2 ෆොස්ෆොරයිලේට් සහ නියාමනය කිරීමට පෙන්වා ඇත. උදාහරණයක් ලෙස, NRF2 මයිටොජන් සක්රීය ප්රෝටීන් කයිනේස් (MAPKs) මගින් පොස්පරීකරණය කළ හැක, නමුත් NRF2 ක්රියාකාරකම් සඳහා එහි දායකත්වය අපැහැදිලිව පවතී [8], [9], [10], [11]. PKA kinase මෙන්ම සමහර PKC isozymes [12], CK2 [13] හෝ Fyn [14] phosphorylate NRF2 එහි ස්ථායීතාවය වෙනස් කරයි. අපගේ කණ්ඩායමේ පෙර වැඩ වාර්තා කළේ glycogen synthase kinse-3? (GSK-3?) NRF2 න්යෂ්ටික බැහැර කිරීම් සහ ප්රෝටිසෝම පරිහානිය [15], [25], [26], [27], [28], [29], [30] මගින් වළක්වයි. අණුක විස්තර 4.1 වගන්තියේ සාකච්ඡා කෙරේ. තවද, NRF2 වෙනත් ආකාරයේ රෙගුලාසි වලට ඉදිරිපත් කෙරේ. නිදසුනක් ලෙස, CBP/p2 මගින් NRF300 ඇසිටයිලේෂන් එහි ක්රියාකාරිත්වය වැඩි කරයි [17], එය miR153, miR27a, miR142-5p, සහ miR144 [16] මගින් නිෂේධනය වේ, නැතහොත් NRF2 ප්රවර්ධනය කරන NRF18 දූපත් තුළ ඇති සයිටොසීන්-ගුවානීන් මෙතිලේෂන් මගින්. [XNUMX].
NRF2 නියාමන යාන්ත්රණ මත ප්රෝටීන් සමස්ථයන්ගේ බලපෑම
මෙම කොටසේදී අපි අවධානය යොමු කරන්නේ වැරදි ලෙස නැමුණු ප්රෝටීන් සමුච්චය වීම NRF2 ක්රියාකාරිත්වයට බලපාන්නේ කෙසේද යන්න පිළිබඳව ඉහත සඳහන් කළ සමහර මාර්ග නිදර්ශන උදාහරණ ලෙස සපයයි. පළමුව, ප්රෝටීන් සමුච්චය ඔක්සිකාරක හානිය සමඟ තදින් සම්බන්ධ වී ඇති බව අප සලකා බැලිය යුතුය. ඇත්ත වශයෙන්ම, වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය කිරීම සහ එකතු කිරීම මයිටොකොන්ඩ්රියා සහ අනෙකුත් ප්රභවයන්ගෙන් ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ (ROS) අසාමාන්ය ලෙස නිෂ්පාදනය කිරීමට හේතු වේ [19]. ඉහත සඳහන් කළ පරිදි, ROS විසින් KEAP1 හි රෙඩොක්ස්-සංවේදී සිස්ටයින් වෙනස් කිරීම, NRF2 මුදා හැරීම, ස්ථායීකරණය සහ න්යෂ්ටික ස්ථානගත කිරීම සිදු කරයි.
ප්රෝටීන් රෝග සම්බන්ධයෙන්, NRF2ට බලපෑ හැකි අක්රමික සංඥා සිදුවීම් සඳහා උදාහරණයක් GSK-3 හි අධි ක්රියාකාරීත්වය මගින් සපයනු ලැබේද? ක්රි.ව. GSK-3?, TAU kinase ලෙසද හැඳින්වේ, මෙම ක්ෂුද්ර නල ආශ්රිත ප්රෝටීනයේ පොස්පරීකරණයට සහභාගී වන අතර, එහි ප්රතිඵලයක් ලෙස එහි එකතුවීම, ස්නායු ෆයිබ්රිලරි පටලැවිල්ල සහ අක්ෂීය ප්රවාහනයට බාධා ඇති වේ ([20] සමාලෝචනය කරන ලදී). අනෙක් අතට, GSK-3? ඉහත සඳහන් කළ පරිදි NRF2 මට්ටම් සහ ක්රියාකාරකම් නාටකාකාර ලෙස අඩු කරයි. පුළුල් ලෙස පිළි නොගත්තද, ඇමයිලොයිඩ් කඳුරැල්ල යෝජනා කරන්නේ එම විෂ සහිත A? oligomers GSK-3 වැඩි කරනවාද? TAU අධි-පොස්පරීකරණය සහ නියුරෝන මරණය සමඟ එක්ව ක්රියාකාරකම් [21], [22]. A කෙසේද යන්න පැහැදිලි කිරීමට විවිධ මාදිලි තිබේ. GSK3-ට කැමතිද? ක්රියාකාරිත්වය. උදාහරණයක් ලෙස, A? ඉන්සියුලින් ප්රතිග්රාහකයට බන්ධනය වන අතර GSK-3 පවත්වා ගැනීමට තීරනාත්මක වන PI3K සහ AKT සංඥා මාර්ග වලක්වයි? එහි N-පර්යන්ත Ser9 අවශේෂ [23] හි පොස්පරීකරණය මගින් අක්රිය කර ඇත. අනෙක් අතට, බාහිර සෛල A? Frizzled receptors සමඟ අන්තර්ක්රියා කරයි, WNT සංඥා අවහිර කරයි [24] සහ නැවත ක්රියාකාරී GSK-3 මුදා හැරීමට හේතු වේ. සාරාංශයක් ලෙස, A? සමුච්චය වීම GSK-3 හි අසාමාන්ය අධි ක්රියාකාරීත්වයට හේතු වේ.
පහත කොටසේ සාකච්ඡා කර ඇති පරිදි, වැරදි ලෙස නැමුණු ප්රෝටීන PERK සහ MAPK සක්රිය කිරීමට හේතු වන අතර, එය NRF2 [31], [8], [9], [10], [11] වැඩි කරයි. එපමනක් නොව, ප්රෝටීනෝපති කිහිපයක අක්රමික CBP/p300 ක්රියාකාරකම් වාර්තා වී ඇත [32] සහ AD මොළයේ DNA මෙතිලේෂන් හි ගෝලීය අඩුවීමක් ද පෙන්නුම් කරන ලදී [33], එබැවින් NRF2 නියාමනයේ මෙම සොයාගැනීම්වල අදාළත්වය ගවේෂණය කිරීමට හේතු සපයයි.
අපි සහ අනෙකුත් අය PD සහ AD රෝගීන්ගේ මළසිරුර පරීක්ෂා කිරීමේදී NRF2 ප්රෝටීන් මට්ටම්වල වැඩි වීමක් සහ එහි සමහර ඉලක්ක වන හීම් ඔක්සිජන්සේස් 1 (HMOX1), NADPH ක්විනෝන් ඔක්සිඩේස් 1 (NQO1), p62, ආදිය, immunoblot මගින් නිරීක්ෂණය කර ඇත. immunohistochemistry මගින් [34], [35], [36], [37], [38], [39]. මෙම රෝග සඳහා NRF2 ඉහළ-නියාමනය අර්ථකථනය කරනු ලබන්නේ හෝමියෝස්ටැටික් අගයන් යථා තත්ත්වයට පත් කිරීමට රෝගී මොළයේ අසාර්ථක උත්සාහයක් ලෙසිනි. කෙසේ වෙතත්, තවත් අධ්යයනයකින් පෙන්නුම් කළේ NRF2 ප්රධාන වශයෙන් AD හිපොකැම්පල් නියුරෝන වල සයිටොප්ලාස්මයේ ස්ථානගත වී ඇති අතර, මොළයේ NRF2 පිටපත් කිරීමේ ක්රියාකාරකම් අඩු වන බව යෝජනා කරයි [40]. මෙම නිරීක්ෂණවල අසමානතාවය ස්නායු පරිහානියේ ප්රගතිශීලී අවධීන් ඔස්සේ NRF2 පාලනය කරන සාධකවල වෙනස්කම් වලට සම්බන්ධ බව සිතිය හැකිය.
ප්රධාන පද්ධති තුනක් ප්රෝටෝස්ටැසිස් සඳහා දායක වේ, එනම් දිග හැරුණු ප්රෝටීන් ප්රතිචාරය (UPR), ubiquitin proteasome පද්ධතිය (UPS) සහ ස්වයංක්රීයකරණය. මීළඟට, ප්රෝටීන් ව්යුත්පන්න යන්ත්රෝපකරණ සමඟ ප්රෝටීන එකතුවෙන් සක්රිය කරන ලද හදිසි සංඥා සම්බන්ධ කරන මධ්යස්ථානයක් ලෙස NRF2 සිතීමට අපි සාක්ෂි ඉදිරිපත් කරමු.
NRF2 දිග හැරෙන ප්රෝටීන් ප්රතිචාරයට (UPR) සහභාගී වේ.
UPR වලට ප්රතිචාර වශයෙන් NRF2 සක්රීය කිරීම
ER හි ඔක්සිකාරක ප්රෝටීන් නැමීම වෙනස් මාර්ග ගණනාවකින් මෙහෙයවනු ලබන අතර, ඒවායින් වඩාත්ම සංරක්ෂණය වී ඇත්තේ ප්රෝටීන් ඩයිසල්ෆයිඩ්-අයිසෝමරේස් (PDI) සහ ක්ෂීරපායීන්ගේ සල්ෆයිඩ්රයිල් ඔක්සිඩේස් එන්ඩොප්ලාස්මික් ඔක්සිඩෝඩෙක්ටින් 1 (ERO1? සහ ERO1?) ඩයිසල්ෆයිඩ් පරිත්යාගශීලීන් ලෙසය. කෙටියෙන් කිවහොත්, PDI විසින් ප්රෝටීන තුළ ඇති සිස්ටීන් අපද්රව්ය අතර ඩයිසල්ෆයිඩ් බන්ධන සෑදීම සහ කැඩීම උත්ප්රේරණය කරයි, ඒවා නැමෙන විට, එහිම cysteine ඇමයිනෝ අම්ල අඩු කිරීම සහ ඔක්සිකරණය වීම හේතුවෙන්. PDI ප්රතිචක්රීකරණය කරනු ලබන්නේ ගෘහ පාලන එන්සයිමය ERO1 ක්රියාව මගිනි, එය ඩයිසල්ෆයිඩ් බන්ධන PDI වෙත නැවත හඳුන්වා දෙයි [41]. අණුක ඔක්සිජන් යනු ERO1 හි පර්යන්ත ඉලෙක්ට්රෝන ප්රතිග්රාහකය වන අතර එය නිපදවන සෑම ඩයිසල්ෆයිඩ් බන්ධනයක් සඳහාම හයිඩ්රජන් පෙරොක්සයිඩ් ස්ටෝයිකියෝමිතික ප්රමාණයන් ජනනය කරයි [42]. Peroxidases (PRX4) සහ glutathione peroxidases (GPX7 සහ GPX8) ER හි හයිඩ්රජන් පෙරොක්සයිඩ් අඩු කිරීමට ප්රධාන එන්සයිම වේ. මෙම ඔක්සිඩෝ-අඩු කිරීමේ පද්ධතිය නිසියාකාරව ක්රියා නොකරන විට, වැරදි ලෙස නැමුණු ප්රෝටීන වල අසාමාන්ය සමුච්චය ER තුළ සිදු වන අතර, දිග හැරුණු ප්රෝටීන් ප්රතිචාරය (UPR) නම් සංඥා මාලාවක් ER homeostasis නැවත ස්ථාපිත කිරීම සඳහා සයිටොප්ලාස්මයට සහ න්යෂ්ටිය වෙත සම්ප්රේෂණය වේ [43]. යුකැරියෝට් වල ER ආතතිය සංවේදනය කිරීම සඳහා පටල ආශ්රිත ප්රෝටීන තුනක් හඳුනාගෙන ඇත: පිටපත් කිරීමේ සාධකය 6 (ATF6), අග්න්යාශයේ ER eIF2 සක්රීය කිරීම? kinase (PERK, ද්විත්ව නූල් සහිත RNA-සක්රීය ප්රෝටීන් kinase-වැනි ER kinase), සහ inositol-අවශ්ය kinase1 (IRE1). එක් එක් සංවේදකයේ ලුමිනල් වසම ග්ලූකෝස් නියාමනය කරන ලද ප්රෝටීන් (GRP78/BIP) ලෙස හඳුන්වන 78 kDa chaperone සමඟ බැඳී ඇත. දිග හැරුණු ප්රෝටීන බන්ධනය කිරීමට BIP ER ආතතිය මත විඝටනය වන අතර, සංවේදක තුන සක්රිය කිරීමට තුඩු දෙයි [44].
ප්රතිඔක්සිකාරක ප්රතිචාරයට සම්බන්ධ NRF2 සහ එහි සමලිංගික NRF1, UPR න්යෂ්ටිය වෙත සම්ප්රේෂණය කිරීමට සහභාගී වේ. NRF1 සම්බන්ධයෙන් ගත් කල, මෙම ප්රෝටීනය ER පටලයෙහි පිහිටා ඇති අතර deglycosylation හෝ cleavage මත න්යෂ්ටික මාරුවකට භාජනය වේ. ඉන්පසුව, UPR සක්රිය කිරීම NRF1 සැකසීමට සහ න්යෂ්ටික මැදිරිය තුළ ඇති වන කොටසෙහි න්යෂ්ටික සමුච්චය වීමට හේතු වේ. කෙසේ වෙතත්, මෙම NRF1 කොටසෙහි ARE අඩංගු ජාන පරිවර්තන කිරීමේ හැකියාව තවමත් සාකච්ඡා මට්ටමේ පවතී [45].
Glover-Cutter සහ සම-සේවකයින් C. elegans හි NRF2 orthologue, SKN-1, විවිධ ER ආතතීන් සමඟ සක්රීය කිරීම පෙන්නුම් කළහ. වැඩි වූ SKN-1 ප්රකාශනය IRE1 හෝ PERK worm orthologues [46] ඇතුළු විවිධ UPR මැදිහත්කරුවන් මත රඳා පවතී. PERK-අඩුපාඩු සහිත සෛල තුළ, දුර්වල වූ ප්රෝටීන් සංස්ලේෂණය අන්තරාසර්ග පෙරොක්සයිඩ් සමුච්චය වීමට සහ පසුව ඇපොප්ටෝසිස් වලට මඟ පාදයි [47]. මෙම පෙරොක්සයිඩ් වලින් ER ආරක්ෂා කිරීම සඳහා PERK විසින් භාවිතා කරන බලපෑම NRF2 විය හැකිය, මන්ද එය PERK ෆොස්ෆොරයිලේට් NRF2 Ser40 හි ඇති බව වාර්තා වී ඇති අතර එමඟින් KEAP1 [31] මගින් එහි ක්ෂය වීම වළක්වයි. IRE1 [2] හි TRAF1-මැදිහත් වූ kinase ක්රියාව හරහා ASK48 ප්රේරණය ද මෙම මාර්ගයේ කාර්යභාරයක් ඉටු කිරීමට ඉඩ ඇත. NRF2 නියාමනය කිරීමේදී MAPK වල භූමිකාව තවමත් මතභේදාත්මක වුවද, IRE1-TRAF2-ASK1-JNK මාර්ගය NRF2 [49] සක්රිය කළ හැකි බවට මෑතකදී යෝජනා විය (රූපය 1). සිත්ගන්නා කරුණ නම්, C. elegans සහ මානව සෛල තුළ, නව සාක්ෂි යෝජනා කරන්නේ IRE1 kinase හි cysteine sulfenylation එහි සක්රීය ලූපයේ IRE1-මැදිහත් වූ UPR වලක්වන අතර NRF38 මගින් මෙහෙයවනු ලබන p2 ප්රතිඔක්සිකාරක ප්රතිචාරයක් ආරම්භ කරන බවයි. දත්ත වලට අනුව IRE1 හට p38 සහ NRF2 [50] සක්රීය කරන සයිටොප්ලාස්මික් සෙන්ටිනල් ලෙස පුරාණ කාර්යයක් ඇත.
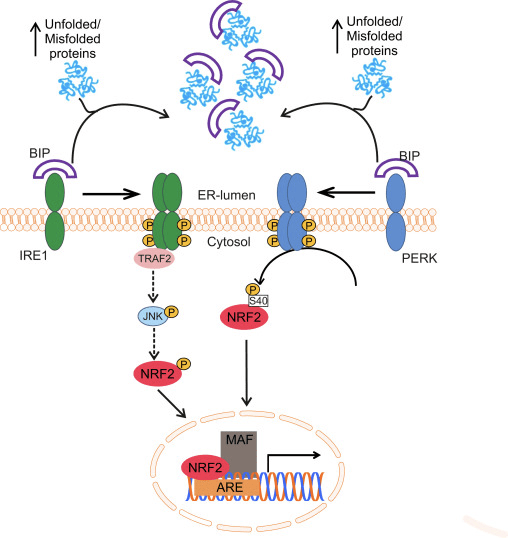 රූපය 1 UPR මගින් NRF2 නියාමනය. එන්ඩොප්ලාස්මික් රෙටිකුලම් තුළ දිග හැරුණු හෝ වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය වීම දිග හැරුණු ප්රෝටීන් ප්රතිචාරය (UPR) ආරම්භ කළ හැකිය. පළමුව, දිග හැරුණු/වැරදි නැමුණු ප්රෝටීන බන්ධනය කිරීම සඳහා ER සංවේදක IRE1 සහ PERK හි අභ්යන්තර වසම වෙතින් chaperone BIP මුදා හරිනු ලැබේ. මෙය ඔවුන්ගේ සයිටොසොලික් වසම්වල ඩයිමර්කරණය සහ ට්රාන්ස්-ස්වයං-පොස්පරීකරණය සක්රීය කරයි. PERK සක්රීය කිරීම Ser2 හි සෘජු NRF40 පොස්පරීකරණයක් ඇති කරයි, NRF2 න්යෂ්ටිය වෙත මාරුවීමට සහ ඉලක්කගත ජාන සක්රීය කිරීමට හේතු වේ. IRE1 සක්රිය කිරීම TRAF2 බඳවා ගැනීම ප්රේරණය කරයි, පසුව ASK1 සහ JNK පොස්පරීකරණය සහ සක්රිය කිරීම. JNK ෆොස්ෆොරයිලේට් සහ NRF2 සක්රිය කිරීමට වාර්තා කර ඇති බැවින්, IRE1 සක්රිය කිරීම NRF2 ක්රියාකාරකම් වැඩි කිරීමට හේතු වනු ඇතැයි සිතීම සාධාරණ ය.
රූපය 1 UPR මගින් NRF2 නියාමනය. එන්ඩොප්ලාස්මික් රෙටිකුලම් තුළ දිග හැරුණු හෝ වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය වීම දිග හැරුණු ප්රෝටීන් ප්රතිචාරය (UPR) ආරම්භ කළ හැකිය. පළමුව, දිග හැරුණු/වැරදි නැමුණු ප්රෝටීන බන්ධනය කිරීම සඳහා ER සංවේදක IRE1 සහ PERK හි අභ්යන්තර වසම වෙතින් chaperone BIP මුදා හරිනු ලැබේ. මෙය ඔවුන්ගේ සයිටොසොලික් වසම්වල ඩයිමර්කරණය සහ ට්රාන්ස්-ස්වයං-පොස්පරීකරණය සක්රීය කරයි. PERK සක්රීය කිරීම Ser2 හි සෘජු NRF40 පොස්පරීකරණයක් ඇති කරයි, NRF2 න්යෂ්ටිය වෙත මාරුවීමට සහ ඉලක්කගත ජාන සක්රීය කිරීමට හේතු වේ. IRE1 සක්රිය කිරීම TRAF2 බඳවා ගැනීම ප්රේරණය කරයි, පසුව ASK1 සහ JNK පොස්පරීකරණය සහ සක්රිය කිරීම. JNK ෆොස්ෆොරයිලේට් සහ NRF2 සක්රිය කිරීමට වාර්තා කර ඇති බැවින්, IRE1 සක්රිය කිරීම NRF2 ක්රියාකාරකම් වැඩි කිරීමට හේතු වනු ඇතැයි සිතීම සාධාරණ ය.
යූපීආර් ප්රේරණය පිළිබඳ බොහෝ අධ්යයනයන් ප්රෝටීන් ග්ලයිකොසිලේෂන් ටියුනිකාමයිසින් නිෂේධකය සමඟ සිදු කර ඇත. Tunicamycin-induced apoptotic සෛල මරණය වැළැක්වීම සඳහා NRF2 අත්යවශ්ය බව පෙනේ [31] සහ මෙම තත්වයන් යටතේ එහි ක්රියාකාරීත්වය KEAP1 [51] හි ස්වයංක්රීය පරිහානිය මගින් මෙහෙයවනු ලැබේ. ඒ අනුව, murine insulinoma ?-සෛල රේඛාවක් වන ?TC-2 සෛල තුළ NRF6 ප්රකාශනයේ shRNA-මැදිහත්වීම නිශ්ශබ්ද කිරීම, tunicamycin-induced cytotoxicity සැලකිය යුතු ලෙස වැඩි කළ අතර CHOP10 ගැති ER ආතති සලකුණෙහි ප්රකාශනය වැඩි කිරීමට හේතු විය. අනෙක් අතට, 2-ඩිතියෝල්-1,2-තයෝන් (D3T) මගින් NRF3 සක්රීය කිරීම tunicamycin සයිටොටොක්සිසිටි අඩු කළ අතර CHOP10 සහ PERK [52] ප්රකාශනය දුර්වල කළේය. සිත්ගන්නා කරුණ නම්, tunicamycin පද්ධතිමය යෙදීම සඳහා ඉදිරිපත් කරන ලද ආඝ්රාණ නියුරෝන CHOP, BIP, XBP2 [1] වැනි අනෙකුත් UPR සාමාජිකයන් සමඟ සමාන්තරව NRF53 වැඩි කිරීමයි. මෙම ප්රතිඵල vivo අධ්යයනයන් දක්වා දීර්ඝ කර ඇත, මීයන් තුළ tunicamycin හි පාර්ශ්වික කශේරුකා මුදල් සම්භාරයක් වියදම් කිරීම මගින් හිපොකැම්පස් හි PERK සහ NRF2 ප්රකාශනය වීම නිසා සැලකිය යුතු සංජානන ඌනතාවයන්, TAU පොස්පරීකරණය සහ A?42 තැන්පතු වැඩි වීම [54].
NRF2 ඉහළ-ඊආර් කායික විද්යාව නඩත්තු කිරීම සඳහා ප්රධාන ජාන නියාමනය කරයි
ඩයිසල්ෆයිඩ් රසායනය පවත්වා ගැනීම සඳහා ER lumen හට සයිටොසෝල් වෙතින් GSH බහුල සැපයුමක් අවශ්ය වේ. NRF2 මොළයේ GSH පරිවෘත්තීය ක්රියාවලියේ තීරණාත්මක එන්සයිම මොඩියුලේට් කරයි, එනම් cystine/glutamate ප්රවාහනය, ?-glutamate cysteine synthetase (?-GS), glutamate-cysteine ligase catalytic and modulator subunits (GCLC සහ GCLRMduct), gaselutathione Gase. glutathione peroxidase (GPX) (සමාලෝචනය [55]). ER හි GSH නඩත්තු කිරීමේදී NRF2 හි අදාළත්වය NRF2 හි c ෂධීය හෝ ජානමය සක්රීය කිරීම GCLC/GCLM හරහා GSH සංශ්ලේෂණය වැඩි කිරීමට හේතු වන බව සොයා ගැනීමෙන් සහය දක්වයි, නමුත් NRF2-knockdown මගින් මෙම එන්සයිමවල ප්රකාශනය වැළැක්වීම හානියට පත් සමුච්චය වීමට හේතු විය. UPR සක්රිය කිරීමට තුඩු දෙන ER තුළ ඇති ප්රෝටීන [56].
C. elegans හි Ire1, Xbp1 සහ Atf1 ඇතුළුව SKN-6 මගින් නියාමනය කරන ලද UPR ඉලක්ක ජානවල සංරචක කිහිපයක්. NRF2 ක්ෂීරපායීන්ගේ පෙරොක්සිඩේස් (PRX) සහ ග්ලූටතයෝන් පෙරොක්සිඩේස් (GPX) ජාන කිහිපයක ප්රකාශනය ඉහළ-නියාමනය කරයි ([57] හි සමාලෝචනය කරන ලදී), GPX8 පමණක් KDEL නැවත ලබා ගැනීමේ සංඥාව රඳවා තබා ගන්නා සත්යවාදී ER-දේශීය එන්සයිමයකි. GPX58 නැතිවීම UPR සක්රීය කිරීම, ERO8?-ව්යුත්පන්න හයිඩ්රජන් පෙරොක්සයිඩ් සයිටොසෝල් වෙත කාන්දු වීම සහ සෛල මියයාමට හේතු වේ. හයිඩ්රජන් පෙරොක්සයිඩ් ERO1 වලින් ලබාගත් එකක්ද? GPX1 සහ PRX8 [4] වල සාමූහික ක්රියාව හේතුවෙන් ක්රියාකාරකම ER සිට cytosol දක්වා විසරණය විය නොහැක. මේ සම්බන්ධයෙන්, වල් වර්ගයේ සහ NRF59-ශුන්ය මීයන්ගේ පටක වලින් RNA භාවිතා කරමින් ප්රතිඔක්සිකාරක ආරක්ෂක මාර්ග-ජාන ප්රකාශන අරාව විශ්ලේෂණය කිරීමෙන් හෙළි වූයේ NRF2 [8] නොමැති විට GPX2 හි ප්රකාශනය අඩු-නියාමනය වී ඇති බවයි. මෙයට අනුකූලව, myeloproliferative neoplasms, polycythemia හෝ myelofibrosis වලින් පෙළෙන රෝගීන්ගේ සාම්පලවල පිටපත් විශ්ලේෂණය, ඔක්සිකාරක ආතතිය සහ අඩු ශ්රේණියේ නිදන්ගත දැවිල්ල සමඟ සම්බන්ධ වන රෝග, පාලන විෂයයන් සමඟ සසඳන විට NRF60 සහ GPX2 යන දෙකෙහිම අඩු ප්රකාශන මට්ටම් පෙන්වයි [8]. මිනිස් මොළය ආරක්ෂා කිරීම සඳහා GPX61 විශේෂයෙන් සම්බන්ධ වන අධ්යයනයන් තවමත් නොමැත, නමුත් මීයන් තුළ පිටපත් කිරීමේ විශ්ලේෂණයක් පාකින්සෝනියානු විෂ එම්පීටීපී වෙත ප්රතිචාර වශයෙන් වන්දි ගෙවීමේ GPX8 වැඩි වීමක් පෙන්නුම් කරයි [8].
ස්නායු විකෘති රෝග වල UPR අක්රියතාවයට NRF2 හි බලපෑම
PDI එන්සයිම වල ක්රියා විරහිත වීම සහ UPR නිදන්ගත සක්රීය කිරීම, පසුව ස්නායු පරිහානිය ආරම්භ කිරීම හෝ වේගවත් කිරීම සිදු කරයි. රෝගයෙන් පීඩාවට පත් වූ නියුරෝන, ස්නායු විකෘතිතා රෝග පිළිබඳ සත්ව ආකෘති මෙන්ම පශ්චාත් මරණ පරීක්ෂණ මානව පටක මෙම ආබාධ බොහෝමයක් තුළ UPR-සලකුණු කිහිපයක් ඉහළ-නියාමනය කරන ලදී. ස්නායු විකෘතිතා රෝග වල PDI/UPR මාර්ගය වෙනස් කිරීම [63] තුළ මනාව සමාලෝචනය කර ඇති නමුත් මොළයේ පශ්චාත් මරණ පරීක්ෂණ සාම්පලවල පහත සඳහන් උද්දීපනයන් සලකා බැලිය යුතුය. පැටලිලි සහිත නියුරෝන වල සහ AD සහ PD රෝගීන්ගේ Lewy Bodies වල PDI මට්ටම් වැඩි වේ, පිළිවෙලින් [64], [65]. PDI සහ ERP57 CSF හි ALS රෝගීන්ගෙන් සහ CJD විෂයයන්ගෙන් [66], [67], [68] මොළයේ නියාමනය කරනු ලැබේ. BIP, PERK, IRE1 සහ ATF6 AD, PD හෝ ALS [69], [70], [71], [67] ඇති රෝගීන්ගේ සාම්පලවල වැඩි වේ. පශ්චාත් මරණ පරීක්ෂණ මොළයේ සාම්පල HD [1], [72] වලින් BIP, CHOP සහ XBP73 ඉහළ නංවා ඇත. එපමනක් නොව, CJD රෝගීන්ගෙන් ERP57, GRP94 සහ BIP ඉහළ-නියාමනය බාහිකයේ පටක වල සොයා ගන්නා ලදී [74]. සමස්තයක් වශයෙන්, මෙම සාක්ෂියෙන් හෙළි වන්නේ මොළයේ පරෙන්චිමා තුළ වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය වීම UPR හි හානිකර සහ නිදන්ගත සක්රිය වීමට හේතු වන බවයි. සිත්ගන්නා කරුණ නම්, ක්රි.ව මුල් භාගයේදී PERK මගින් NRF2 සක්රිය කිරීම සම්බන්ධ කරන මෑත අධ්යයනයක් තිබීමයි. මෙම අධ්යයනයේ දී, කතුවරුන් විසින් NRF2 සහ UPR හි ඔක්සිකාරක ආතතිය මැදහත් වූ වෙනස්කම් මානව පර්යන්ත රුධිර සෛල සහ විවිධ රෝග අවස්ථා වලදී AD සංක්රාන්ති මූසික ආකෘතියක් භාවිතා කිරීමෙන් AD ව්යාධිජනකයේ මුල් සිදුවීම් සෑදිය හැකිද යන්න විශ්ලේෂණය කළහ. මෘදු සංජානන දුර්වලතා ඇති පුද්ගලයින්ගෙන් හුදකලා වූ මානව පර්යන්ත රුධිර ඒක න්යෂ්ටික සෛලවල ඔක්සිකාරක ආතතිය වැඩි වීම සහ pSer40-NRF2 වැඩි වීම නිරීක්ෂණය විය. එපමනක් නොව, ඔවුන් මෘදු සංජානන දුර්වලතා සහ මෘදු AD [75] ඇති පුද්ගලයින්ගෙන් මෙම සෛලවල දුර්වල වූ ER කැල්සියම් හෝමියස්ටැසිස් සහ ඉහළ-නියාමනය කරන ලද ER-ආතති සලකුණු වාර්තා කරන ලදී.
NRF2 සහ Ubiquitin Proteasome'System (UPS) හි අන්යෝන්ය නියාමනය
UPS NRF2 ප්රෝටීන් මට්ටම් මොඩියුලේට් කරයි
UPS හානියට පත් හෝ වැරදි ලෙස නැමුණු ප්රෝටීන වල ක්ෂය වීමට සහභාගී වන අතර සයිටොසෝල් සහ න්යෂ්ටියේ ප්රධාන නියාමන අණු මට්ටම් පාලනය කරයි. මෙම පද්ධතියේ කේන්ද්රීය හරය 20S නම් වූ ප්රෝටියෝලයිටික් සක්රීය සංකීර්ණයක් අඩංගු විශාල බහු අනුකාරක එන්සයිමයකි. 20S core proteasome දිගහැරුණු ප්රෝටීන පිරිහීමට ලක් කරයි, නමුත් විවිධ නියාමන ප්රෝටීන් සංකීර්ණ වලට බන්ධනය වීම එහි උපස්ථර නිශ්චිතභාවය සහ ක්රියාකාරකම් වෙනස් කරයි. නිදසුනක් ලෙස, 19S හරයට 20S නියාමන අනු ඒකක එකක් හෝ දෙකක් එකතු කිරීම 26S ප්රෝටිසෝමයක් වන අතර ස්වදේශීය නැමුණු ප්රෝටීන වෙත එහි විශේෂත්වය වෙනස් කරයි [76], [77]. ප්රෝටිසෝම පරිහානියට ubiquitin හි සහසංයුජ බන්ධනය අවශ්ය වේ. ubiquitin සංයෝජන ක්රියාවලිය තුන්-පියවර කඳුරැල්ල යාන්ත්රණයක් හරහා සිදුවේ. පළමුව, ubiquitin-සක්රීය එන්සයිමය E1 ATP-අවශ්ය ප්රතික්රියාවක ubiquitin සක්රීය කරයි. ඉන්පසුව, එක් E2 එන්සයිමයක් (ubiquitin-වාහක ප්රෝටීන් හෝ ubiquitin-conjugating enzyme) සක්රිය ubiquitin E1 සිට E3 නම් ubiquitin-protein ligase පවුලේ සාමාජිකයෙකුට විශේෂයෙන් බැඳී ඇති උපස්ථරයට මාරු කරයි. ubiquitinated-protein වල නියම ඉරණම ubiquitin දාමයේ ස්වභාවය මත රඳා පවතිනු ඇතත්, මෙම ක්රියාවලිය සාමාන්යයෙන් 26S ප්රෝටිසෝමයෙන් පිරිහීමකට ලක්වේ [78].
E3-ligase KEAP1 NRF2 හි හොඳම නිෂේධකය වේ. KEAP1 නියාමනයේ යාන්ත්රණය NRF2 මට්ටම් ඔක්සිකාරක උච්චාවචනයන්ට ගැලපෙන ආකාරය අලංකාර ලෙස පැහැදිලි කරයි. බාසල් තත්ත්වයන් යටතේ, අලුතින් සංස්ලේෂණය කරන ලද NRF2 homodimer KEAP1 මගින් ග්රහණය කර ගන්නා අතර, එය එක් NRF2 අණුවක් ඇමයිනෝ අම්ල අනුක්රම දෙකකදී අඩු (aspartate, leucine, glycine; DLG) සහ ඉහළ (glutamate, threonine, glycine, gluta) සමඟ බන්ධනය කරයි. KEAP1 සමඟ අන්තර්ක්රියා මගින් NRF2 CULIN3/RBX1 ප්රෝටීන් සංකීර්ණයට ඉදිරිපත් කිරීමට උපකාරී වන අතර, එහි ප්රතිඵලයක් ලෙස එහි සර්ව ව්යාප්තිය සහ පසුව ප්රෝටිසෝම පරිහානිය සිදුවේ. කෙසේ වෙතත්, KEAP1 හි රෙඩොක්ස් වෙනස් කිරීම CULIN2/RBX3 මගින් නියෝජනය කරන UPS වෙත NRF1 ඉදිරිපත් කිරීමට බාධා කරයි. එහි ප්රතිඵලයක් වශයෙන්, අලුතින් සංස්ලේෂණය කරන ලද NRF2 KEAP1 මත යැපෙන පරිහානියෙන් ගැලවී, න්යෂ්ටිය තුළ එකතු වී ARE අඩංගු ජාන [79], [80], [81], [82] සක්රීය කරයි.
E3-ligase ඇඩැප්ටරය ?-TrCP යනු GSK-2 මගින් NRF3 හි පොස්පරීකරණයට අදාළ සංඥාකරණ සිදුවීම් වලට සහභාගී වන සමලිංගිකයකි. මෙම kinase NRF2 (aspartate, serine, glycine, isoleucine serine; DSGIS) හි නිශ්චිත සෙරීන් අපද්රව්ය පොස්පරීකරණය කර පසුව ?-TrCP මගින් හඳුනාගෙන CULLIN1/RBX1/RBX3 සංකීර්ණයක් මගින් ප්රෝටීසෝම පරිහානිය සඳහා ටැග් කරන ලද degradation domain නිර්මාණය කරයි. GSK-6 මගින් පොස්පරීකරණය කරන ලද විශේෂිත ඇමයිනෝ අම්ල හඳුනාගැනීම? මෙම degron තුළ Neh2 වසමෙහි අඩවියට යොමු කරන ලද විකෘතිය, 15D-ජෙල් ඉලෙක්ට්රෝෆොරෙසිස් [26], [83] සහ ස්කන්ධ වර්ණාවලීක්ෂය [3] යන සංයෝජන මගින් සිදු කරන ලදී. ප්රතිඵලයක් වශයෙන්, GSK-3 නිෂේධනය? GSK-2 සමස්ථානික වලට එරෙහිව ඉතා වරණීය ඖෂධ හෝ siRNAs මගින් NRF1 ප්රෝටීන් මට්ටම් වැඩි වීමට හේතු විය. ?-TrCP සමස්ථානික 2 සහ 2 ට එරෙහිව siRNA සමඟ සමාන ප්රතිඵල සොයා ගන්නා ලදී. GSK-3 ට පසුව NRF1 ස්ථායීකරණය? KEAP2-අඩුපාඩු මූසික කළල තන්තුමය තන්තු වල නිෂේධනය සිදුවී ඇති අතර KEAP1 වෙත ඉහළ සම්බන්ධතාවයක් සඳහා තීරනාත්මක ETGE අපද්රව්ය නොමැති ectopically ප්රකාශිත NRF1 මකාදැමීමේ විකෘතියක් තුළ KEAPXNUMX-ස්වාධීන නියාමනයක් තවදුරටත් පෙන්නුම් කරයි.
ස්නායු විකෘති රෝග සන්දර්භය තුළ, UPS මගින් NRF2 වෙනස් කිරීම වෙනස් ආකාර දෙකකින් අපට සිතාගත හැකිය. එක් අතකින්, KEAP1 පද්ධතිය වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය වීමෙන් ඇති වන රෙඩොක්ස් අසමතුලිතතාවය දැනේවි, GSK-3/?-TrCP අක්ෂය ප්රෝටියෝස්ටේස් නැතිවීමෙන් වෙනස් වූ සංඥා සම්ප්රේෂණයේ සක්රීය සහභාගීකරුවෙකු ලෙස ක්රියා කරයි (රූපය 2).
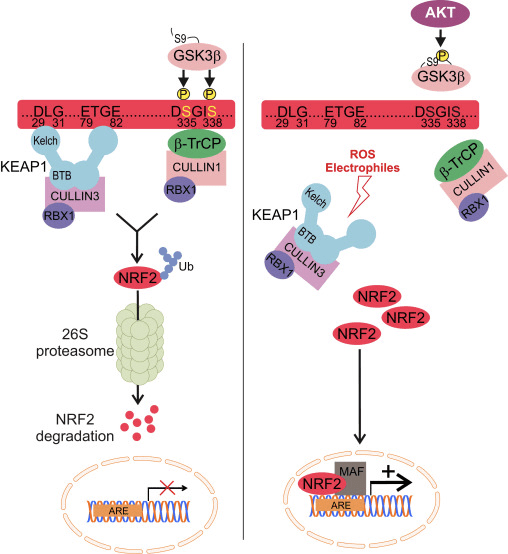 රූපය 2 UPS NRF2 මට්ටම් තදින් පාලනය කරයි. හෝමියස්ථිතික තත්ත්වයන් යටතේ, අඩු NRF2 මට්ටම් පවත්වා ගෙන යනු ලබන්නේ E3 ligases ඇඩැප්ටර KEAP1 සහ ?-TrCP වල ක්රියාකාරිත්වය මගිනි. වම, NRF2 අඩු (DLG) සහ ඉහළ (ETGE) අනුබද්ධිත motifs හරහා KEAP1 homodimer ක Kelch වසම්වලට බැඳේ. එහි BTB වසම හරහා, KEAP1 එකවර CULLIN3/RBX1 සංකීර්ණයකට බන්ධනය කරයි, NRF2 26 S ප්රෝටිසෝමයෙන් සර්වප්රකාරව හා හායනය සක්රීය කරයි. එපමණක්ද නොව, GSK-3? පසුව ubiquitin ligase adapter ?-TrCP මගින් හඳුනාගෙන CULIN335/RBX338 සංකීර්ණයක් මගින් ප්රෝටීසෝම පරිහානිය සඳහා ටැග් කර ඇති degradation domain (DpSGIpSL) නිර්මාණය කිරීම සඳහා NRF2 හි Ser3 සහ Ser1 අවශේෂ phosphorylates කරයි. හරි, KEAP1 හි ප්රතික්රියාශීලී ඔක්සිජන් විශේෂවලට හෝ ඉලෙක්ට්රෝෆයිල්වලට නිරාවරණය වූ විට විවේචනාත්මක Cys අවශේෂ වෙනස් කර, KEAP1 හට NRF2 හෝ CULIN3/RBX1 සමඟ කාර්යක්ෂමව අන්තර්ක්රියා කිරීමට නොහැකි වන අතර එවිට මෙම පිටපත් කිරීමේ සාධකය ARE-ජාන වෙත එහි අර්ධ ආයු කාලය සහ පිටපත් කිරීමේ ක්රියාකාරකම් වැඩි කරයි. GSK-3 නිෂේධනයට හේතු වන සංඥා මාර්ග?, Ser9 හි එවැනි AKT පොස්පරීකරණය, ඉලක්කගත ජානවල ප්රෝටිසෝම, සමුච්චය සහ ප්රේරණය මගින් NRF2 ආබාධිත පිරිහීමට හේතු වේ.
රූපය 2 UPS NRF2 මට්ටම් තදින් පාලනය කරයි. හෝමියස්ථිතික තත්ත්වයන් යටතේ, අඩු NRF2 මට්ටම් පවත්වා ගෙන යනු ලබන්නේ E3 ligases ඇඩැප්ටර KEAP1 සහ ?-TrCP වල ක්රියාකාරිත්වය මගිනි. වම, NRF2 අඩු (DLG) සහ ඉහළ (ETGE) අනුබද්ධිත motifs හරහා KEAP1 homodimer ක Kelch වසම්වලට බැඳේ. එහි BTB වසම හරහා, KEAP1 එකවර CULLIN3/RBX1 සංකීර්ණයකට බන්ධනය කරයි, NRF2 26 S ප්රෝටිසෝමයෙන් සර්වප්රකාරව හා හායනය සක්රීය කරයි. එපමණක්ද නොව, GSK-3? පසුව ubiquitin ligase adapter ?-TrCP මගින් හඳුනාගෙන CULIN335/RBX338 සංකීර්ණයක් මගින් ප්රෝටීසෝම පරිහානිය සඳහා ටැග් කර ඇති degradation domain (DpSGIpSL) නිර්මාණය කිරීම සඳහා NRF2 හි Ser3 සහ Ser1 අවශේෂ phosphorylates කරයි. හරි, KEAP1 හි ප්රතික්රියාශීලී ඔක්සිජන් විශේෂවලට හෝ ඉලෙක්ට්රෝෆයිල්වලට නිරාවරණය වූ විට විවේචනාත්මක Cys අවශේෂ වෙනස් කර, KEAP1 හට NRF2 හෝ CULIN3/RBX1 සමඟ කාර්යක්ෂමව අන්තර්ක්රියා කිරීමට නොහැකි වන අතර එවිට මෙම පිටපත් කිරීමේ සාධකය ARE-ජාන වෙත එහි අර්ධ ආයු කාලය සහ පිටපත් කිරීමේ ක්රියාකාරකම් වැඩි කරයි. GSK-3 නිෂේධනයට හේතු වන සංඥා මාර්ග?, Ser9 හි එවැනි AKT පොස්පරීකරණය, ඉලක්කගත ජානවල ප්රෝටිසෝම, සමුච්චය සහ ප්රේරණය මගින් NRF2 ආබාධිත පිරිහීමට හේතු වේ.
NRF2 ප්රෝටිසෝම අනු ඒකකවල පිටපත් කිරීමේ පාලනය හරහා UPS ක්රියාකාරකම් වැඩි කරයි
NRF2 ප්රෝටිසෝම අනු ඒකක කිහිපයක ප්රකාශනය ඉහළ-නියාමනය කරයි, එමඟින් සෛලය විෂ සහිත ප්රෝටීන සමුච්චය වීමෙන් ආරක්ෂා කරයි. NRF2 ප්රේරක D2T [3] සමඟින් පිහිටුවන ලද අක්මා RNA වෙතින් පුළුල් ක්ෂුද්ර අරා විශ්ලේෂණයකට අනුව, ප්රෝටිසෝම සහ සර්ව ව්යාප්තිය සම්බන්ධ ජාන 84ක් NRF26 මගින් නියාමනය කරනු ලබන බව පෙනේ. පශ්චාත් අධ්යයනයක දී, 3S ප්රෝටිසෝමයේ බොහෝ උප ඒකකවල ප්රකාශනය D2T සමඟ ප්රතිකාර කළ මීයන්ගෙන් අක්මාව තුළ තුන් ගුණයකින් වැඩි වී ඇති බව එම කතුවරුන්ම සාක්ෂි දුන්හ. උප ඒකක ප්රෝටීන් මට්ටම් සහ ප්රෝටිසෝම ක්රියාකාරිත්වය සම්බන්ධීකරණයෙන් වැඩි විය. කෙසේ වෙතත්, NRF5 පිටපත් කිරීමේ සාධකය කඩාකප්පල් වූ මීයන් තුළ කිසිදු ප්රේරණයක් දක්නට නොලැබුණි. PSMB20 (2S) ප්රෝටිසෝම අනු ඒකකයේ ප්රවර්ධක ක්රියාකාරකම් NRF5 අධි ප්රකාශනය හෝ මූසික කළල තන්තුමය සක්රියකාරක සමඟ ප්රතිකාර කිරීම සමඟ වැඩි විය, සහ PSMB85 [2] හි සමීප ප්රවර්ධකයා තුළ ARE හඳුනා ගන්නා ලදී. NRF3 හි ඖෂධීය සක්රීය කිරීම මගින් නියෝජිත ප්රෝටිසෝම අනු ඒකකවල (PSMA6, PSMA1, PSMB5 සහ PSMB2) ප්රකාශන මට්ටම් ඉහළ ගියේ ක්රියාකාරී NRF86 අඩංගු නොවන වැඩිහිටි මානව තන්තුමය තන්තු වල පමණි. ඔක්සිකාරක ආතතියට අනුවර්තනය වීමේදී NRF2 සක්රීය කිරීම PSMB1 (20S) සහ PA28 හි ඉහළ ප්රකාශනයක් ඇති කරයි? උප ඒකක (හෝ S11, ප්රෝටිසෝම නියාමකය) [87]. එපමනක් නොව, මානව කළල ප්රාථමික සෛලවල ප්රතිඵලවලින් හෙළි වූයේ NRF2 විසින් ප්රෝටීසෝම පරිණත ප්රෝටීනයේ (POMP) ප්රකාශනය පාලනය කරන බවයි, එය ප්රෝටීසෝම චැපෙරෝනයක් වන අතර එමඟින් ස්වයං-අලුත් කරන මානව කළල ප්රාථමික සෛල ප්රගුණනය, විෂබීජ ස්ථර තුනක වෙනස සහ සෛලීය ප්රතිනිර්මාණය කිරීම […] 88]. සියල්ල එක්ව, මෙම අධ්යයනවලින් පෙන්නුම් කරන්නේ NRF2 UPS හි ප්රධාන කොටස්වල ප්රකාශනය ඉහළ-නියාමනය කරන අතර එම නිසා විෂ සහිත ප්රෝටීන නිෂ්කාශනය කිරීමට සක්රියව දායක වන බවයි.
ස්නායු විකෘති රෝග වල NRF2-UPS අක්ෂය
ස්නායු විකෘතිතා රෝග සඳහා UPS හි භූමිකාව දැඩි විවාදයේ ක්ෂේත්රයකි. මූලික අධ්යයනයන් මගින් ස්නායු විකෘති රෝග කිහිපයකින් පීඩාවට පත් වූ රෝගීන්ගේ මානව මළ සිරුරු වල ප්රෝටිසෝම ක්රියාකාරිත්වය අඩු වී ඇති බව වාර්තා විය. කෙසේ වෙතත්, vitro සහ in vivo ප්රවේශයන් භාවිතා කරන අනෙකුත් අධ්යයනයන් නොවෙනස්ව හෝ වැඩි වූ ප්රෝටීසෝම ක්රියාකාරකම් සොයා ගන්නා ලදී ([89] හි සමාලෝචනය කරන ලදී). මෙම විෂමතාවය සඳහා විය හැකි එක් පැහැදිලි කිරීමක් නම්, NRF2-ඉලක්ක සඳහා යෝජනා කර ඇති පරිදි රෝගයේ ප්රගතිය සහ විවිධ මොළයේ කලාපවල UPS සංරචකවල මට්ටම් වෙනස් විය හැකි බවයි.
මෙම මතභේදය නොතකා, ARE අඩංගු ප්රෝටිසෝම ජාන නියාමනය කිරීමෙන් මොළයේ විෂ සහිත ප්රෝටීන නිෂ්කාශනය වැඩි කිරීමෙන් UPS ශක්තිමත් වන බව සඳහන් කළ යුතුය. ඇත්ත වශයෙන්ම, නියුරෝන සෛලවල ප්රතිඔක්සිකාරක ප්රතිචාරයේ මොඩියුලේටරය වන NRF1 අහෝසි කිරීම ප්රෝටිසෝම ක්රියාකාරිත්වය අඩාල වීමට සහ ස්නායු පරිහානියට හේතු වේ. ක්රොමැටින් ප්රතිශක්තිකරණ පරීක්ෂණ සහ පිටපත් කිරීමේ විශ්ලේෂණය මගින් PSMB6 නියාමනය කරනු ලබන්නේ NRF1 මගින් බව පෙන්නුම් කරයි. මීට අමතරව, ජාන ප්රකාශන පැතිකඩ මගින් NRF1 නියුරෝන වල ප්රෝටීසෝම ජානවල ප්රධාන පිටපත් කිරීමේ නියාමකයෙකු ලෙස හඳුනා ගැනීමට හේතු විය, NRF1 හි කැළඹීම් ස්නායු විකෘති රෝග වල ව්යාධිජනකයට දායක විය හැකි බව යෝජනා කරයි [90]. සිත්ගන්නා කරුණ නම්, NRF1 සහ එහි දිගු සමස්ථානික TCF11 අඩු වූ ප්රෝටෝලිටික් ක්රියාකාරකම් සඳහා වන්දි ගෙවීම සඳහා ප්රතිපෝෂණ පුඩුවක ප්රෝටීසෝම නිෂේධනය මත ARE අඩංගු ප්රෝටීසෝම ජාන ඉහළ-නියාමනය කරන බව පෙන්වා දී ඇත [91], [92].
NRF2 සම්බන්ධයෙන්, neurotoxin paraquat සමඟ ප්රතිකාර කරන ලද DJ-2 ඌනතාවයෙන් යුත් මීයන්ගේ මැද මොළයේ NRF6, RPT19 (5 S) සහ PSMB20 (1 S) මට්ටම් අඩු කිරීම අතර සහසම්බන්ධයක් ඇත [93]. එපමනක් නොව, ස්වභාවිකව සිදු වන සංයෝගය සල්ෆෝරාපේන් (SFN) UPS හි තීරණාත්මක මොඩියුලේටරයක් ලෙස NRF2 හි වඩාත් ශක්තිමත් රූපයක් ලබා දෙයි. Murine neuroblastoma Neuro2A සෛල සමඟ සිදු කරන ලද පරීක්ෂණවලදී ප්රෝටිසෝමයේ උත්ප්රේරක අනු ඒකකවල වැඩි දියුණු ප්රකාශනයක් මෙන්ම SFN වලට ප්රතිචාර වශයෙන් එහි පෙප්ටයිඩේස් ක්රියාකාරකම්ද පෙන්නුම් කළේය. මෙම ඖෂධය හයිඩ්රජන් පෙරොක්සයිඩ් මධ්යගත සයිටොටොක්සිසිටි සහ ප්රෝටීන ඔක්සිකරණයෙන් සෛල ආරක්ෂා කළේ ප්රෝටීසෝම ක්රියාකාරිත්වය මත රඳා පවතින ආකාරයටය [94]. ඊට අමතරව, Liu සහ සම-සේවකයින් මොළයේ SFN වලට ප්රතිචාර වශයෙන් UPS ක්රියාකාරකම් නිරීක්ෂණය කිරීමට වාර්තාකරු මූසිකයක් යොදවා ඇත. මෙම මීයන් UPS (GFPu) මගින් එහි ශීඝ්ර පරිහානිය ප්රවර්ධනය කරන සංඝටක පිරිහීමේ සංඥාවකට විලයනය කරන ලද හරිත ප්රතිදීප්ත ප්රෝටීනය (GFP) සර්වසම්පූර්ණව ප්රකාශ කරයි. මස්තිෂ්ක බාහිකයේ දී, SFN 5 S ප්රෝටීසෝමයේ චයිමොට්රිප්සින් වැනි (PSMB2), කැස්පේස් වැනි (PSMB1) සහ ට්රයිප්සින් වැනි (PSMB20) ක්රියාකාරකම්වල සමාන්තර වැඩි වීමක් සමඟින් GFPu මට්ටම අඩු කළේය. මීට අමතරව, හන්ටිංටන්-ව්යුත්පන්න සෛල SFN සමඟ ප්රතිකාර කිරීමෙන් හෙළි වූයේ NRF2 සක්රිය කිරීම mHtt ක්ෂය වීම වැඩිදියුණු කළ අතර mHtt සයිටොටොක්සිසිටි [95] අඩු කරන බවයි. SFN ක්රියාවෙහි ප්රධාන යාන්ත්රණය වන්නේ NRF2 [96] ප්රේරණය කිරීම මගිනි. NRF2 හි නිශ්චිත දායකත්වය වැඩිදුර අධ්යයනයන්හි NRF2-ශුන්ය පද්ධති භාවිතා කරමින් ආමන්ත්රණය කළ යුතුය.
NRF2 සහ Macroautophagy අතර ක්රියාකාරී සම්බන්ධතාවය
NRF2 ප්රෝටීන් මට්ටම් ඇඩැප්ටර ප්රෝටීන් P62 මගින් මොඩියුලේට් කර ඇත
Autophagy යන්නෙන් අදහස් කරන්නේ ලයිසොසෝම තුළ ඇති සයිටොසොලික් සංඝටක පිරිහීමයි. මෙම ක්රියාවලිය දිගුකාලීන හා වැරදි ලෙස නැමුණු ප්රෝටීන මෙන්ම හානියට පත් ඉන්ද්රියයන් ඉවත් කිරීම සඳහා යොදා ගනී. NRF2 සහ autophagy අතර සෘජු සම්බන්ධයක් මුලින්ම නිරීක්ෂණය කරන ලද්දේ ඇඩැප්ටර ප්රෝටීන් p62 සම්බන්ධයෙනි, එය SQSTM1 [97], [98], [99], [100], [101] ලෙසද හැඳින්වේ. මෙම ප්රෝටීනය සර්වසම්පූර්ණ ප්රෝටීන ප්රෝටීසෝම සහ ලයිසොසෝම විඛණ්ඩන යන්ත්ර සූත්ර වෙත ගෙන යන අතර හානි වූ ප්රෝටීන ඒවායේ හායනය වීමට පෙර සමස්ථයන් බවට පත් කරයි. P62 විසින් ubiquitin-associated (UBA) වසමක්, සර්වසම්පූර්ණ ප්රෝටීන සමඟ බන්ධනය කිරීම සඳහා සහ LC3-අන්තර්ක්රියාකාරී කලාපයක් (LIR) ස්වයංක්රීය ප්රතිග්රාහක LC3 හරහා ස්වයංක්රීය පටලය සමඟ ඒකාබද්ධ කිරීම සඳහා ඉදිරිපත් කරයි.
NRF62 සහ එහි ඉලක්කගත ජානවල p2-මැදිහත් වූ ප්රේරණය 2007 [102] දී ප්රථම වරට වාර්තා වුවද, KEAP1 [103], [98], [99], [100 සමඟ එහි අන්තර්ක්රියා සොයා ගන්නා තෙක් අණුක යාන්ත්රණය සම්පූර්ණයෙන් වටහාගෙන නොතිබුණි. ], [101]. Komatsu සහ සහායකයින් P1 හි KEAP62 අන්තර්ක්රියා කලාපයක් (KIR) හඳුනා ගත් අතර එය NRF1 හා සමාන මූලික මතුපිට සාක්කුවේ KEAP2 බැඳ ඇති අතර NRF2 හි ETGE මෝස්තරයට සමාන බන්ධන සම්බන්ධතාවයකින් p62 සහ NRF2 අතර තරඟයක් යෝජනා කරයි. P351 (62-DPSTGE-349) හි KIR මෝටිෆ්හි Ser354 හි පොස්පරීකරණය KEAP1 සඳහා එහි බැඳීම වැඩි කරන බව පෙන්නුම් කරන ලදී, NRF2 බන්ධනය සමඟ තරඟ වදින අතර එහි ඉලක්කගත ජානවල සමුච්චය සහ පිටපත් කිරීමේ ක්රියාකාරීත්වයට ඉඩ සලසයි [98], [99]. ඇත්ත වශයෙන්ම, p62 අධි ප්රකාශනය NRF2 සර්වප්රකාරනය අඩු කිරීමට සහ එහි ප්රතිඵලයක් ලෙස ස්ථායීකරණයට මෙන්ම එහි ඉලක්කගත ජාන ප්රේරණය කිරීමට හේතු විය [104]. සමහර කයිනේස් p62 ෆොස්ෆොරයිලීකරණයට සහභාගී වීමට යෝජනා කර ඇත. mTOR inhibitor rapamycin සමඟ ප්රතිකාර කිරීමෙන් p1 හි පොස්පරීකරණය සහ ආසනයිට් ප්රතිකාරය මත KEAP1 හි පහළ-නියාමනය මැඩපවත්වන බැවින්, rapamycin සංකීර්ණ 62 (mTORC1) හි ක්ෂීරපායී ඉලක්කය සම්බන්ධ විය හැක. මෑතදී, TGF-?-සක්රිය kinase 1 (TAK1) හට P62 ෆොස්ෆොරයිලේට් කළ හැකි බව පෙන්නුම් කරන ලදී, KEAP1 හායනය සහ NRF2-අප්-නියාමනය වැඩි දියුණු කරයි. මෙම අධ්යයනයේ කතුවරුන් යෝජනා කරන්නේ මෙය ස්ථාවර තත්ත්වයන් යටතේ සෛලීය රෙඩොක්ස්ටාසිස් නියාමනය කිරීමේ ක්රමයක් වන අතර, TAK1-අඩුපාඩුව NRF2 ප්රෝටීන් මට්ටම් අඩු කිරීමට සමගාමීව විවිධ මූසික පටකවල බාහිර ඔක්සිකාරකයක් නොමැති විට ROS ඉහළ-නියාමනය කරයි [105] ].
UBA වසම නොමැති p62 නිර්මිතයක් තවමත් KEAP1 බන්ධනය කිරීමට සමත් විය, එයින් ගම්ය වන්නේ අන්තර් ක්රියා සර්ව ව්යාප්ත වූ KEAP1 [101] මත රඳා නොපවතින බවයි. කෙසේ වෙතත්, Drosophila melanogaster හි ඇති p62 homologue, Ref(2) නම්, KIR මෝස්තරයක් අඩංගු නොවන අතර DmKEAP1 සමඟ සෘජුව අන්තර් ක්රියා නොකරයි, නමුත් එය UBA වසම හරහා සෑම තැනකම පැතිරී ඇති DmKEAP1 සමඟ බැඳිය හැක. එපමනක් නොව, DmKEAP1 හට Atg8 (සමලිංගික සිට ක්ෂීරපායී LC3) සමඟ සෘජුවම අන්තර් ක්රියා කළ හැක. KEAP1 ඌනතාවය හේතුවෙන් Atg8 සහ ස්වයංක්රීය ප්රේරණය NRF2 orthologue CncC මත රඳා පවතින අතර TFEB/MITF [106] මත රඳා පවතී. NRF2 සහ autophagy අතර සම්බන්ධය එහි ක්රියාකාරී අදාළත්වය ඉස්මතු කරමින් කෙසේ වෙතත් සංරක්ෂණය කර ඇති බව පෙනේ.
P2 මගින් NRF62 ප්රේරණය වීම KEAP1 බැඳීමට ඇති තරඟයේ සහ ලයිසොසෝමයේ KEAP1 ක්ෂය වීම යන දෙකෙහිම ප්රතිඵලයකි. siRNA සමඟ p62 නිශ්ශබ්ද කිරීම NRF1 සහ එහි ඉලක්කගත ජානවල අඩුවීමක් සමඟ සමාන්තරව KEAP2 අර්ධ ආයු කාලය දෙගුණ කරයි [101]. එකඟතාවයකට අනුව, p62 ප්රකාශනය ඉවත් කිරීම වල් වර්ගයේ මීයන් හා සසඳන විට KEAP1 මට්ටම් වැඩි වී ඇති බව පෙන්නුම් කරයි. ඉතා අදාළ, KEAP1 මට්ටම්වල වැඩිවීම ප්රෝටිසෝම නිෂේධක මගින් බල නොපා ඇති නමුත් කුසගින්න ඇති කරන ස්වයංක්රීයකරණය යටතේ අඩු කරන ලදී [107]. ඇත්ත වශයෙන්ම, KEAP1 p62 සහ LC3 [99], [100], [103] වලින් සරසා ඇති ස්වයංක්රීය වෙසිලිවල ක්ෂීරපායී සෛල තුළ පවතී. මෙම සියලු දත්ත යෝජනා කරන්නේ KEAP1 යනු macroautophagy යන්ත්රෝපකරණවල උපස්ථරයක් බවයි, නමුත් සමහර මතභේදාත්මක ප්රතිඵල පැවතීම නිසා මෙම ගැටළුව වඩාත් විස්තරාත්මකව විශ්ලේෂණය කළ යුතුය. මැක්රෝඕටෝෆාගි [1] හි ප්රධාන ප්රතිඵලයක් වන Atg7-null මීයන් තුළ KEAP107 ප්රෝටීන් මට්ටම් වැඩි කරන ලදී, නමුත් torin1, E64/pepstatin හෝ bafilomycin සමඟ macroautophagy හි ඖෂධීය නිෂේධනය KEAP1 [107], [100] සමුච්චය කිරීමට අසමත් විය. සමස්තයක් වශයෙන්, මෙම ප්රතිඵල යෝජනා කරන්නේ වැඩි වූ p62 මට්ටම් KEAP1 ස්වයංක්රීය රික්තක බවට අනුයුක්ත කරන බවත් බොහෝ විට මෙම ප්රතිඵලය NRF1 සක්රිය කිරීමට ඉඩ සලසන KEAP2 ස්වයංක්රීය පරිහානියට හේතු වන බවත්ය (රූපය 3). විවිධ අධ්යයන දෙකක් වාර්තා කළේ සල්ෆිනික් අම්ලය අඩු කරන SESTRINS මෙම සන්දර්භය තුළ වැදගත් කාර්යභාරයක් ඉටු කරන බවයි. SESTRIN 2 p62, KEAP1 සහ RBX1 සමඟ අන්තර්ක්රියා කරන අතර ඉලක්කගත ජානවල KEAP62 සහ NRF1 සක්රිය කිරීමේ p2 මත යැපෙන පරිහානියට පහසුකම් සපයයි [108]. තවත් අධ්යයනයකින් පෙන්නුම් කළේ SESTRIN 2 ULK1 සහ p62 සමඟ අන්තර්ක්රියා කළ අතර, Ser62 හි p403 පොස්පරීකරණය ප්රවර්ධනය කරන අතර එමඟින් KEAP1 ඇතුළුව භාණ්ඩ ප්රෝටීන පිරිහීමට පහසුකම් සපයයි.
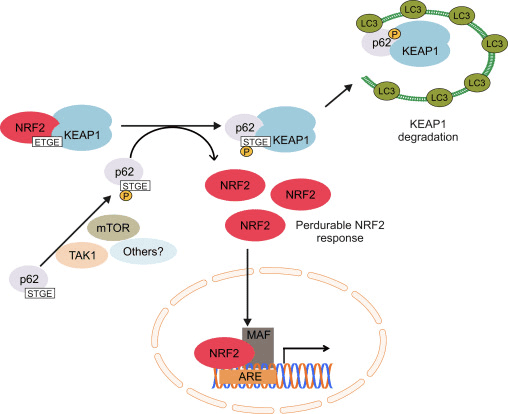 රූපය 3 NRF2 මට්ටම් නියාමනය කරනු ලබන්නේ ඇඩැප්ටර ප්රෝටීන් p62 මගිනි. mTORC351, TAK62 හෝ වෙනත් kinases මගින් p349 (354-DPSTGE-1) හි KIR motif හි Ser 1 හි පොස්පරීකරණය NRF1 හි ETGE මෝස්තරයට සමාන වීම හේතුවෙන් KEAP2 වෙත බැඳීම සඳහා වැඩි බැඳීමක් ඇති කරයි. එහි ප්රතිඵලයක් ලෙස, ෆොස්ෆොරයිලේටඩ් p62 NRF2 විස්ථාපනය කර KEAP1 බන්ධනය කරයි. p62 හි LIR මෝස්තරය ස්වයංක්රීය පටලයේ LC3 සමඟ අන්තර්ක්රියා සක්රීය කරයි, එවිට p62-KEAP1 සංකීර්ණය අවසානයේ ලයිසෝමයේ දිරාපත් වේ. එහි ප්රතිඵලයක් ලෙස NRF2 හට න්යෂ්ටිය වෙත සංක්රමණය වීමටත්, p62 ඇතුළු ARE අඩංගු ජානවල පිටපත් කිරීම වැඩි කිරීමටත් හැකි වේ. NRF2 ක්රියාකාරකම් වලක්වාලීම සඳහා KEAP1 අලුතින් සංස්ලේෂණය කළ යුතු බැවින්, මෙම නියාමන යාන්ත්රණය කල් පවතින NRF2 ප්රතිචාරයක් සපයයි.
රූපය 3 NRF2 මට්ටම් නියාමනය කරනු ලබන්නේ ඇඩැප්ටර ප්රෝටීන් p62 මගිනි. mTORC351, TAK62 හෝ වෙනත් kinases මගින් p349 (354-DPSTGE-1) හි KIR motif හි Ser 1 හි පොස්පරීකරණය NRF1 හි ETGE මෝස්තරයට සමාන වීම හේතුවෙන් KEAP2 වෙත බැඳීම සඳහා වැඩි බැඳීමක් ඇති කරයි. එහි ප්රතිඵලයක් ලෙස, ෆොස්ෆොරයිලේටඩ් p62 NRF2 විස්ථාපනය කර KEAP1 බන්ධනය කරයි. p62 හි LIR මෝස්තරය ස්වයංක්රීය පටලයේ LC3 සමඟ අන්තර්ක්රියා සක්රීය කරයි, එවිට p62-KEAP1 සංකීර්ණය අවසානයේ ලයිසෝමයේ දිරාපත් වේ. එහි ප්රතිඵලයක් ලෙස NRF2 හට න්යෂ්ටිය වෙත සංක්රමණය වීමටත්, p62 ඇතුළු ARE අඩංගු ජානවල පිටපත් කිරීම වැඩි කිරීමටත් හැකි වේ. NRF2 ක්රියාකාරකම් වලක්වාලීම සඳහා KEAP1 අලුතින් සංස්ලේෂණය කළ යුතු බැවින්, මෙම නියාමන යාන්ත්රණය කල් පවතින NRF2 ප්රතිචාරයක් සපයයි.
NRF2 මගින් Macroautophagy ජාන මොඩියුලේෂන්
NRF2 macroautophagy සඳහා අදාළ ජාන ප්රකාශනය මෙන්ම UPR සහ UPS සඳහාද නියාමනය කරයි. විද්යුත් තන්තු, ROS සහ නයිට්රික් ඔක්සයිඩ් [62], [110], [111] වලට නිරාවරණය වීමේදී p112 ප්රකාශනය ප්රේරණය වන බව පෙන්නුම් කළ අධ්යයනවලින් පළමු සාක්ෂිය ලැබුණි. ප්රේරණයේ යාන්ත්රණය වසර කිහිපයකට පසුව විස්තර කරන ලද්දේ p62 එහි ජාන ප්රවර්ධකයෙහි ක්රියාකාරී ARE අඩංගු බව සොයා ගැනීමත් සමඟය [99]. මෑත කාලීන අධ්යයනයක දී, ජෛව තොරතුරු විශ්ලේෂණය සහ චිප් විශ්ලේෂණයෙන් පසුව තවත් ක්රියාකාරී ARE කිහිපයක් සොයාගෙන වලංගු කරන ලදී. එපමනක් නොව, Nrf2-knockout මීයන්ගේ මූසික කළල තන්තුමය තන්තු සහ cortical නියුරෝන අඩු p62 ප්රකාශනය ප්රදර්ශනය කරන ලද අතර එය NRF2-ප්රකාශිත lentivirus සමඟ ගලවා ගත හැකිය. ඒ හා සමානව, NRF2 ඌනතාවය මීයන් හිපොකැම්පස් වලින් තුවාල වූ නියුරෝන වල p62 මට්ටම අඩු කළේය [36]. එබැවින්, NRF2 සක්රීය කිරීම p62 මට්ටම් වැඩි කරන බව යෝජනා කර ඇති අතර, එහි ප්රතිඵලයක් ලෙස KEAP1 පිරිහීමට සහ ධනාත්මක ප්රතිපෝෂණ පුඩුවක් තුළ තවදුරටත් NRF2 ස්ථායීකරණයට අනුග්රහය දක්වයි. NRF2 ප්රේරණයේ මෙම කැනොනිකල් නොවන යාන්ත්රණයට ජාන ප්රකාශනයේ වෙනස්කම් අවශ්ය වන අතර දිගුකාලීන සෛලීය ආතතියට අදාළ ප්රතිචාරයක් විය හැකිය.
භාණ්ඩ හඳුනාගැනීමේ ප්රෝටීන් NDP52 NRF2 මගින් පිටපත් කිරීමේ නියාමනය කරන ලදී. NDP52 p62 හා සමාන ආකාරයකින් ක්රියා කරයි, සර්වසම්පූර්ණ ප්රෝටීන හඳුනාගෙන LIR වසමක් හරහා LC3 සමඟ අන්තර්ක්රියා කරයි, එවිට භාණ්ඩ ලයිසෝසෝමවල දිරාපත් වේ. Ndp52 ප්රවර්ධක ඩීඑන්ඒ අනුක්රමය තුළ ප්රේරක AREs පහක් සොයා ගන්නා ලදී. ඒවායින් තුනක් NRF2-මැදිහත් වූ Ndp52 පිටපත් කිරීම සඳහා අත්යවශ්ය ලෙස වෙනස් වූ විකෘති නිර්මිතයන් සහ ChIP පරීක්ෂණ සමඟ හඳුනාගෙන ඇත [113]. සැලකිල්ලට ගත යුතු කරුණක් නම්, Nrf52-knockout මීයන්ගේ hippocampus හි Ndp2 mRNA මට්ටම් අඩු විය. මෙම අනුපිළිවෙලින් එකක් ස්වාධීන අධ්යයනයක දී NRF2-නියාමනය කරන ලද ARE [36] ලෙසද වලංගු විය.
කෙසේ වෙතත්, ස්වයංක්රීයකරණයේ මොඩියුලේෂන් හි NRF2 හි කාර්යභාරය මෙම භාණ්ඩ හඳුනාගැනීමේ ප්රෝටීන දෙකේ ප්රේරණයට සීමා නොවේ. අතිරේක ස්වයංක්රීය ආශ්රිත ජාන වෙනස් කිරීමේදී NRF2 හි භූමිකාව පිළිබඳ ගැඹුරු අවබෝධයක් ලබා ගැනීම සඳහා, අපගේ කණ්ඩායම NRF1-නියාමනය කරන ලද AREs බන්ධනය කරන MAFK සහ BACH2 යන ප්රෝටීන දෙකක් සඳහා ක්රොමැටින් ප්රතිශක්තිකරණ දත්ත සමුදාය ENCODE පරීක්ෂා කරන ලදී. JASPAR හි සම්මුති ARE අනුපිළිවෙලින් උත්පාදනය කරන ලද ස්ක්රිප්ට් එකක් භාවිතා කරමින්, අපි බොහෝ ස්වයංක්රීය ජානවල ඇති ARE කිහිපයක් හඳුනා ගත්තෙමු. මෙම අනුපිළිවෙලවල් දොළහක් ස්වයංක්රීය ජාන නවයක NRF2 නියාමනය කරන ලද ARE ලෙස වලංගු කරන ලද අතර, Nrf2-knockout මීයන්ගේ මූසික කළල තන්තුමය තන්තු වල ප්රකාශනය අඩු වූ නමුත් NRF2-ප්රකාශිත lentivirus මගින් ප්රතිසාධනය කළ හැකිය. අපගේ අධ්යයනයෙන් පෙන්නුම් කළේ ස්වයංක්රීය ආරම්භය (ULK2), භාණ්ඩ හඳුනාගැනීම (p1 සහ NDP62), ස්වයංක්රීයව සෑදීම (ATG52D, ATG4 සහ GABARAPL7), දිගු කිරීම (ATG1B සහ දිගු කිරීම) ඇතුළුව ස්වයංක්රීය ක්රියාවලියේ විවිධ පියවරයන්ට සම්බන්ධ සමහර ජානවල ප්රකාශනය NRF2 සක්රීය කරන බවයි. ), සහ autolysosome නිෂ්කාශනය (ATG5D). එහි ප්රතිඵලයක් ලෙස, NRF4 නොමැති විට හයිඩ්රජන් පෙරොක්සයිඩ් වලට ප්රතිචාර වශයෙන් ස්වයංක්රීය ප්රවාහය දුර්වල විය [2].
ස්නායු විකෘතිතා ආබාධවලදී NRF2-මැදිහත් වූ මැක්රෝඕටෝෆාජි ජාන ප්රකාශනයේ අදාළත්වය
දෝෂ සහිත ස්වයංක්රීයකරණය ස්නායු විකෘති රෝග කිහිපයක වැදගත් කාර්යභාරයක් ඉටු කරන බව පෙන්වා දී ඇත [114] සහ ස්වයංක්රීයකරණය ඉවත් කිරීම මීයන් තුළ ස්නායු විකෘතියට තුඩු දෙයි [115], [116]. Atg7-knockout මීයන් හෙළි කළේ ස්වයංක්රීය ඌනතාවයේ ප්රතිඵලයක් ලෙස ubiquitin-positive inclusion body වල p62 සමුච්චය වන බවයි. KEAP1 මෙම ඇතුළත් කිරීමේ සිරුරු තුළ වෙන් කර ඇති අතර, NRF2 ස්ථායීකරණයට සහ ඉලක්කගත ජාන ප්රේරණය කිරීමට මග පාදයි [103]. වැදගත් වන්නේ, AD, PD සහ ALS [62] ඇතුළු ස්නායු විකෘතිතා රෝග වලදී p117 සහ සර්ව ව්යාප්ත ප්රෝටීන සමඟ අධික ලෙස සමුච්චය වීම හඳුනාගෙන ඇත. ඇත්ත වශයෙන්ම, AD රෝගීන්ගේ ඉහළ මට්ටමේ APP හෝ TAU ප්රකාශ කරන නියුරෝන p62 සහ න්යෂ්ටික NRF2 ප්රකාශ කරන අතර, ස්වයංක්රීයකරණය හරහා අභ්යන්තර නියුරෝන සමස්ථයන් පිරිහීමට ඔවුන්ගේ උත්සාහය යෝජනා කරයි [36].
NRF2 ඌනතාවය AD හි සන්දර්භය තුළ ප්රෝටීන් සමුච්චය වීම උග්ර කරයි. ඇත්ත වශයෙන්ම, Nrf2-knockout මීයන් තුළ ෆොස්ෆොරයිලේටඩ් සහ සාර්කොසිල්-ද්රාව්ය නොවන TAU මට්ටම් වැඩි වී ඇත, නමුත් වල්-වර්ගයේ පසුබිම සමඟ සසඳන විට කයිනේස් හෝ පොස්පේටේස් ක්රියාකාරකම්වල වෙනසක් අනාවරණය කර ගත නොහැකි විය [113]. වැදගත් කරුණක් නම්, NDP52 මූරීන් නියුරෝනවල TAU සමඟ සම-දේශීයකරණය වන බව පෙන්නුම් කරන අතර ෆොස්ෆෝ-TAU සහ NDP52 අතර සෘජු අන්තර්ක්රියා මීයන් සහ AD සාම්පලවල සම-ප්රතිශක්තිකරණ පරීක්ෂණ මගින් පෙන්නුම් කරන ලද අතර, TAU පිරිහීමෙහි එහි භූමිකාව පෙන්වා දෙයි. සිත්ගන්නා කරුණ නම්, නියුරෝන වල NDP52, p62 හෝ NRF2 නිශ්ශබ්ද කිරීම ෆොස්ෆෝ-TAU [113], [118] වැඩි කිරීමට හේතු විය. එපමනක් නොව, NRF1 නොමැති විට APP/PS9?E2 මීයන්ගේ හිපොකැම්පස් වල අභ්යන්තර නියුරෝන APP සමස්ථයන් වැඩි විය. මෙය වැඩිවන ෆොස්ෆෝ-mTOR/mTOR සහ ෆොස්ෆෝ-p70S6k/p70S6k අනුපාත (ස්වයංක්රීය නිෂේධනය පිළිබඳ ඇඟවීම), පූර්ව කැටෙප්සින් ඩී මට්ටම් සහ බහුවිද්යාත්මක ශරීර විශාල ප්රමාණයක් ඇතුළුව වෙනස් කරන ලද ස්වයංක්රීය සලකුණු සමඟ සහසම්බන්ධ වේ [119]. මීයන් සම-ප්රකාශනය කරන මානව APP (V717I) සහ TAU (P301L), NRF2 ඌනතාවය නිසා ද්රාව්ය නොවන කොටසෙහි සම්පූර්ණ මට්ටම් සහ ෆොස්ෆෝ-TAU මට්ටම් වැඩි වීම සහ අභ්යන්තර නියුරෝන APP සමස්ථයන් වැඩි වීමත් සමඟ p62, NDP52 හි නියුරෝන මට්ටම් අඩු විය. ATG1 සහ GABARAPL5. ඇඩැප්ටර ප්රෝටීන් p1 සහ APP හෝ TAU අතර සම-ප්රාදේශීයකරණය NRF62 [2] නොමැති විට අඩු විය. සමස්තයක් වශයෙන්, මෙම ප්රතිඵල මගින් නියුරෝන ස්වයංක්රීයකරණයේදී NRF36 හි වැදගත්කම ඉස්මතු කරයි.
ප්රෝටෝස්ටැසිස් මොඩියුලේට් කිරීමට විවිධ පිටපත් කිරීමේ සාධක සම්බන්ධීකරණයෙන් ක්රියා කරයි
ස්ථාවර තත්ත්වයන් යටතේ, ප්රෝටියෝස්ටැසිස් පාලනය කරනු ලබන්නේ ප්රෝටීන්-ප්රෝටීන් අන්තර්ක්රියා සහ පශ්චාත් පරිවර්තන වෙනස් කිරීම් හරහා වේගවත් ප්රතිචාරයක් ලබා ගැනීමෙනි. කෙසේ වෙතත්, සෛල අනුවර්තනය සඳහා UPR, UPS සහ ස්වයංක්රීය ජානවල පිටපත් කිරීමේ නියාමනය අවශ්ය වේ. ස්නායු සෛල ඔක්සිකාරක සහ ප්රෝටෝටොක්සික් ආතතිය ඇතුළුව අඩු ශ්රේණියේ විෂ සහිත අපහාසවලට අඛණ්ඩව ඉදිරිපත් වන බව සලකන විට, පිටපත් කිරීමේ මොඩියුලේෂන් මගින් ප්රේරණය කරන ලද ප්රෝටෝස්ටැසිස් ශක්තිමත් කිරීම මොළයේ පරිහානිය වැළැක්වීමට උපකාරී වේ.
UPR සම්බන්ධයෙන් ගත් කල, එක් එක් අත් තුනෙහි සක්රිය වීම අවසානයේ ඇතැම් ජානවල පිටපත් කිරීමේ ප්රේරණයට හේතු වේ (සමාලෝචනය කරන ලද්දේ [43]). නිදසුනක් ලෙස, ATF6-ව්යුත්පන්න ඛණ්ඩයක් (ATF6f) ER-ආතති ප්රතිචාර මූලද්රව්ය (ERSE) වෙත බන්ධනය වන අතර XBPI, BIP සහ CHOP ඇතුළු ජාන කිහිපයක ප්රකාශනය ප්රේරණය කරයි. මීට අමතරව, PERK සංඥා කිරීම මගින් පිටපත් කිරීමේ සාධකය ATF4 සක්රීය කරයි, එය බහු UPR ආශ්රිත ජානවල ප්රකාශනය සහ NRF2 ඉලක්කගත ජාන Hmox1 සහ p62 ඇතුළු තවත් සමහරක් පාලනය කරයි. අවසාන වශයෙන්, IRE1 සක්රිය කිරීමේ ප්රතිඵලය වන්නේ ප්රෝටීන් නැමීමට සම්බන්ධ ජාන කේතීකරණ ප්රෝටීනවල පිටපත් කිරීම පාලනය කරන ක්රියාකාරී පිටපත් කිරීමේ සාධකයක් වන spliced XBP1 (XBP1s) ජනනය කිරීමයි.
අනෙක් අතට, NRF1 මොළයේ ප්රෝටිසෝම ජාන ප්රකාශනය සඳහා අවශ්ය බව පෙන්නුම් කරන ලදී, Nrf1-knockout මීයන් විසින් 20S හරයේ විවිධ උප ඒකක කේතනය කරන ජානවල ප්රකාශනය අඩු වීම මෙන්ම 19S නියාමන සංකීර්ණය දුර්වල ප්රෝටීසෝම ක්රියාකාරිත්වය සමඟ [90] ]. NRF1 සහ NRF2 යන දෙකම එහි ඉලක්කගත ජානවල ප්රවර්ධක කලාපවල ARE අනුපිළිවෙලට බන්ධනය වන අතර, එයින් ඇඟවෙන්නේ ඒවායේ නියාමන යාන්ත්රණ සහ සෛලීය ප්රාදේශීයකරණය [120] වෙනස් වුවද ඒවා අතිච්ඡාදනය වන පිටපත් කිරීමේ ක්රියාකාරකම් ඇති බවයි.
Forkhead box O (FOXO) පවුලේ පිටපත් කිරීමේ සාධක බහු ස්වයංක්රීය සම්බන්ධ ජානවල ප්රකාශනය පාලනය කරයි. NRF2 සමඟ සිදු වන දෙයට සමානව, FOXO සාමාජිකයින්ගේ ක්රියාකාරකම් නියාමනය කිරීමේ ස්ථර කිහිපයක් ඇත, ඒවා පෝෂණ හෝ ඔක්සිකාරක ආතතිය මත ප්රේරණය කළ හැකිය [121]. අවසාන වශයෙන්, lysosomal biogenesis හි ප්රධාන නියාමකයා ලෙස සැලකෙන පිටපත් කිරීමේ සාධකය TFEB, පෝෂණ ආතති තත්වයන් යටතේ ස්වයංක්රීයව නියාමනය කිරීමේදී තීරණාත්මක කාර්යභාරයක් ඉටු කරයි. මේ අනුව, mTORC1 නිෂේධනය කිරීම TFEB හි න්යෂ්ටික ස්ථාන මාරුවට සහ ස්වයංක්රීය ජානවල ප්රකාශනයට තුඩු දෙයි [122].
සමස්තයක් වශයෙන්, මෙම යන්ත්ර සූත්රවල විවිධ පිටපත් කිරීමේ නියාමකයන්ගේ පැවැත්ම විවිධ තත්වයන් යටතේ ප්රෝටෝස්ටැසිස් සහතික කළ හැකි ක්රොස්ටෝක් සහ අර්ධ වශයෙන් අතිරික්ත යාන්ත්රණයන් ද යෝජනා කරයි. ඒ අනුව, ඉහළ මට්ටමේ ඔක්සිකාරක ආතතියට සහාය වන පටක සඳහා NRF2 අදාළ භූමිකාවක් තිබිය හැකිය. නිදසුනක් වශයෙන්, ඔක්සිකාරක ආතතියෙන් ඇති කරන ලද NRF2, සාගින්න තත්වයන් යටතේ TFEB සඳහා සොයාගෙන ඇති ආකාරයටම, ස්වයංක්රීයව නියාමනය කිරීම සඳහා පෝෂක-පොහොසත් තත්ව යටතේ ක්රියා කළ හැක. එපමනක් නොව, මොළය බොහෝ දුරට පෝෂ්ය පදාර්ථ වලින් පොහොසත් තත්ව යටතේ ක්රියා කරයි, NRF2 නියුරෝන වල ස්වයංක්රීයකරණය සක්රීය කිරීමට අදාළ යාන්ත්රණයක් ලෙස ඉදිරිපත් කරයි.
Proteinopathies හි NRF2 සඳහා ප්රොමිංසිං-චිකිත්සක විභවය
පසුගිය වසර කිහිපය තුළ, UPR, UPS සහ NRF2 ක්රියාකාරකම් පිළිබඳ ස්වයංක්රීයකරණයේ නියාමන භූමිකාවන් මෙන්ම මෙම පද්ධති තුනේ සංරචකවල අන්යෝන්ය NRF2-මැදිහත් වූ පිටපත් කිරීම පිළිබඳ දැනුමේ විශාල ප්රගතියක් ලබා ඇත. එබැවින්, ස්නායු විකෘති රෝග වල ප්රෝටීන නිෂ්කාශනය කිරීමේ තීරණාත්මක නියාමකයක් ලෙස NRF2 සූරාකෑම මත පදනම්ව නව චිකිත්සක හැකියාවන් මතු විය හැකිය.
කෙසේ වෙතත්, ඉතිරිව ඇති ප්රධාන ප්රශ්නය නම් මොළයේ NRF2 මට්ටම් වැඩි කිරීමට එය ප්රයෝජනවත්ද හානිකරද යන්නයි. NFE2L2 ජානය ඉතා බහුරූපී බව සහ එහි ප්රවර්ධක නියාමන කලාපයේ දක්නට ලැබෙන ඇතැම් තනි නියුක්ලියෝටයිඩ බහුරූපතාවන් ජනගහන මට්ටමින් ජාන ප්රකාශනයේ භෞතික විද්යාත්මක විචල්යතා පරාසයක් සහ සමහර හැප්ලෝටයිපින් සැපයිය හැකි බැවින්, වසංගත රෝග දත්ත විශ්ලේෂණය අර්ධ පිළිතුරක් සැපයිය හැක. AD, PD හෝ ALS වල අවදානම අඩු වීම සහ/හෝ ප්රමාද වූ ආරම්භය සමඟ සම්බන්ධ විය [123]. එපමනක් නොව, හේස් සහ සගයන් විසින් [124] විසින් සාකච්ඡා කරන ලද පරිදි, NRF2 බලපෑම U-හැඩැති ප්රතිචාරයක් තිබිය හැක, එනම් NRF2 මට්ටම ඉතා අඩු සයිටොප්රොටෙක්ෂන් නැතිවීමට සහ ආතතියට ගොදුරු වීමේ වැඩි ප්රතිඵලයක් විය හැකි අතර, NRF2 වැඩි වීම හෝමියෝස්ටැටික් සමතුලිතතාවයට බාධා කළ හැකිය. ප්රෝටීන වැරදි ලෙස නැවීම සහ එකතු කිරීම සඳහා අනුග්රහය දක්වන අඩු කිරීමේ අවස්ථාවක් (අඩු කිරීමේ ආතතිය). මොළයේ අඩු NRF2 මට්ටම් ව්යාධි තත්ත්වයන් යටතේ ප්රතිලාභයක් ලබා ගැනීම සඳහා සුළු ඉහළ නියාමනයක් ප්රමාණවත් විය හැකිය යන අදහසට සහාය වේ. ඇත්ත වශයෙන්ම, ප්රෝටීන නිෂ්කාශනය සඳහා ඖෂධීය NRF2-මැදිහත් සක්රීය කිරීමේ ආරක්ෂිත භූමිකාව විවිධ ස්නායු විකෘති සෛල සංස්කෘතියේ සහ vivo ආකෘතිවල පෙන්වා ඇත.
SFN යනු ඖෂධීය NRF2 සක්රියකාරකයක් වන අතර එය ප්රෝටිසෝමල් සහ ස්වයංක්රීය ජාන ප්රකාශනය ඇති කිරීමට ප්රේරණය කරන ලදී [95], [36]. සිත්ගන්නා කරුණ නම්, ජෝ සහ සගයන් විසින් SFN විසින් පොස්පරීකරණය කරන ලද TAU මට්ටම් අඩු කර Beclin-1 සහ LC3-II වැඩි කරන බව පෙන්නුම් කරන ලදී, NRF2 සක්රිය කිරීම ස්වයංක්රීයකරණය හරහා මෙම විෂ ප්රෝටීනය පිරිහීමට පහසුකම් සැලසිය හැකි බව යෝජනා කරයි [113]. එපමනක් නොව, SFN සමඟ mHtt හි පිරිහීම වැඩිදියුණු කරන ලද අතර, MG132 භාවිතයෙන් මෙය ප්රතිවර්තනය කරන ලදී, මෙම විෂ සහිත ප්රෝටීනයේ ප්රෝටිසෝම පරිහානිය පෙන්නුම් කරයි [95]. කාබනික ෆ්ලේවනොයිඩ් ෆිසෙටින් සමඟ පොස්ෆෝ- සහ දිය නොවන-TAU හි ස්වයංක්රීය-මැදිහත්වීම හායනය වාර්තා විය. මෙම සංයෝගය TFEB සහ NRF2 යන දෙකෙහිම සක්රීය කිරීම සහ න්යෂ්ටික මාරු කිරීම, එහි සමහර ඉලක්කගත ජාන සමඟ එකවර ප්රවර්ධනය කිරීම මගින් ස්වයංක්රීයකරණය ඇති කිරීමට සමත් විය. TFEB හෝ NRF2 නිශ්ශබ්ද කිරීම [125] මගින් මෙම ප්රතිචාරය වලක්වා ඇත. බොට් සහ සගයන් විසින් ප්රෝටීන් සමූහයන් ඇති පොලිග්ලූටමින්-කේතන CAG පුනරාවර්තන ප්රසාරණය නිසා ඇති වන ස්නායු විකෘතිතා ආබාධයක් වන කොඳු ඇට පෙළේ සහ බල්බාර් මාංශ පේශි ක්ෂය වීමේ ප්රෝටීන් විෂ වීම මත එකවර NRF2, NRF1 සහ HSF1 සක්රියකාරකයේ වාසිදායක බලපෑම් වාර්තා කරන ලදී [126]. බහු ස්ක්ලේරෝසිස් [2], [12] සඳහා ප්රතිකාර කිරීම සඳහා NRF2 ප්රේරක ඩයිමීතයිල් ෆුමරේට් (DMF) හි වාචික සූත්රගත කිරීම BG-127 හි අනුමැතිය ඇතිව ස්නායු විකෘතිතා ආබාධ සඳහා ප්රතිකාර කිරීම සඳහා NRF128 සක්රීය කිරීමේ හැකියාව පෙන්නුම් කර ඇත. ශක්තිමත් ගිනි අවුලුවන සංරචකයක් සහිත ස්වයං ප්රතිශක්තිකරණ රෝග සමඟ ඩීඑම්එෆ් හි සාර්ථකත්වය පෙන්නුම් කරන්නේ මෙම ඖෂධය නැවත ස්ථානගත කිරීමෙන් ස්නායු විකෘතිතා රෝගවලට ප්රතිලාභ ලැබිය හැකි බවයි. PD හි ?-synucleinopathy ආකෘතියක් පිළිබඳ මෑතකාලීන පූර්ව සායනික අධ්යයනයක දී, DMF එහි ස්වයංක්රීය ප්රේරණය [129] හේතුවෙන් අර්ධ වශයෙන් ස්නායු ආරක්ෂක බව පෙන්නුම් කරන ලදී. NRF2 ස්නායු පරිහානියට හිතකර බලපෑම් වාර්තා කරන නමුත් ප්රෝටීන් නිෂ්කාශනය කෙරෙහි එහි බලපෑම කෙරෙහි අවධානය යොමු නොකරන අධ්යයනයන් ඊටත් වඩා බහුල වේ (පුළුල් සමාලෝචනයක් සඳහා, [7] බලන්න). ඔක්සිකාරක ආතතිය, ස්නායු ප්රදාහය හෝ මයිටොකොන්ඩ්රිය අක්රියතාව ඇතුළුව NRF2 හි එක් පහරකින් එකවර ඉලක්ක කළ හැකි බහුවිධ හානිකර ක්රියාවලීන් ඉස්මතු කරන බැවින් මෙය බෙහෙවින් අදාළ වේ. කෙසේ වෙතත්, NRF2 හි ඖෂධීය සක්රීය කිරීම මොළයේ විෂ සහිත ප්රෝටීන ක්ෂය වීම පහසු කිරීම සඳහා වලංගු උපාය මාර්ගයක් විය හැකිද යන්න නිශ්චිතවම තීරණය කිරීමට අනාගත කටයුතු අවශ්ය වනු ඇත.
කලින් පැහැදිලි කළ පරිදි, GSK-3 උත්සන්න කළාද? ස්නායු විකෘතිතා රෝග වලදී ක්රියාකාරකම් වාර්තා වී ඇති අතර එහි ප්රතිඵලයක් ලෙස NRF2 අඩු කිරීම හානිකර ප්රතිඵල සඳහා අර්ධ වශයෙන් වගකිව හැකි බව අනුමාන කර ඇත. මෙම ව්යාධිජනක තත්වයන් යටතේ, GSK-3 නිෂේධකයන්ට NRF2 මට්ටම් සහ ප්රෝටෝස්ටැසිස් වැඩි කිරීමට සහයෝගී විය හැක. GSK-3 නිෂේධකවල වාසිදායක බලපෑම් ස්නායු විකෘති කිරීමේ විවිධ මාදිලිවල වාර්තා වී ඇති අතර, වඩාත් සිත්ගන්නා කරුණ නම්, GSK-3 මර්දනය මගින් විෂ සහිත ප්රෝටීන [130], [131], [132], [133] අඩු කරන බව පෙන්වා දී ඇත. GSK-3 නිෂේධනය සහ ප්රෝටියෝස්ටැසිස් ප්රවර්ධනය කරන ජානවල NRF2-පිටපත් කිරීමේ නියාමනය අතර සෘජු සම්බන්ධයක් තවමත් නිරීක්ෂණය වී නැතත්, GSK-3 ක්රියාකාරකම් පහත හෙළීම NRF2 මට්ටම් වැඩි කිරීමට හේතු වනු ඇතැයි අනුමාන කිරීම සාධාරණ ය, එය අවසානයේ ශක්තිමත් වීමට හේතු වනු ඇත. proteostasis.
NRF2 හි පිටපත් කිරීමේ ක්රියාකාරකම් මෙන්ම ප්රෝටෝස්ටැසිස් පවත්වා ගැනීමේ සෛලීය ධාරිතාව වයස සමඟ අඩු වන අතර එය ස්නායු විකෘති රෝග වර්ධනය සඳහා ප්රධාන අවදානම් සාධකය වේ. NRF2 ශක්තිමත් කිරීම සහ එහි ප්රතිඵලයක් ලෙස ප්රෝටෝස්ටැසිස් අවම වශයෙන් ප්රෝටීන් සමුච්චය වීම සහ ස්නායු පරිහානිය ප්රමාද කරනු ඇතැයි සිතීම සාධාරණ ය. ඇත්ත වශයෙන්ම, 18?-glycyrrhetinic අම්ලය (18?-GA) ට්රයිටර්පෙනයිඩ් සමඟ මානව වැඩිහිටි ෆයිබ්රොබ්ලාස්ට් වලට ප්රතිකාර කිරීම NRF2 සක්රීය කිරීම ප්රවර්ධනය කරන අතර, ප්රෝටීසෝම ප්රේරණයට සහ වැඩි දියුණු කළ ආයු කාලයට මග පාදයි. මෙම අධ්යයනයෙන් ඇඟවෙන්නේ NRF2 හි ඖෂධීය සක්රීය කිරීම ජීවිතයේ අගභාගයේදී පවා කළ හැකි බවයි [86]. එපමනක් නොව, පසුව කරන ලද අධ්යයනයකින් පෙන්නුම් කළේ මෙම සංයෝගය SKN-1 සහ C.elegans හි ප්රෝටීසෝම සක්රීය කිරීම මැදිහත් වී අදාළ නෙමටෝඩා ආකෘතිවල AD ප්රගතිය කෙරෙහි හිතකර බලපෑම් ඇති කරන බවයි [134].
සෑම දෙයක්ම සලකා බැලූ විට, ප්රෝටියෝස්ටැසිස් ආශ්රිත ජානවල NRF2-මැදිහත් වූ ප්රේරණය විවිධ ප්රෝටීන් රෝග වලදී ප්රයෝජනවත් වන බව පෙනේ.
සල්ෆෝරාපේන් සහ පිළිකා, මරණ, වයස්ගත වීම, මොළය සහ හැසිරීම, හෘද රෝග සහ තවත් දේ කෙරෙහි එහි බලපෑම්
Isothiocyanates යනු ඔබේ ආහාර වේලට ලබා ගත හැකි වැදගත්ම ශාක සංයෝග කිහිපයකි. මෙම වීඩියෝවෙන් මම ඔවුන් සඳහා මෙතෙක් කර ඇති වඩාත්ම සවිස්තරාත්මක නඩුව ඉදිරිපත් කරමි. කෙටි අවධානයක්? පහත කාල ලක්ෂ්යවලින් එකක් ක්ලික් කිරීමෙන් ඔබේ ප්රියතම මාතෘකාව වෙත යන්න. සම්පූර්ණ කාලසටහන පහතින්.
ප්රධාන කොටස්:
- 00:01:14 - පිළිකා සහ මරණ
- 00:19:04 - වයසට යාම
- 00:26:30 - මොළය සහ හැසිරීම
- 00:38:06 - අවසාන නැවත බැලීම
- 00:40:27 - මාත්රාව
සම්පූර්ණ කාලරේඛාව:
- 00:00:34 - වීඩියෝවේ ප්රධාන අවධානයක් වන සල්ෆෝරාපේන් හඳුන්වාදීම.
- 00:01:14 - කුරුස එළවළු පරිභෝජනය සහ සියලු හේතු මරණ අනුපාතය අඩු කිරීම.
- 00:02:12 - පුරස්ථි පිළිකා අවදානම.
- 00:02:23 - මුත්රාශයේ පිළිකා අවදානම.
- 00:02:34 - දුම් පානය කරන්නන්ගේ පෙනහළු පිළිකා අවදානම.
- 00:02:48 - පියයුරු පිළිකා අවදානම.
- 00:03:13 - උපකල්පිත: ඔබට දැනටමත් පිළිකාවක් ඇත්නම් කුමක් කළ යුතුද? (මැදිහත්වීමේ)
- 00:03:35 - පිළිකා සහ මරණ අනුබද්ධ දත්ත මෙහෙයවන පිළිගත හැකි යාන්ත්රණය.
- 00:04:38 - Sulforaphane සහ පිළිකා.
- 00:05:32 - මීයන්ගේ මුත්රාශයේ ගෙඩි වර්ධනයට බ්රොකොලි පැළ නිස්සාරණයේ ප්රබල බලපෑමක් පෙන්නුම් කරන සත්ව සාක්ෂි.
- 00:06:06 - පුරස්ථි ග්රන්ථියේ පිළිකා රෝගීන් සඳහා සල්ෆෝරාපේන් සෘජුවම ලබා දීමේ බලපෑම.
- 00:07:09 - සැබෑ පියයුරු පටක වල isothiocyanate පරිවෘත්තීය ජෛව සමුච්චනය.
- 00:08:32 - පියයුරු පිළිකා ප්රාථමික සෛල නිෂේධනය කිරීම.
- 00:08:53 - ඉතිහාස පාඩම: පුරාණ රෝමයේ පවා බ්රැසිකා සෞඛ්ය ගුණාංග ඇති බව තහවුරු විය.
- 00:09:16 - පිළිකා කාරක බැහැර කිරීම (බෙන්සීන්, ඇක්රොලීන්) වැඩි දියුණු කිරීමට සල්ෆෝරාපේන්ගේ හැකියාව.
- 00:09:51 - NRF2 ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය හරහා ජානමය ස්විචයක් ලෙස.
- 00:10:10 - NRF2 සක්රිය කිරීම glutathione-S-conjugates හරහා පිළිකා කාරක පිටකිරීම වැඩි දියුණු කරන ආකාරය.
- 00:10:34 - Brussels sprouts glutathione-S-transferase වැඩි කරන අතර DNA හානි අඩු කරයි.
- 00:11:20 - Broccoli sprout පානය බෙන්සීන් බැහැර කිරීම 61% කින් වැඩි කරයි.
- 00:13:31 – Broccoli sprout homogenate ඉහළ ශ්වසන මාර්ගයේ ප්රතිඔක්සිකාරක එන්සයිම වැඩි කරයි.
- 00:15:45 - කුරුස එළවළු පරිභෝජනය සහ හෘද රෝග මරණ.
- 00:16:55 - බ්රොකොලි පැළ කුඩු 2 වර්ගයේ දියවැඩියා රෝගීන්ගේ රුධිර ලිපිඩ සහ සමස්ත හෘද රෝග අවදානම වැඩි දියුණු කරයි.
- 00:19:04 - වයසට යාමේ අංශයේ ආරම්භය.
- 00:19:21 - සල්ෆෝරාපේන් බහුල ආහාර කුරුමිණියන්ගේ ආයු කාලය 15 සිට 30% දක්වා වැඩි කරයි (ඇතැම් තත්වයන් යටතේ).
- 00:20:34 - දිගුකාලීන පැවැත්ම සඳහා අඩු දැවිල්ලක වැදගත්කම.
- 00:22:05 - කුරුස එළවළු සහ බ්රොකොලි පැළ කුඩු මිනිසුන් තුළ විවිධාකාර ගිනි අවුලුවන සලකුණු අඩු කරන බව පෙනේ.
- 00:23:40 - මැද-වීඩියෝ නැවත බැලීම: පිළිකා, වයස්ගත කොටස්
- 00:24:14 - මවුස් අධ්යයනයන් යෝජනා කරන්නේ සල්ෆෝරාපේන් මහලු වියේදී අනුවර්තන ප්රතිශක්තිකරණ ක්රියාකාරිත්වය වැඩි දියුණු කළ හැකි බවයි.
- 00:25:18 - සල්ෆෝරාපේන් තට්ටය දැමීමේ මූසික ආකෘතියක හිසකෙස් වර්ධනය වැඩි දියුණු කළේය. පින්තූරය 00:26:10 ට.
- 00:26:30 - මොළයේ සහ හැසිරීම් අංශයේ ආරම්භය.
- 00:27:18 - ඔටිසම් මත බ්රොකොලි පැළ සාරය බලපෑම.
- 00:27:48 - භින්නෝන්මාදය මත ග්ලූකෝරෆනින් වල බලපෑම.
- 00:28:17 - අවපාත සාකච්ඡාවේ ආරම්භය (පිළිගත හැකි යාන්ත්රණය සහ අධ්යයන).
- 00:31:21 – ආතති-ප්රේරිත මානසික අවපීඩනයේ විවිධ මාදිලි 10 ක් භාවිතා කරමින් මූසික අධ්යයනය සල්ෆෝරාපේන් ෆ්ලෝක්සෙටීන් (ප්රෝසාක්) හා සමානව ඵලදායී බව පෙන්වයි.
- 00:32:00 - අධ්යයනයෙන් පෙන්නුම් කරන්නේ මීයන් තුළ ග්ලූකෝරෆනින් සෘජුවම ශරීරගත වීම සමාජ පරාජයේ ආතති ආකෘතියෙන් මානසික අවපීඩනය වැළැක්වීමට සමානව ඵලදායී බවයි.
- 00:33:01 - neurodegeneration අංශයේ ආරම්භය.
- 00:33:30 - සල්ෆෝරාපේන් සහ ඇල්සයිමර් රෝගය.
- 00:33:44 - සල්ෆෝරාපේන් සහ පාකින්සන් රෝගය.
- 00:33:51 - Sulforaphane සහ Hungtington's රෝගය.
- 00:34:13 - Sulforaphane තාප කම්පන ප්රෝටීන වැඩි කරයි.
- 00:34:43 - කම්පන සහගත මොළයේ තුවාල අංශයේ ආරම්භය.
- 00:35:01 - TBI මතකය වැඩි දියුණු කළ වහාම Sulforaphane එන්නත් කිරීම (මූසික අධ්යයනය).
- 00:35:55 - Sulforaphane සහ නියුරෝන ප්ලාස්ටික්.
- 00:36:32 - සල්ෆෝරාපේන් මීයන් තුළ II වර්ගයේ දියවැඩියා ආකෘතියේ ඉගෙනීම වැඩි දියුණු කරයි.
- 00:37:19 - Sulforaphane සහ duchenne මස්කියුලර් ඩිස්ට්රොෆි.
- 00:37:44 - මාංශ පේශි චන්ද්රිකා සෛලවල Myostatin නිෂේධනය (in vitro).
- 00:38:06 - ප්රමාද වීඩියෝ පුනරුච්චාරණය: මරණ සහ පිළිකා, DNA හානි, ඔක්සිකාරක ආතතිය සහ දැවිල්ල, බෙන්සීන් බැහැර කිරීම, හෘද වාහිනී රෝග, දෙවන වර්ගයේ දියවැඩියාව, මොළයට බලපෑම් (මානසික අවපීඩනය, ඔටිසම්, භින්නෝන්මාදය, ස්නායු විකෘති වීම), NRF2 මාර්ගය.
- 00:40:27 - බ්රොකොලි පැළ හෝ සල්ෆෝරාපේන් මාත්රාවක් සොයා ගැනීම පිළිබඳ සිතුවිලි.
- 00:41:01 - නිවසේ පැළවීම පිළිබඳ කථා.
- 00:43:14 - පිසීමේ උෂ්ණත්වය සහ සල්ෆෝරාපේන් ක්රියාකාරිත්වය මත.
- 00:43:45 - ග්ලූකෝරෆනින් වලින් සල්ෆෝරාපේන් බඩවැල් බැක්ටීරියාව පරිවර්තනය කිරීම.
- 00:44:24 - එළවළු වලින් සක්රීය මයිරොසිනේස් සමඟ සංයෝජිතව ඇති විට අතිරේක හොඳින් ක්රියා කරයි.
- 00:44:56 - පිසීමේ ශිල්පීය ක්රම සහ කුරුස එළවළු.
- 00:46:06 - Goitrogens ලෙස Isothiocyanates.

න්යෂ්ටික සාධකය එරිත්රොයිඩ්-ව්යුත්පන්න 2 (NF-E2) ආශ්රිත සාධකය 2, වෙනත් ආකාරයකින් Nrf2 ලෙස හැඳින්වේ, ප්රතිඔක්සිකාරක සහ විෂ නසන එන්සයිමවල ප්රකාශනය නියාමනය කරන පිටපත් කිරීමේ සාධකයකි. පර්යේෂණ අධ්යයන මගින් ඔක්සිකාරක ආතතිය පාලනය කිරීමේදී එහි කාර්යභාරය ද පෙන්නුම් කර ඇත. ඇල්සයිමර් රෝගය සහ පාකින්සන් රෝගය වැනි බොහෝ ස්නායු විකෘතිතා රෝග, ඔක්සිකාරක ආතතිය සහ නිදන්ගත දැවිල්ල මගින් සංලක්ෂිත වේ. Nrf2 ප්රතිකාර ප්රවේශයන්. ආචාර්ය ඇලෙක්ස් ජිමිනෙස් ඩීසී, සීසීඑස්ටී ඉන්සයිට්
සමාප්ති සටහන්
පිටපත් කිරීමේ සාධකය NRF2 UPR, UPS සහ autophagy හි වෙනස්කම් සංවේදනය කිරීම සහ මොඩියුලේට් කිරීම මගින් ප්රෝටෝස්ථිතික ප්රතිචාරයක් සංවිධානය කරයි (රූපය 4). ප්රතිඵලයක් ලෙස, NRF2 හි ඌනතාවය ප්රෝටීන් නිෂ්කාශනය සඳහා NRF2 අවශ්ය බව යෝජනා කරමින් ප්රෝටීන් රෝග උත්සන්න කරන බව පෙන්වා දී ඇත. සියල්ල එක්ව, අපට NRF2 ප්රෝටීන් රෝග සඳහා සිත්ගන්නා චිකිත්සක ඉලක්කයක් විය හැකි යැයි අනුමාන කළ හැකිය.
 රූප සටහන 4 NRF2 ප්රෝටෝටොක්සික් ව්යුත්පන්න හදිසි සංඥා ආරක්ෂිත පිටපත් කිරීමේ ප්රතිචාරයකට සම්බන්ධ කරන මධ්යස්ථානයක් ලෙස. දිග හැරුණු / වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය වීම ER හි දිග හැරුණු ප්රෝටීන් ප්රතිචාරය (UPR) සක්රිය කිරීමට හේතු වේ. PERK හෝ MAPK සක්රිය කිරීමේ ප්රතිඵලයක් ලෙස ER-Reident Gpx8 සහ GSH මට්ටම් නියාමනය කරන එන්සයිම කිහිපයක පිටපත් කිරීමේ ප්රේරණය සිදු විය හැක, නිවැරදි ප්රෝටීන් නැමීම සහතික කිරීම සඳහා වැදගත් වේ. ප්රෝටීන් සමස්ථයන් ප්රෝටිසෝම ක්රියාකාරකම් (UPS) වළක්වයි, සමහර විට NRF2 පිරිහීම වළක්වයි. NRF2 විසින් Psma3, Psma6, Psmb1, Psmb5 සහ Pomp ජානවල පිටපත් කිරීම විශේෂිතව මොඩියුලේට් කරන බව පෙන්වා දී ඇත. තවත් උප ඒකක කිහිපයක් D2T වලට ප්රතිචාර වශයෙන් NRF3 මත යැපෙන ආකාරයෙන් නියාමනය කරන ලද අතර, NRF2 මගින් නියාමනය කරන ලද ප්රෝටිසෝම අනු ඒකක ලැයිස්තුව විශාල කරයි. ප්රෝටීන් සමස්ථයන් ක්ෂය වීමේ ප්රධාන මාර්ගය ස්වයංක්රීයකරණයයි. ස්වයංක්රීයකරණය NRF2 නියාමනය කරයි, p2, Ndp62, Ulk52, Atg1b, Atg2c, Atg4, Atg5 සහ Gabarapl7 හි NRF1 පිටපත් කිරීමේ ප්රේරණය සමඟ මෙම පිරිහීමේ මාර්ගය සම්බන්ධ කරයි.
රූප සටහන 4 NRF2 ප්රෝටෝටොක්සික් ව්යුත්පන්න හදිසි සංඥා ආරක්ෂිත පිටපත් කිරීමේ ප්රතිචාරයකට සම්බන්ධ කරන මධ්යස්ථානයක් ලෙස. දිග හැරුණු / වැරදි ලෙස නැමුණු ප්රෝටීන සමුච්චය වීම ER හි දිග හැරුණු ප්රෝටීන් ප්රතිචාරය (UPR) සක්රිය කිරීමට හේතු වේ. PERK හෝ MAPK සක්රිය කිරීමේ ප්රතිඵලයක් ලෙස ER-Reident Gpx8 සහ GSH මට්ටම් නියාමනය කරන එන්සයිම කිහිපයක පිටපත් කිරීමේ ප්රේරණය සිදු විය හැක, නිවැරදි ප්රෝටීන් නැමීම සහතික කිරීම සඳහා වැදගත් වේ. ප්රෝටීන් සමස්ථයන් ප්රෝටිසෝම ක්රියාකාරකම් (UPS) වළක්වයි, සමහර විට NRF2 පිරිහීම වළක්වයි. NRF2 විසින් Psma3, Psma6, Psmb1, Psmb5 සහ Pomp ජානවල පිටපත් කිරීම විශේෂිතව මොඩියුලේට් කරන බව පෙන්වා දී ඇත. තවත් උප ඒකක කිහිපයක් D2T වලට ප්රතිචාර වශයෙන් NRF3 මත යැපෙන ආකාරයෙන් නියාමනය කරන ලද අතර, NRF2 මගින් නියාමනය කරන ලද ප්රෝටිසෝම අනු ඒකක ලැයිස්තුව විශාල කරයි. ප්රෝටීන් සමස්ථයන් ක්ෂය වීමේ ප්රධාන මාර්ගය ස්වයංක්රීයකරණයයි. ස්වයංක්රීයකරණය NRF2 නියාමනය කරයි, p2, Ndp62, Ulk52, Atg1b, Atg2c, Atg4, Atg5 සහ Gabarapl7 හි NRF1 පිටපත් කිරීමේ ප්රේරණය සමඟ මෙම පිරිහීමේ මාර්ගය සම්බන්ධ කරයි.
ස්තූතියි
Sciencedirect.com/science/article/pii/S2213231716304050
ඉහත ලිපියට අනුව, ස්නායු විකෘතිතා රෝග වල රෝග ලක්ෂණ විවිධ ප්රතිකාර විකල්ප හරහා ප්රතිකාර කළ හැකි අතර, පර්යේෂණ අධ්යයන මගින් Nrf2 සක්රීය කිරීම ප්රයෝජනවත් ප්රතිකාර ප්රවේශයක් විය හැකි බව පෙන්වා දී ඇත. නිසා Nrf2 සක්රියකාරක රෝග සඳහා පුළුල් යාන්ත්රණයන් ඉලක්ක කරයි, සියලුම ස්නායු විකෘති රෝග Nrf2 පිටපත් කිරීමේ සාධකය භාවිතයෙන් ප්රයෝජන ගත හැකිය. Nrf2 හි සොයාගැනීම් ස්නායු විකෘතිතා රෝග සඳහා ප්රතිකාර කිරීමේ විප්ලවීය වෙනසක් සිදු කර ඇත. අපගේ තොරතුරු වල විෂය පථය චිරොක්ට්රැක්ටික් සහ කොඳු ඇට පෙළේ සෞඛ්ය ගැටළු වලට සීමා වේ. විෂය කරුණු සාකච්ඡා කිරීමට, කරුණාකර වෛද්ය ජිමිනෙස්ගෙන් විමසීමට හෝ අපව අමතන්න915-850-0900 .
ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස් විසින් පාලනය කරන ලදී
යොමු කර ඇත්තේ:Sciencedirect.com
අතිරේක මාතෘකා සාකච්ඡාව: ශල්යකර්මයකින් තොරව දණහිසේ වේදනාව සමනය කිරීම
දණහිසේ වේදනාව යනු දණහිස් තුවාල සහ/හෝ විවිධ තත්වයන් නිසා ඇතිවිය හැකි ප්රසිද්ධ රෝග ලක්ෂණයකි.ක්රීඩා තුවාල ලබා ඇත. දණහිස මිනිස් සිරුරේ වඩාත් සංකීර්ණ සන්ධිවලින් එකකි, එය අස්ථි හතරක්, බන්ධන හතරක්, විවිධ කණ්ඩරාවන්, මෙනිස්කි දෙකක් සහ කාටිලේජයේ ඡේදනය වීමෙන් සෑදී ඇත. පවුලේ වෛද්යවරුන්ගේ ඇමරිකානු ඇකඩමියට අනුව, දණහිසේ වේදනාවට වඩාත් පොදු හේතු වන්නේ පැටලර් උපලුක්සේෂන්, පැටලර් ටෙන්ඩිනයිටිස් හෝ ජම්පර්ගේ දණහිස සහ ඔස්ගුඩ්-ෂ්ලැටර් රෝගයයි. දණහිස් වේදනාව බොහෝ විට අවුරුදු 60 ට වැඩි පුද්ගලයින් තුළ ඇති වුවද, දණහිසේ වේදනාව ළමුන් හා නව යොවුන් වියේ දී ද ඇති විය හැක. දණහිසේ වේදනාව RICE ක්රම අනුගමනය කරමින් නිවසේදී ප්රතිකාර කළ හැක, කෙසේ වෙතත්, දරුණු දණහිස් තුවාල සඳහා චිරොක්ට්රැක්ටික් ප්රතිකාර ඇතුළුව වහාම වෛද්ය ප්රතිකාර අවශ්ය විය හැකිය. �
***
by ආචාර්ය ඇලෙක්ස් ජිමිනෙස් | පිළිකා සෞඛ්ය, විෂාදිය, ක්රියාකාරී වෛද්ය විද්යාව, සෞඛ්යය, බෙහෙත් වෛද්ය විද්යාව, ස්වභාවික සෞඛ්යය, පෝෂණ, ඔක්සිකාරක ආතතිය, පර්යේෂණ අධ්යයන, අතිරේක, ප්රතිකාර, සුවතාව
ඔක්සිකාරක ආතතිය යනු නිදහස් රැඩිකලුන් හෝ අස්ථායී අණු මගින් සිදුවන සෛල හානි ලෙස විස්තර කර ඇති අතර එය අවසානයේ නිරෝගී ක්රියාකාරිත්වයට බලපායි. මිනිස් සිරුර බැක්ටීරියා සහ වෛරස් උදාසීන කිරීම සඳහා නිදහස් රැඩිකලුන් නිර්මාණය කරයි, කෙසේ වෙතත්, ඔක්සිජන්, දූෂණය සහ විකිරණ වැනි බාහිර සාධක බොහෝ විට නිදහස් රැඩිකලුන් නිපදවිය හැකිය. ඔක්සිකාරක ආතතිය බොහෝ සෞඛ්ය ගැටලු සමඟ සම්බන්ධ වී ඇත.
ඔක්සිකාරක ආතතිය සහ අනෙකුත් ආතතීන් මිනිස් සිරුරේ ප්රතිඔක්සිකාරක ප්රතිචාරය නියාමනය කිරීමට උපකාරී වන අභ්යන්තර ආරක්ෂණ යාන්ත්රණ ක්රියාත්මක කරයි. Nrf2 යනු ඔක්සිකාරක ආතතියේ මට්ටම් සංවේදනය කරන ප්රෝටීනයක් වන අතර සෛල වලට අභ්යන්තර හා බාහිර සාධක වලින් ආරක්ෂා වීමට හැකියාව ලබා දේ. Nrf2 ද ප්රතිඔක්සිකාරක එන්සයිම සහ ආතති ප්රතිචාර ජාන නිෂ්පාදනයට සම්බන්ධ ජාන නියාමනය කිරීමට උපකාරී වේ. යන්න පැහැදිලි කිරීම පහත ලිපියේ අරමුණයි Nrf2 හි බලපෑම් පිළිකාවක් තුළ.
වියුක්ත
Keap1-Nrf2 මාර්ගය ඔක්සිකාරක සහ ඉලෙක්ට්රොෆිලික් ආතතියට සයිටොප්රොටෙක්ටිව් ප්රතිචාරවල ප්රධාන නියාමකය වේ. පිටපත් කිරීමේ සාධකය Nrf2 මගින් අවුලුවන ලද සෛල සංඥා මාර්ග සාමාන්ය සහ පූර්ව පිළිකා සහිත පටක වල පිළිකා ආරම්භය සහ ප්රගතිය වළක්වන නමුත්, සම්පූර්ණයෙන්ම මාරාන්තික සෛල තුළ Nrf2 ක්රියාකාරකම් පිළිකා රසායනික ප්රතිරෝධය වැඩි කිරීමෙන් සහ පිළිකා සෛල වර්ධනය වැඩි කිරීමෙන් වර්ධන වාසියක් සපයයි. මෙම චිත්රක සමාලෝචනයේදී, අපි Keap1-Nrf2 මාර්ගය සහ පිළිකා සෛල තුළ එහි අක්රමිකතා පිළිබඳ දළ විශ්ලේෂණයක් සපයන්නෙමු. පිළිකා සෛල තුළ Nrf2 සක්රීය කිරීමේ ප්රතිවිපාක සහ පිළිකා ජාන ප්රතිකාරයේදී මෙය ප්රයෝජනයට ගත හැකි ආකාරය ද අපි කෙටියෙන් සාරාංශ කරමු.
ප්රධාන වචන: Nrf2, Keap1, පිළිකා, ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්යය, ජාන චිකිත්සාව
හැදින්වීම
Keap1-Nrf2 මාර්ගය ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ (ROS) සහ ඉලෙක්ට්රෝෆයිල් [1] මගින් ඇතිවන අන්තරාසර්ග සහ බාහිර ආතතීන්ට සයිටොප්රොටෙක්ටිව් ප්රතිචාර වල ප්රධාන නියාමකය වේ. මාර්ගය තුළ ඇති ප්රධාන සංඥා ප්රෝටීන වන්නේ ඉලක්කගත ජානවල නියාමන කලාපවල ඇති ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය (ARE) වෙත කුඩා Maf ප්රෝටීන සමඟ එකට බැඳෙන පිටපත් කිරීමේ සාධකය Nrf2 (න්යෂ්ටික සාධකය එරිත්රොයිඩ් 2-ආශ්රිත සාධකය 2) සහ Keap1 (Kelch ECH) වේ. ආශ්රිත ප්රෝටීන් 1), Nrf2 සමඟ බන්ධනය වන සහ ubiquitin proteasome මාර්ගය මගින් එහි පිරිහීම ප්රවර්ධනය කරන ප්රතිරෝධක ප්රෝටීනයකි (රූපය 1). Keap1 යනු ඉතා cysteine බහුල ප්රෝටීනයකි, Mouse Keap1 හි මුළු 25 සහ මානව 27 cysteine අපද්රව්ය ඇති අතර, ඒවායින් බොහොමයක් විවිධ ඔක්සිකාරක සහ ඉලෙක්ට්රෝෆයිල් මගින් vitro තුළ වෙනස් කළ හැක [2]. මෙම අපද්රව්ය තුන, C151, C273 සහ C288, Nrf1 හි න්යෂ්ටික සංක්රමණයට තුඩු දෙන Keap2 හි අනුකූලතාව වෙනස් කිරීමෙන් සහ පසුව ඉලක්කගත ජාන ප්රකාශනයට [3] (රූපය 1) ක්රියාකාරී භූමිකාවක් ඉටු කරන බව පෙන්වා දී ඇත. Keap1 හි cysteine වෙනස් කිරීම් Nrf2 සක්රිය කිරීමට තුඩු දෙන නිවැරදි යාන්ත්රණය නොදනී, නමුත් පවතින නමුත් අන්යෝන්ය නොවන මාදිලි දෙක (1) Keap1 හි IVR හි පවතින තයෝල් අවශේෂවල Keap1 වෙනස් කිරීම් කරන hinge සහ latch ආකෘතිය වේ. Nrf2 සමඟ අන්තර්ක්රියා කඩාකප්පල් කර Nrf2 තුළ ඇති ලයිසීන් අපද්රව්ය තවදුරටත් බහුවිධීකරණය කළ නොහැකි අතර (2) තයෝල් වෙනස් කිරීම Keap3 වෙතින් Cul1 විඝටනය වීමට හේතු වන ආකෘතිය [3]. ආකෘති දෙකෙහිම, ප්රේරක-විශෝධිත සහ Nrf2-බන්ධිත Keap1 අක්රිය කර ඇති අතර, එහි ප්රතිඵලයක් ලෙස, අලුතින් සංස්ලේෂණය කරන ලද Nrf2 ප්රෝටීන් Keap1 මඟ හැර න්යෂ්ටිය තුළට මාරු වී, ARE වෙත බැඳී NAD(P)H වැනි Nrf2 ඉලක්කගත ජානවල ප්රකාශනය මෙහෙයවයි. ක්විනෝන් ඔක්සිඩෝඩක්ටේස් 1 (NQO1), හේම් ඔක්සිජන් 1 (HMOX1), ග්ලූටමේට්-සිස්ටයින් ලිගසේ (GCL) සහ ග්ලූටතයෝන් එස් ට්රාන්ස්පේස් (GSTs) (රූපය 2). Nrf1 ඉලක්කගත ජාන ප්රේරණයට හේතු වන Keap2 thiols හි වෙනස් කිරීම් වලට අමතරව, p21 සහ p62 වැනි ප්රෝටීන Nrf2 හෝ Keap1 සමඟ බැඳිය හැකි අතර එමඟින් Nrf2 සහ Keap1 අතර අන්තර්ක්රියා බාධා කරයි [1], [3] (රූපය 3).
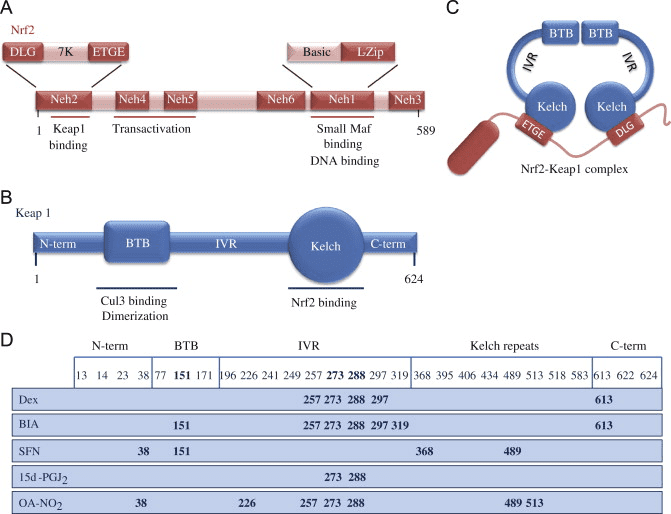 Fig. 1. Nrf2 සහ Keap1 හි ව්යුහයන් සහ cysteine කේතය. (A) Nrf2 ඇමයිනෝ අම්ල 589 කින් සමන්විත වන අතර පරිණාමීය ලෙස ඉහළ සංරක්ෂිත වසම් හයක් ඇත, Neh1-6. Neh1 හි මූලික කලාපයක් වන bZip මෝස්තරයක් අඩංගු වේ - ලියුසීන් සිපර් (L-Zip) ව්යුහය, මෙහි මූලික කලාපය DNA හඳුනාගැනීම සඳහා වගකිව යුතු අතර L-Zip කුඩා Maf ප්රෝටීන සමඟ dimerization සඳහා මැදිහත් වේ. Neh6 න්යෂ්ටියේ Nrf2 පරිහානියට මැදිහත් වීමට degron ලෙස ක්රියා කරයි. Neh4 සහ 5 පරිවර්තන වසම් වේ. Neh2 හි Keap1 සමඟ අන්තර්ක්රියා සඳහා අවශ්ය ETGE සහ DLG මෝස්තර සහ Keap7 මත යැපෙන බහුවිද්යාකරණය සහ Nrf1 පිරිහීම සඳහා අත්යවශ්ය වන ලයිසීන් අපද්රව්ය (2 K) හි හයිඩ්රොෆිලික් කලාපයක් අඩංගු වේ. (B) Keap1 ඇමයිනෝ අම්ල අවශේෂ 624 කින් සමන්විත වන අතර වසම් පහක් ඇත. BTB වසම සහ Kelch වසම යන ප්රෝටීන් ප්රෝටීන් අන්තර්ක්රියා චේතනාවන් දෙක අතරමැදි කලාපය (IVR) මගින් වෙන් කරනු ලැබේ. BTB වසම IVR හි N-පර්යන්ත කොටස සමඟ එක්ව Keap1 සමලිංගිකකරණය සහ Cullin3 (Cul3) සමඟ බන්ධනය කරයි. Kelch වසම සහ C-පර්යන්ත කලාපය Neh2 සමඟ අන්තර්ක්රියා කිරීමට මැදිහත් වේ. (C) Nrf2 එහි Neh1 ETGE සහ DLG මෝස්තර හරහා Keap2 අණු දෙකක් සමඟ අන්තර්ක්රියා කරයි. ETGE සහ DLG යන දෙකම Keap1 Kelch මෝස්තරයේ පහළ මතුපිට ඇති සමාන අඩවි වලට බැඳී ඇත. (D) Keap1 මිනිස් ප්රෝටීන් වල cysteine 27ක් සමඟින් cysteine අවශේෂ වලින් පොහොසත් වේ. මෙම සිස්ටීන් සමහරක් මූලික අපද්රව්ය අසල පිහිටා ඇති අතර එම නිසා ඉලෙක්ට්රොෆයිල් සහ ඔක්සිකාරකවල විශිෂ්ට ඉලක්ක වේ. ඉලෙක්ට්රෝෆයිල් මගින් සිස්ටීන් අපද්රව්ය වෙනස් කිරීමේ රටාව සිස්ටීන් කේතය ලෙස හැඳින්වේ. cysteine කේත කල්පිතය යෝජනා කරන්නේ ව්යුහාත්මකව වෙනස් Nrf2 සක්රීය කාරක විවිධ Keap1 cysteines වලට බලපාන බවයි. cysteine වෙනස් කිරීම් Keap1 හි අනුකූල වෙනස්කම් වලට තුඩු දෙයි, Nrf2 DLG සහ Keap1 Kelch වසම් අතර අන්තර්ක්රියා කඩාකප්පල් කරයි, එමඟින් Nrf2 හි බහුවිධකරණය වළක්වයි. ප්රේරක [151], [273] මගින් Nrf288 සක්රිය කිරීම සඳහා Nrf273 සහ Cys288 මර්දනය සඳහා Cys2 සහ Cys151 අවශ්ය වන බැවින් Cys2, Cys1 සහ Cys3 හි ක්රියාකාරී වැදගත්කම පෙන්වා ඇත.
Fig. 1. Nrf2 සහ Keap1 හි ව්යුහයන් සහ cysteine කේතය. (A) Nrf2 ඇමයිනෝ අම්ල 589 කින් සමන්විත වන අතර පරිණාමීය ලෙස ඉහළ සංරක්ෂිත වසම් හයක් ඇත, Neh1-6. Neh1 හි මූලික කලාපයක් වන bZip මෝස්තරයක් අඩංගු වේ - ලියුසීන් සිපර් (L-Zip) ව්යුහය, මෙහි මූලික කලාපය DNA හඳුනාගැනීම සඳහා වගකිව යුතු අතර L-Zip කුඩා Maf ප්රෝටීන සමඟ dimerization සඳහා මැදිහත් වේ. Neh6 න්යෂ්ටියේ Nrf2 පරිහානියට මැදිහත් වීමට degron ලෙස ක්රියා කරයි. Neh4 සහ 5 පරිවර්තන වසම් වේ. Neh2 හි Keap1 සමඟ අන්තර්ක්රියා සඳහා අවශ්ය ETGE සහ DLG මෝස්තර සහ Keap7 මත යැපෙන බහුවිද්යාකරණය සහ Nrf1 පිරිහීම සඳහා අත්යවශ්ය වන ලයිසීන් අපද්රව්ය (2 K) හි හයිඩ්රොෆිලික් කලාපයක් අඩංගු වේ. (B) Keap1 ඇමයිනෝ අම්ල අවශේෂ 624 කින් සමන්විත වන අතර වසම් පහක් ඇත. BTB වසම සහ Kelch වසම යන ප්රෝටීන් ප්රෝටීන් අන්තර්ක්රියා චේතනාවන් දෙක අතරමැදි කලාපය (IVR) මගින් වෙන් කරනු ලැබේ. BTB වසම IVR හි N-පර්යන්ත කොටස සමඟ එක්ව Keap1 සමලිංගිකකරණය සහ Cullin3 (Cul3) සමඟ බන්ධනය කරයි. Kelch වසම සහ C-පර්යන්ත කලාපය Neh2 සමඟ අන්තර්ක්රියා කිරීමට මැදිහත් වේ. (C) Nrf2 එහි Neh1 ETGE සහ DLG මෝස්තර හරහා Keap2 අණු දෙකක් සමඟ අන්තර්ක්රියා කරයි. ETGE සහ DLG යන දෙකම Keap1 Kelch මෝස්තරයේ පහළ මතුපිට ඇති සමාන අඩවි වලට බැඳී ඇත. (D) Keap1 මිනිස් ප්රෝටීන් වල cysteine 27ක් සමඟින් cysteine අවශේෂ වලින් පොහොසත් වේ. මෙම සිස්ටීන් සමහරක් මූලික අපද්රව්ය අසල පිහිටා ඇති අතර එම නිසා ඉලෙක්ට්රොෆයිල් සහ ඔක්සිකාරකවල විශිෂ්ට ඉලක්ක වේ. ඉලෙක්ට්රෝෆයිල් මගින් සිස්ටීන් අපද්රව්ය වෙනස් කිරීමේ රටාව සිස්ටීන් කේතය ලෙස හැඳින්වේ. cysteine කේත කල්පිතය යෝජනා කරන්නේ ව්යුහාත්මකව වෙනස් Nrf2 සක්රීය කාරක විවිධ Keap1 cysteines වලට බලපාන බවයි. cysteine වෙනස් කිරීම් Keap1 හි අනුකූල වෙනස්කම් වලට තුඩු දෙයි, Nrf2 DLG සහ Keap1 Kelch වසම් අතර අන්තර්ක්රියා කඩාකප්පල් කරයි, එමඟින් Nrf2 හි බහුවිධකරණය වළක්වයි. ප්රේරක [151], [273] මගින් Nrf288 සක්රිය කිරීම සඳහා Nrf273 සහ Cys288 මර්දනය සඳහා Cys2 සහ Cys151 අවශ්ය වන බැවින් Cys2, Cys1 සහ Cys3 හි ක්රියාකාරී වැදගත්කම පෙන්වා ඇත.
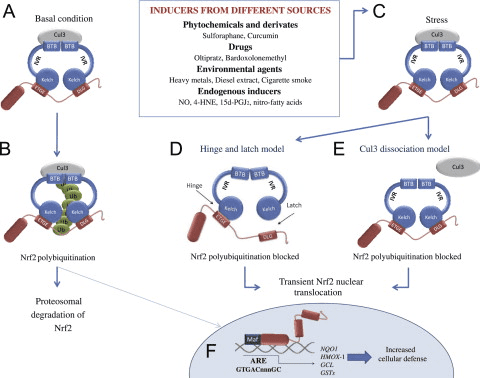 රූපය 2. Nrf2-Keap1 සංඥා මාර්ගය. (A සහ B) බාසල් තත්ත්වයේ දී, Keap1 අණු දෙකක් Nrf2 හා Nrf2 බන්ධනය වන අතර Cul3-පාදක E3 ligase සංකීර්ණය මගින් බහු ව්යාප්ත වේ. මෙම බහුබිම්කරණය ප්රෝටිසෝම මගින් වේගවත් Nrf2 ක්ෂය වීමට හේතු වේ. Nrf2 හි කුඩා ප්රතිශතයක් නිෂේධන සංකීර්ණයෙන් ගැලවී න්යෂ්ටිය තුළ එකතු වී බාසල් ARE මත යැපෙන ජාන ප්රකාශනයට මැදිහත් වන අතර එමඟින් සෛලීය හෝමියස්ටැසිස් පවත්වා ගනී. (C) ආතති තත්වයන් යටතේ, inducers විසින් Keap1 cysteines වෙනස් කරයි, එය නිෂේධන සංකීර්ණය විඝටනය කිරීම හරහා Nrf2 සර්වබලධාරීත්වය නිෂේධනය කරයි. (D) hinge සහ latch ආකෘතියට අනුව, නිශ්චිත Keap1 cysteine අපද්රව්ය වෙනස් කිරීම Keap1 හි අනුකූල වෙනස්කම් වලට තුඩු දෙන අතර එහි ප්රතිඵලයක් ලෙස Nrf2 DLG මෝස්තරය Keap1 වෙතින් වෙන් වේ. Nrf2 හි සෑම තැනකම පැතිරීම බාධා ඇති නමුත් ETGE මෝස්තරය සමඟ බැඳීම පවතී. (E) Keap1-Cul3 විඝටන ආකෘතියේ දී, ඉලෙක්ට්රෝෆයිල් වලට ප්රතිචාර වශයෙන් Keap1 සහ Cul3 බන්ධනය කඩාකප්පල් වන අතර, සර්වබලධාරී පද්ධතියෙන් Nrf2 ගැලවී යාමට හේතු වේ. යෝජිත ආකෘති දෙකෙහිම, ප්රේරකය-වෙනස් කළ සහ Nrf2-බන්ධිත Keap1 අක්රිය කර ඇති අතර, එහි ප්රතිඵලයක් ලෙස, අලුතින් සංස්ලේෂණය කරන ලද Nrf2 ප්රෝටීන් Keap1 මඟහැර න්යෂ්ටිය තුළට මාරු කර, ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය (ARE) වෙත බැඳී Nrf2 හි ඉලක්ක ප්රකාශනය මෙහෙයවයි. NQO1, HMOX1, GCL සහ GSTs [1], [3] වැනි ජාන.
රූපය 2. Nrf2-Keap1 සංඥා මාර්ගය. (A සහ B) බාසල් තත්ත්වයේ දී, Keap1 අණු දෙකක් Nrf2 හා Nrf2 බන්ධනය වන අතර Cul3-පාදක E3 ligase සංකීර්ණය මගින් බහු ව්යාප්ත වේ. මෙම බහුබිම්කරණය ප්රෝටිසෝම මගින් වේගවත් Nrf2 ක්ෂය වීමට හේතු වේ. Nrf2 හි කුඩා ප්රතිශතයක් නිෂේධන සංකීර්ණයෙන් ගැලවී න්යෂ්ටිය තුළ එකතු වී බාසල් ARE මත යැපෙන ජාන ප්රකාශනයට මැදිහත් වන අතර එමඟින් සෛලීය හෝමියස්ටැසිස් පවත්වා ගනී. (C) ආතති තත්වයන් යටතේ, inducers විසින් Keap1 cysteines වෙනස් කරයි, එය නිෂේධන සංකීර්ණය විඝටනය කිරීම හරහා Nrf2 සර්වබලධාරීත්වය නිෂේධනය කරයි. (D) hinge සහ latch ආකෘතියට අනුව, නිශ්චිත Keap1 cysteine අපද්රව්ය වෙනස් කිරීම Keap1 හි අනුකූල වෙනස්කම් වලට තුඩු දෙන අතර එහි ප්රතිඵලයක් ලෙස Nrf2 DLG මෝස්තරය Keap1 වෙතින් වෙන් වේ. Nrf2 හි සෑම තැනකම පැතිරීම බාධා ඇති නමුත් ETGE මෝස්තරය සමඟ බැඳීම පවතී. (E) Keap1-Cul3 විඝටන ආකෘතියේ දී, ඉලෙක්ට්රෝෆයිල් වලට ප්රතිචාර වශයෙන් Keap1 සහ Cul3 බන්ධනය කඩාකප්පල් වන අතර, සර්වබලධාරී පද්ධතියෙන් Nrf2 ගැලවී යාමට හේතු වේ. යෝජිත ආකෘති දෙකෙහිම, ප්රේරකය-වෙනස් කළ සහ Nrf2-බන්ධිත Keap1 අක්රිය කර ඇති අතර, එහි ප්රතිඵලයක් ලෙස, අලුතින් සංස්ලේෂණය කරන ලද Nrf2 ප්රෝටීන් Keap1 මඟහැර න්යෂ්ටිය තුළට මාරු කර, ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය (ARE) වෙත බැඳී Nrf2 හි ඉලක්ක ප්රකාශනය මෙහෙයවයි. NQO1, HMOX1, GCL සහ GSTs [1], [3] වැනි ජාන.
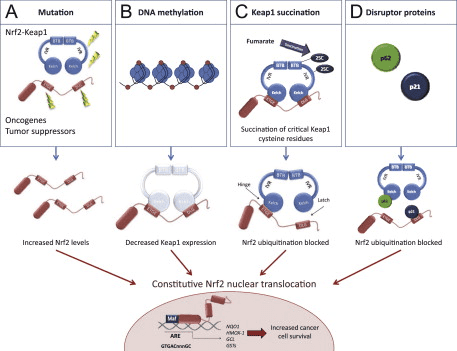 Fig. 3. පිළිකා වලදී Nrf2 හි න්යෂ්ටික සමුච්චය සඳහා යාන්ත්රණ. (A) Nrf2 හෝ Keap1 හි ඇති සොමැටික් විකෘති මෙම ප්රෝටීන දෙකේ අන්තර් ක්රියාකාරිත්වය කඩාකප්පල් කරයි. Nrf2 හි, විකෘති ETGE සහ DLG ආකෘතීන් කෙරෙහි බලපාන නමුත්, Keap1 හි විකෘති වඩාත් ඒකාකාරව බෙදා හැරේ. තවද, KrasG12D[5] වැනි පිළිකා කාරක සක්රීය කිරීම හෝ PTEN [11] වැනි පිළිකා මර්දන යන්ත්ර කඩාකප්පල් කිරීම Nrf2 හි පිටපත් කිරීමේ ප්රේරණයට සහ න්යෂ්ටික Nrf2 වැඩි වීමට හේතු විය හැක. (B) පෙනහළු සහ පුරස්ථි ග්රන්ථියේ පිළිකා වල Keap1 ප්රවර්ධකයේ හයිපර්මීතයිලීකරණය Keap1 mRNA ප්රකාශනය අඩු කිරීමට මග පාදයි, එය Nrf2 [6], [7] හි න්යෂ්ටික සමුච්චය වැඩි කරයි. (C) පවුලේ පැපිලරි වකුගඩු පිළිකා වලදී, fumarate හයිඩ්රේටේස් එන්සයිම ක්රියාකාරිත්වය නැතිවීම fumarate සමුච්චය වීමට තුඩු දෙන අතර තවදුරටත් Keap1 cysteine අවශේෂ (2SC) උරාබීම දක්වා ගමන් කරයි. මෙම පශ්චාත් පරිවර්තන වෙනස් කිරීම Keap1-Nrf2 අන්තර්ක්රියා කඩාකප්පල් කිරීමට සහ Nrf2 [8], [9] හි න්යෂ්ටික සමුච්චය වීමට හේතු වේ. (D) p62 සහ p21 වැනි කඩාකප්පල්කාරී ප්රෝටීන සමුච්චය වීම Nrf2-Keap1 බන්ධනයට බාධා කළ හැකි අතර න්යෂ්ටික Nrf2 හි වැඩි වීමක් ඇති කරයි. p62 Nrf1 සඳහා බන්ධන සාක්කුව අතිච්ඡාදනය කරමින් Keap2 වෙත බැඳෙන අතර p21 Nrf2 හි DLG සහ ETGE මෝස්තර සමඟ සෘජුව අන්තර් ක්රියා කරයි, එමඟින් Keap1 සමඟ තරඟ කරයි.
Fig. 3. පිළිකා වලදී Nrf2 හි න්යෂ්ටික සමුච්චය සඳහා යාන්ත්රණ. (A) Nrf2 හෝ Keap1 හි ඇති සොමැටික් විකෘති මෙම ප්රෝටීන දෙකේ අන්තර් ක්රියාකාරිත්වය කඩාකප්පල් කරයි. Nrf2 හි, විකෘති ETGE සහ DLG ආකෘතීන් කෙරෙහි බලපාන නමුත්, Keap1 හි විකෘති වඩාත් ඒකාකාරව බෙදා හැරේ. තවද, KrasG12D[5] වැනි පිළිකා කාරක සක්රීය කිරීම හෝ PTEN [11] වැනි පිළිකා මර්දන යන්ත්ර කඩාකප්පල් කිරීම Nrf2 හි පිටපත් කිරීමේ ප්රේරණයට සහ න්යෂ්ටික Nrf2 වැඩි වීමට හේතු විය හැක. (B) පෙනහළු සහ පුරස්ථි ග්රන්ථියේ පිළිකා වල Keap1 ප්රවර්ධකයේ හයිපර්මීතයිලීකරණය Keap1 mRNA ප්රකාශනය අඩු කිරීමට මග පාදයි, එය Nrf2 [6], [7] හි න්යෂ්ටික සමුච්චය වැඩි කරයි. (C) පවුලේ පැපිලරි වකුගඩු පිළිකා වලදී, fumarate හයිඩ්රේටේස් එන්සයිම ක්රියාකාරිත්වය නැතිවීම fumarate සමුච්චය වීමට තුඩු දෙන අතර තවදුරටත් Keap1 cysteine අවශේෂ (2SC) උරාබීම දක්වා ගමන් කරයි. මෙම පශ්චාත් පරිවර්තන වෙනස් කිරීම Keap1-Nrf2 අන්තර්ක්රියා කඩාකප්පල් කිරීමට සහ Nrf2 [8], [9] හි න්යෂ්ටික සමුච්චය වීමට හේතු වේ. (D) p62 සහ p21 වැනි කඩාකප්පල්කාරී ප්රෝටීන සමුච්චය වීම Nrf2-Keap1 බන්ධනයට බාධා කළ හැකි අතර න්යෂ්ටික Nrf2 හි වැඩි වීමක් ඇති කරයි. p62 Nrf1 සඳහා බන්ධන සාක්කුව අතිච්ඡාදනය කරමින් Keap2 වෙත බැඳෙන අතර p21 Nrf2 හි DLG සහ ETGE මෝස්තර සමඟ සෘජුව අන්තර් ක්රියා කරයි, එමඟින් Keap1 සමඟ තරඟ කරයි.
පිළිකාවේ Nrf2 සක්රිය කිරීමේ සහ අක්රිය කිරීමේ යාන්ත්රණ
Nrf2 සක්රීය කිරීම මගින් සපයනු ලබන සයිටොප්රොටෙක්ෂන් සාමාන්ය සහ පූර්ව මාරාන්තික පටක වල පිළිකා රසායනික නිවාරණය සඳහා වැදගත් වුවද, සම්පූර්ණයෙන්ම මාරාන්තික සෛල තුළ Nrf2 ක්රියාකාරකම් පිළිකා රසායනික ප්රතිරෝධය වැඩි කිරීමෙන් සහ පිළිකා සෛල වර්ධනය වැඩි කිරීමෙන් වර්ධන වාසිය සපයයි [4]. විවිධ පිළිකා වලදී Nrf2 සංඥා මාර්ගය ව්යුහාත්මකව සක්රිය කර ඇති යාන්ත්රණ කිහිපයක් විස්තර කර ඇත: (1) Keap1 හි සොමැටික් විකෘති හෝ Nrf1 හි Keap2 බන්ධන වසම ඔවුන්ගේ අන්තර්ක්රියාවට බාධා කරයි; (2) Keap1 ප්රකාශනයේ එපිජෙනටික් නිශ්ශබ්ද කිරීම Nrf2 දෝෂ සහිත මර්දනයට මග පාදයි; (3) Keap62-Nrf1 සංකීර්ණය විඝටනය වීමට තුඩු දෙන p2 වැනි බාධාකාරී ප්රෝටීන සමුච්චය වීම; (4) ඔන්කොජනික් K-Ras, B-Raf සහ c-Myc මගින් Nrf2 පිටපත් කිරීමේ ප්රේරණය; සහ (5) ෆුමරේට් හයිඩ්රේටේස් එන්සයිම ක්රියාකාරිත්වය නැතිවීම හේතුවෙන් පවුලේ පැපිලරි වකුගඩු පිළිකාවේදී ඇතිවන සුක්සිනයිලේෂන් මගින් Keap1 cysteines පශ්චාත් පරිවර්තන වෙනස් කිරීම [3], [4], [5], [6], [7], [ 8], [9], [10] (රූපය 3). ව්යවස්ථාපිතව බහුල Nrf2 ප්රෝටීන් ඖෂධ පරිවෘත්තීය ක්රියාවලියට සම්බන්ධ ජානවල ප්රකාශනය වැඩි කිරීමට හේතු වන අතර එමඟින් රසායනික චිකිත්සක ඖෂධ සහ විකිරණ ප්රතිකාර සඳහා ප්රතිරෝධය වැඩි කරයි. මීට අමතරව, ඉහළ Nrf2 ප්රෝටීන් මට්ටම පිළිකා වල දුර්වල පුරෝකථනය සමඟ සම්බන්ධ වේ [4]. අධි ක්රියාකාරී Nrf2 සෛල ප්රගුණනයට බලපාන්නේ ග්ලූකෝස් සහ ග්ලූටමින් ඇනොබලික් මාර්ග දෙසට යොමු කිරීමෙන් පියුරීන් සංස්ලේෂණය වැඩි කිරීම සහ සෛල ප්රගුණනය ප්රවර්ධනය කිරීම සඳහා පෙන්ටෝස් පොස්පේට් මාර්ගයට බලපෑම් කිරීම [11] (රූපය 4).
 Fig. 4. tumorigenesis හි Nrf2 ද්විත්ව භූමිකාව. කායික තත්ත්වයන් යටතේ, න්යෂ්ටික Nrf2 අඩු මට්ටම් සෛලීය හෝමියස්ටැසිස් නඩත්තු කිරීම සඳහා ප්රමාණවත් වේ. Nrf2 පිළිකා කාරක, ROS සහ අනෙකුත් DNA-හානිකර නියෝජිතයන් ඉවත් කිරීමෙන් ගෙඩියක් ආරම්භ කිරීම සහ පිළිකා පරිවෘත්තීය වීම වළක්වයි. පිළිකා උත්පාදනය අතරතුර, DNA හානි සමුච්චය වීම Nrf2 හි සංඝටක අධි ක්රියාකාරීත්වයට මග පාදයි, එය ස්වයංක්රීය මාරාන්තික සෛල වලට ඉහළ මට්ටමේ අන්තරාසර්ග ROS දරා ගැනීමට සහ ඇපොප්ටෝසිස් වළක්වා ගැනීමට උපකාරී වේ. පරිවෘත්තීය ප්රතික්රමලේඛනයට සහ වැඩි දියුණු කළ සෛල ප්රගුණනයට දායක වන සයිටොප්රොටෙක්ටිව් ජානවලට අමතරව නොකඩවා ඉහළ යන න්යෂ්ටික Nrf2 මට්ටම් පරිවෘත්තීය ජාන සක්රීය කරයි. ඉහළ Nrf2 මට්ටම් සහිත පිළිකා, ගුවන්විදුලිය සහ රසායනික ප්රතිරෝධය සහ ආක්රමණශීලී පිළිකා සෛල ප්රගුණනය හේතුවෙන් දුර්වල පුරෝකථනය සමඟ සම්බන්ධ වේ. මේ අනුව, Nrf2 මාර්ග ක්රියාකාරිත්වය tumorigenesis හි මුල් අවධියේදී ආරක්ෂාකාරී වන නමුත් පසුකාලීන අවස්ථා වලදී හානිකර වේ. එබැවින්, පිළිකා වැළැක්වීම සඳහා, Nrf2 ක්රියාකාරකම් වැඩි දියුණු කිරීම වැදගත් ප්රවේශයක් වන අතර, පිළිකා ප්රතිකාර සඳහා, Nrf2 නිෂේධනය කිරීම යෝග්ය වේ [4], [11].
Fig. 4. tumorigenesis හි Nrf2 ද්විත්ව භූමිකාව. කායික තත්ත්වයන් යටතේ, න්යෂ්ටික Nrf2 අඩු මට්ටම් සෛලීය හෝමියස්ටැසිස් නඩත්තු කිරීම සඳහා ප්රමාණවත් වේ. Nrf2 පිළිකා කාරක, ROS සහ අනෙකුත් DNA-හානිකර නියෝජිතයන් ඉවත් කිරීමෙන් ගෙඩියක් ආරම්භ කිරීම සහ පිළිකා පරිවෘත්තීය වීම වළක්වයි. පිළිකා උත්පාදනය අතරතුර, DNA හානි සමුච්චය වීම Nrf2 හි සංඝටක අධි ක්රියාකාරීත්වයට මග පාදයි, එය ස්වයංක්රීය මාරාන්තික සෛල වලට ඉහළ මට්ටමේ අන්තරාසර්ග ROS දරා ගැනීමට සහ ඇපොප්ටෝසිස් වළක්වා ගැනීමට උපකාරී වේ. පරිවෘත්තීය ප්රතික්රමලේඛනයට සහ වැඩි දියුණු කළ සෛල ප්රගුණනයට දායක වන සයිටොප්රොටෙක්ටිව් ජානවලට අමතරව නොකඩවා ඉහළ යන න්යෂ්ටික Nrf2 මට්ටම් පරිවෘත්තීය ජාන සක්රීය කරයි. ඉහළ Nrf2 මට්ටම් සහිත පිළිකා, ගුවන්විදුලිය සහ රසායනික ප්රතිරෝධය සහ ආක්රමණශීලී පිළිකා සෛල ප්රගුණනය හේතුවෙන් දුර්වල පුරෝකථනය සමඟ සම්බන්ධ වේ. මේ අනුව, Nrf2 මාර්ග ක්රියාකාරිත්වය tumorigenesis හි මුල් අවධියේදී ආරක්ෂාකාරී වන නමුත් පසුකාලීන අවස්ථා වලදී හානිකර වේ. එබැවින්, පිළිකා වැළැක්වීම සඳහා, Nrf2 ක්රියාකාරකම් වැඩි දියුණු කිරීම වැදගත් ප්රවේශයක් වන අතර, පිළිකා ප්රතිකාර සඳහා, Nrf2 නිෂේධනය කිරීම යෝග්ය වේ [4], [11].
අහිතකර ප්රතිඵල සහිත පිළිකා සෛලවල ඉහළ Nrf2 ක්රියාකාරකම් බහුලව සිදුවන බැවින්, Nrf2 වැළැක්වීම සඳහා ප්රතිකාර ක්රම අවශ්ය වේ. අවාසනාවකට මෙන්, වෙනත් සමහර bZip පවුලේ සාමාජිකයන් සමඟ ව්යුහාත්මක සමානකම් හේතුවෙන්, විශේෂිත Nrf2 නිෂේධක සංවර්ධනය කිරීම අභියෝගාත්මක කාර්යයක් වන අතර Nrf2 නිෂේධනය පිළිබඳ අධ්යයනයන් කිහිපයක් පමණක් අද දක්වා ප්රකාශයට පත් කර ඇත. ස්වභාවික නිෂ්පාදන පරීක්ෂා කිරීමෙන්, Ren et al. [12] සිස්ප්ලැටින් වල රසායනික චිකිත්සක කාර්යක්ෂමතාව වැඩි කරන Nrf2 නිෂේධකයක් ලෙස ප්රතිනියෝප්ලාස්ටික් සංයෝගයක් බෲසැටෝල් හඳුනාගෙන ඇත. මීට අමතරව, PI3K inhibitors [11], [13] සහ Nrf2 siRNA [14] පිළිකා සෛල තුළ Nrf2 වැළැක්වීම සඳහා භාවිතා කර ඇත. මෑතකදී, අපි ඉහළ Nrf2 මට්ටම් සහිත පිළිකා සෛල ඉලක්ක කර ගැනීම සඳහා පිළිකා සියදිවි නසාගැනීමේ ජාන චිකිත්සාව ලෙස හඳුන්වන විකල්ප ප්රවේශයක් භාවිතා කර ඇත. තයිමිඩින් කයිනේස් (TK) අඩංගු Nrf2-ධාවනය කරන ලද ලෙන්ටිවෛරස් වාහකයන් [15] ඉහළ ARE ක්රියාකාරීත්වයක් සහිත පිළිකා සෛල වෙත මාරු කරනු ලබන අතර සෛලවලට ගැති ඖෂධයක් වන ganciclovir (GCV) සමඟ ප්රතිකාර කරනු ලැබේ. GCV GCV-monophosphate බවට පරිවෘත්තීය වේ, එය සෛලීය කයිනේස් මගින් විෂ සහිත ට්රයිපොස්පේට් ආකාරයක් බවට තවදුරටත් පොස්පරීකරණය කරයි [16] (රූපය 5). මෙය පිළිකා සෛල අඩංගු TK පමණක් නොව, නරඹන්නන්ගේ බලපෑම හේතුවෙන් අසල්වැසි සෛල ද ඵලදායී ලෙස මරා දැමීමට හේතු වේ [17]. ARE-නියාමනය කරන ලද TK/GCV ජාන ප්රතිකාරය පිළිකා රසායනික චිකිත්සක කාරක ඩොක්සොරුබිසින් ප්රතිකාරයට [16] ඒකාබද්ධ කිරීම හරහා තවදුරටත් වැඩිදියුණු කළ හැකි අතර, මෙම ප්රවේශය සාම්ප්රදායික ප්රතිකාර සමඟ ඒකාබද්ධව ප්රයෝජනවත් විය හැකිය යන අදහසට සහාය වේ.
 රූපය 5. සියදිවි නසාගැනීම් ජාන චිකිත්සාව. පිළිකා සෛල තුළ Nrf2 න්යෂ්ටික සමුච්චය වීම පිළිකා සියදිවි නසාගැනීමේ ජාන ප්රතිකාරය සඳහා Nrf2-ධාවනය කරන වෛරස් දෛශිකය භාවිතා කිරීමෙන් ප්රයෝජන ගත හැක [16]. මෙම ප්රවේශයේදී, ARE හතරක් සහිත අවම SV40 ප්රවර්ධකයක් යටතේ තයිමිඩින් කයිනේස් (TK) ප්රකාශ කරන ලෙන්ටිවෛරස් දෛශිකය (LV) පෙනහළු ඇඩිනොකාර්සිනෝමා සෛල වෙත සම්ප්රේෂණය වේ. ඉහළ න්යෂ්ටික Nrf2 මට්ටම් Nrf2 බන්ධනය හරහා TK හි ශක්තිමත් ප්රකාශනයට මග පාදයි. සෛල පසුව TK මගින් පොස්පරීකරණය කරන ලද ගැන්සික්ලොවර් (GCV) ඖෂධයට ප්රතිකාර කරයි. ට්රයිෆොස්ෆොරයිලේටඩ් GCV DNA සංශ්ලේෂණය කඩාකප්පල් කරන අතර නරඹන්නන්ගේ බලපෑම හේතුවෙන් TK අඩංගු පිළිකා සෛල පමණක් නොව අසල්වැසි සෛල ද ඵලදායී ලෙස මරා දමයි.
රූපය 5. සියදිවි නසාගැනීම් ජාන චිකිත්සාව. පිළිකා සෛල තුළ Nrf2 න්යෂ්ටික සමුච්චය වීම පිළිකා සියදිවි නසාගැනීමේ ජාන ප්රතිකාරය සඳහා Nrf2-ධාවනය කරන වෛරස් දෛශිකය භාවිතා කිරීමෙන් ප්රයෝජන ගත හැක [16]. මෙම ප්රවේශයේදී, ARE හතරක් සහිත අවම SV40 ප්රවර්ධකයක් යටතේ තයිමිඩින් කයිනේස් (TK) ප්රකාශ කරන ලෙන්ටිවෛරස් දෛශිකය (LV) පෙනහළු ඇඩිනොකාර්සිනෝමා සෛල වෙත සම්ප්රේෂණය වේ. ඉහළ න්යෂ්ටික Nrf2 මට්ටම් Nrf2 බන්ධනය හරහා TK හි ශක්තිමත් ප්රකාශනයට මග පාදයි. සෛල පසුව TK මගින් පොස්පරීකරණය කරන ලද ගැන්සික්ලොවර් (GCV) ඖෂධයට ප්රතිකාර කරයි. ට්රයිෆොස්ෆොරයිලේටඩ් GCV DNA සංශ්ලේෂණය කඩාකප්පල් කරන අතර නරඹන්නන්ගේ බලපෑම හේතුවෙන් TK අඩංගු පිළිකා සෛල පමණක් නොව අසල්වැසි සෛල ද ඵලදායී ලෙස මරා දමයි.

Nrf2 යනු ප්රධාන නියාමකයක් වන අතර එය ඔක්සිකාරක ආතතිය තුරන් කිරීමට උපකාරී වන මිනිස් සිරුරේ ප්රබල ප්රතිඔක්සිකාරක නිෂ්පාදනය අවුලුවන. සුපර් ඔක්සයිඩ් ඩිස්මියුටේස්, හෝ SOD, ග්ලූටතයෝන් සහ කැටලේස් වැනි විවිධ ප්රතිඔක්සිකාරක එන්සයිම ද Nrf2 මාර්ගය හරහා ක්රියාත්මක වේ. තවද, කහ, අශ්වගන්ධ, බැකෝපා, හරිත තේ සහ කිරි thistle වැනි ඇතැම් ශාක රසායනික ද්රව්ය Nrf2 සක්රීය කරයි. ඒ බව පර්යේෂණ අධ්යයනවලින් සොයාගෙන ඇත Nrf2 සක්රිය කිරීම ස්වාභාවිකවම සෛලීය ආරක්ෂාව වැඩි දියුණු කළ හැකි අතර මිනිස් සිරුරේ සමතුලිතතාවය යථා තත්වයට පත් කළ හැකිය.
ආචාර්ය ඇලෙක්ස් ජිමිනෙස් ඩීසී, සීසීඑස්ටී ඉන්සයිට්
සල්ෆෝරාපේන් සහ පිළිකා, මරණ, වයස්ගත වීම, මොළය සහ හැසිරීම, හෘද රෝග සහ තවත් දේ කෙරෙහි එහි බලපෑම්
Isothiocyanates යනු ඔබේ ආහාර වේලට ලබා ගත හැකි වැදගත්ම ශාක සංයෝග කිහිපයකි. මෙම වීඩියෝවෙන් මම ඔවුන් සඳහා මෙතෙක් කර ඇති වඩාත්ම සවිස්තරාත්මක නඩුව ඉදිරිපත් කරමි. කෙටි අවධානයක්? පහත කාල ලක්ෂ්යවලින් එකක් ක්ලික් කිරීමෙන් ඔබේ ප්රියතම මාතෘකාව වෙත යන්න. සම්පූර්ණ කාලසටහන පහතින්.
ප්රධාන කොටස්:
- 00:01:14 - පිළිකා සහ මරණ
- 00:19:04 - වයසට යාම
- 00:26:30 - මොළය සහ හැසිරීම
- 00:38:06 - අවසාන නැවත බැලීම
- 00:40:27 - මාත්රාව
සම්පූර්ණ කාලරේඛාව:
- 00:00:34 - වීඩියෝවේ ප්රධාන අවධානයක් වන සල්ෆෝරාපේන් හඳුන්වාදීම.
- 00:01:14 - කුරුස එළවළු පරිභෝජනය සහ සියලු හේතු මරණ අනුපාතය අඩු කිරීම.
- 00:02:12 - පුරස්ථි පිළිකා අවදානම.
- 00:02:23 - මුත්රාශයේ පිළිකා අවදානම.
- 00:02:34 - දුම් පානය කරන්නන්ගේ පෙනහළු පිළිකා අවදානම.
- 00:02:48 - පියයුරු පිළිකා අවදානම.
- 00:03:13 - උපකල්පිත: ඔබට දැනටමත් පිළිකාවක් ඇත්නම් කුමක් කළ යුතුද? (මැදිහත්වීමේ)
- 00:03:35 - පිළිකා සහ මරණ අනුබද්ධ දත්ත මෙහෙයවන පිළිගත හැකි යාන්ත්රණය.
- 00:04:38 - Sulforaphane සහ පිළිකා.
- 00:05:32 - මීයන්ගේ මුත්රාශයේ ගෙඩි වර්ධනයට බ්රොකොලි පැළ නිස්සාරණයේ ප්රබල බලපෑමක් පෙන්නුම් කරන සත්ව සාක්ෂි.
- 00:06:06 - පුරස්ථි ග්රන්ථියේ පිළිකා රෝගීන් සඳහා සල්ෆෝරාපේන් සෘජුවම ලබා දීමේ බලපෑම.
- 00:07:09 - සැබෑ පියයුරු පටක වල isothiocyanate පරිවෘත්තීය ජෛව සමුච්චනය.
- 00:08:32 - පියයුරු පිළිකා ප්රාථමික සෛල නිෂේධනය කිරීම.
- 00:08:53 - ඉතිහාස පාඩම: පුරාණ රෝමයේ පවා බ්රැසිකා සෞඛ්ය ගුණාංග ඇති බව තහවුරු විය.
- 00:09:16 - පිළිකා කාරක බැහැර කිරීම (බෙන්සීන්, ඇක්රොලීන්) වැඩි දියුණු කිරීමට සල්ෆෝරාපේන්ගේ හැකියාව.
- 00:09:51 - NRF2 ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්ය හරහා ජානමය ස්විචයක් ලෙස.
- 00:10:10 - NRF2 සක්රිය කිරීම glutathione-S-conjugates හරහා පිළිකා කාරක පිටකිරීම වැඩි දියුණු කරන ආකාරය.
- 00:10:34 - Brussels sprouts glutathione-S-transferase වැඩි කරන අතර DNA හානි අඩු කරයි.
- 00:11:20 - Broccoli sprout පානය බෙන්සීන් බැහැර කිරීම 61% කින් වැඩි කරයි.
- 00:13:31 – Broccoli sprout homogenate ඉහළ ශ්වසන මාර්ගයේ ප්රතිඔක්සිකාරක එන්සයිම වැඩි කරයි.
- 00:15:45 - කුරුස එළවළු පරිභෝජනය සහ හෘද රෝග මරණ.
- 00:16:55 - බ්රොකොලි පැළ කුඩු 2 වර්ගයේ දියවැඩියා රෝගීන්ගේ රුධිර ලිපිඩ සහ සමස්ත හෘද රෝග අවදානම වැඩි දියුණු කරයි.
- 00:19:04 - වයසට යාමේ අංශයේ ආරම්භය.
- 00:19:21 - සල්ෆෝරාපේන් බහුල ආහාර කුරුමිණියන්ගේ ආයු කාලය 15 සිට 30% දක්වා වැඩි කරයි (ඇතැම් තත්වයන් යටතේ).
- 00:20:34 - දිගුකාලීන පැවැත්ම සඳහා අඩු දැවිල්ලක වැදගත්කම.
- 00:22:05 - කුරුස එළවළු සහ බ්රොකොලි පැළ කුඩු මිනිසුන් තුළ විවිධාකාර ගිනි අවුලුවන සලකුණු අඩු කරන බව පෙනේ.
- 00:23:40 - මැද-වීඩියෝ නැවත බැලීම: පිළිකා, වයස්ගත කොටස්
- 00:24:14 - මවුස් අධ්යයනයන් යෝජනා කරන්නේ සල්ෆෝරාපේන් මහලු වියේදී අනුවර්තන ප්රතිශක්තිකරණ ක්රියාකාරිත්වය වැඩි දියුණු කළ හැකි බවයි.
- 00:25:18 - සල්ෆෝරාපේන් තට්ටය දැමීමේ මූසික ආකෘතියක හිසකෙස් වර්ධනය වැඩි දියුණු කළේය. පින්තූරය 00:26:10 ට.
- 00:26:30 - මොළයේ සහ හැසිරීම් අංශයේ ආරම්භය.
- 00:27:18 - ඔටිසම් මත බ්රොකොලි පැළ සාරය බලපෑම.
- 00:27:48 - භින්නෝන්මාදය මත ග්ලූකෝරෆනින් වල බලපෑම.
- 00:28:17 - අවපාත සාකච්ඡාවේ ආරම්භය (පිළිගත හැකි යාන්ත්රණය සහ අධ්යයන).
- 00:31:21 – ආතති-ප්රේරිත මානසික අවපීඩනයේ විවිධ මාදිලි 10 ක් භාවිතා කරමින් මූසික අධ්යයනය සල්ෆෝරාපේන් ෆ්ලෝක්සෙටීන් (ප්රෝසාක්) හා සමානව ඵලදායී බව පෙන්වයි.
- 00:32:00 - අධ්යයනයෙන් පෙන්නුම් කරන්නේ මීයන් තුළ ග්ලූකෝරෆනින් සෘජුවම ශරීරගත වීම සමාජ පරාජයේ ආතති ආකෘතියෙන් මානසික අවපීඩනය වැළැක්වීමට සමානව ඵලදායී බවයි.
- 00:33:01 - neurodegeneration අංශයේ ආරම්භය.
- 00:33:30 - සල්ෆෝරාපේන් සහ ඇල්සයිමර් රෝගය.
- 00:33:44 - සල්ෆෝරාපේන් සහ පාකින්සන් රෝගය.
- 00:33:51 - Sulforaphane සහ Hungtington's රෝගය.
- 00:34:13 - Sulforaphane තාප කම්පන ප්රෝටීන වැඩි කරයි.
- 00:34:43 - කම්පන සහගත මොළයේ තුවාල අංශයේ ආරම්භය.
- 00:35:01 - TBI මතකය වැඩි දියුණු කළ වහාම Sulforaphane එන්නත් කිරීම (මූසික අධ්යයනය).
- 00:35:55 - Sulforaphane සහ නියුරෝන ප්ලාස්ටික්.
- 00:36:32 - සල්ෆෝරාපේන් මීයන් තුළ II වර්ගයේ දියවැඩියා ආකෘතියේ ඉගෙනීම වැඩි දියුණු කරයි.
- 00:37:19 - Sulforaphane සහ duchenne මස්කියුලර් ඩිස්ට්රොෆි.
- 00:37:44 - මාංශ පේශි චන්ද්රිකා සෛලවල Myostatin නිෂේධනය (in vitro).
- 00:38:06 - ප්රමාද වීඩියෝ පුනරුච්චාරණය: මරණ සහ පිළිකා, DNA හානි, ඔක්සිකාරක ආතතිය සහ දැවිල්ල, බෙන්සීන් බැහැර කිරීම, හෘද වාහිනී රෝග, දෙවන වර්ගයේ දියවැඩියාව, මොළයට බලපෑම් (මානසික අවපීඩනය, ඔටිසම්, භින්නෝන්මාදය, ස්නායු විකෘති වීම), NRF2 මාර්ගය.
- 00:40:27 - බ්රොකොලි පැළ හෝ සල්ෆෝරාපේන් මාත්රාවක් සොයා ගැනීම පිළිබඳ සිතුවිලි.
- 00:41:01 - නිවසේ පැළවීම පිළිබඳ කථා.
- 00:43:14 - පිසීමේ උෂ්ණත්වය සහ සල්ෆෝරාපේන් ක්රියාකාරිත්වය මත.
- 00:43:45 - ග්ලූකෝරෆනින් වලින් සල්ෆෝරාපේන් බඩවැල් බැක්ටීරියාව පරිවර්තනය කිරීම.
- 00:44:24 - එළවළු වලින් සක්රීය මයිරොසිනේස් සමඟ සංයෝජිතව ඇති විට අතිරේක හොඳින් ක්රියා කරයි.
- 00:44:56 - පිසීමේ ශිල්පීය ක්රම සහ කුරුස එළවළු.
- 00:46:06 - Goitrogens ලෙස Isothiocyanates.
අනුමත කර
මෙම කාර්යයට ෆින්ලන්ත ඇකඩමිය, සිග්රිඩ් ජුසේලියස් පදනම සහ ෆින්ලන්ත පිළිකා සංවිධාන විසින් සහාය දක්වන ලදී.
අවසාන වශයෙන්, න්යෂ්ටික සාධකය (එරිත්රොයිඩ් ව්යුත්පන්න 2) වැනි 2, NFE2L2 හෝ Nrf2 ලෙසද හැඳින්වේ, ඔක්සිකාරක ආතතියෙන් මිනිස් සිරුර ආරක්ෂා කරන ප්රතිඔක්සිකාරක නිෂ්පාදනය වැඩි කරන ප්රෝටීනයකි. ඉහත විස්තර කර ඇති පරිදි, පිළිකා ඇතුළු ඔක්සිකාරක ආතතිය නිසා ඇති වන රෝග සඳහා ප්රතිකාර කිරීම සඳහා Nrf2 මාර්ගය උත්තේජනය කිරීම අධ්යයනය කෙරේ. අපගේ තොරතුරු වල විෂය පථය චිරොක්ට්රැක්ටික් සහ කොඳු ඇට පෙළේ සෞඛ්ය ගැටළු වලට සීමා වේ. විෂය කරුණු සාකච්ඡා කිරීමට, කරුණාකර වෛද්ය ජිමිනෙස්ගෙන් විමසීමට හෝ අපව අමතන්න915-850-0900 .
ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස් විසින් පාලනය කරන ලදී
යොමු කර ඇත්තේ:Sciencedirect.com
අතිරේක මාතෘකා සාකච්ඡාව: ශල්යකර්මයකින් තොරව දණහිසේ වේදනාව සමනය කිරීම
දණහිසේ වේදනාව යනු දණහිස් තුවාල සහ/හෝ විවිධ තත්වයන් නිසා ඇතිවිය හැකි ප්රසිද්ධ රෝග ලක්ෂණයකි.ක්රීඩා තුවාල ලබා ඇත. දණහිස මිනිස් සිරුරේ වඩාත් සංකීර්ණ සන්ධිවලින් එකකි, එය අස්ථි හතරක්, බන්ධන හතරක්, විවිධ කණ්ඩරාවන්, මෙනිස්කි දෙකක් සහ කාටිලේජවල ඡේදනය වීමෙන් සෑදී ඇත. පවුලේ වෛද්යවරුන්ගේ ඇමරිකානු ඇකඩමියට අනුව, දණහිසේ වේදනාවට වඩාත් පොදු හේතු වන්නේ පැටලර් උපලුක්සේෂන්, පැටලර් ටෙන්ඩිනයිටිස් හෝ ජම්පර්ගේ දණහිස සහ ඔස්ගුඩ්-ෂ්ලැටර් රෝගයයි. දණහිස් වේදනාව බොහෝ විට අවුරුදු 60 ට වැඩි පුද්ගලයින් තුළ ඇති වුවද, දණහිසේ වේදනාව ළමුන් හා නව යොවුන් වියේ දී ද ඇති විය හැක. දණහිසේ වේදනාව RICE ක්රම අනුගමනය කරමින් නිවසේදී ප්රතිකාර කළ හැක, කෙසේ වෙතත්, දරුණු දණහිස් තුවාල සඳහා චිරොක්ට්රැක්ටික් ප්රතිකාර ඇතුළුව වහාම වෛද්ය ප්රතිකාර අවශ්ය විය හැකිය.
***

by ආචාර්ය ඇලෙක්ස් ජිමිනෙස් | ක්රියාකාරී වෛද්ය විද්යාව, සෞඛ්යය, ස්වභාවික සෞඛ්යය, පෝෂණ, ඔක්සිකාරක ආතතිය, පිළියම්, ප්රතිකාර, සුවතාව
DNA දළ වශයෙන් ජාන 20,000කට සහය දක්වන අතර, ඒ සෑම එකක්ම සෞඛ්ය සම්පන්න ජීවන රටාවකට අවශ්ය ප්රෝටීනයක් හෝ එන්සයිමයක් සෑදීම සඳහා වැඩසටහනක් පවත්වයි. මෙම සෑම රටාවක්ම "ප්රවර්ධකයෙකු" විසින් නිරන්තරයෙන් නියාමනය කළ යුතු අතර එමඟින් එක් එක් ද්රව්ය සහ/හෝ රසායනිකයන් කොපමණ ප්රමාණයක් ජනනය වන්නේද සහ කුමන තත්වයන් යටතේද මේවා වර්ධනය වන්නේද යන්න නිවැරදිව කළමනාකරණය කරයි.
ප්රතිඔක්සිකාරක ප්රතිචාර මූලද්රව්යය, හෝ ARE ලෙස හඳුන්වන ස්විචයක් වැනි ප්රවර්ධක ප්රදේශ වල විශේෂිත වර්ගයකට සම්බන්ධ කිරීමෙන් Nrf2 සාධකයආතති තත්වයන් යටතේ සෛල වලට නොනැසී පැවතීමට හැකි වන පරිදි වෙනස් ජාන සිය ගණනක් සඳහා නිර්මාණය කිරීමේ වේගයට සහාය වේ. මෙම ජාන පසුව ප්රතිඔක්සිකාරක එන්සයිම තෝරා ගැනීමක් උත්පාදනය කරන අතර එමඟින් ඔක්සිකාරක උදාසීන කිරීමෙන් සහ ඒවායේ නිෂ්පාදනයේ ඉතිරිව ඇති විෂ සහිත අතුරු නිෂ්පාදන පිරිසිදු කිරීමෙන් ආරක්ෂක ජාලයක් වර්ධනය කරයි, ඊට අමතරව ඒවායින් ඇති වූ හානිය යථා තත්ත්වයට පත් කිරීමට උපකාරී වේ.
ඔක්සිකාරක ආතතිය යනු කුමක්ද?
සුපර් ඔක්සයිඩ් රැඩිකල්, හෝ O2-., සහ හයිඩ්රජන් පෙරොක්සයිඩ්, හෝ H2O2 වැනි ඔක්සිකාරක කිහිපයක් නිර්මාණය වී ඇත්තේ මිනිස් සිරුරට ඔරොත්තු දෙන ද්රව්ය සහ/හෝ රසායනික ද්රව්ය දහනය කිරීමේ පුරුද්දෙනි. මිනිස් සිරුරේ ප්රතිඔක්සිකාරක එන්සයිම අඩංගු වන අතර එය අප පරිභෝජනය කරන ප්රතික්රියාශීලී ආහාර සහ පාන වර්ග උදාසීන කර විෂහරණය කරයි. Nrf2 සමතුලිතතාවය පවත්වා ගැනීම සඳහා ඔවුන්ගේ නිෂ්පාදනය මොඩියුලේට් කරන අතර මෙම සියලු එන්සයිම සඳහා ඇති ඉල්ලුම අවධාරනය කරයි. මෙම සමතුලිතතාවය වයස ඇතුළුව සාධක කිහිපයක් මගින් බාධා කළ හැකිය.
අප වයසට යන විට, මිනිස් සිරුර අඩු Nrf2 නිර්මාණය කරන අතර මෙම සියුම් සමතුලිතතාවය ක්රමයෙන් ඔක්සිකාරක පැත්තට හැරවීමට පටන් ගනී, එය ඔක්සිකාරක ආතතිය ලෙස හැඳින්වේ. රෝග ඔක්සිකාරක අධික ලෙස නිපදවීමට ද හේතු විය හැක. ආසාදන, අසාත්මිකතා සහ ස්වයං ප්රතිශක්තිකරණ ආබාධවලට අමතරව O2- වැනි ප්රතික්රියාශීලී ඔක්සිකාරක සෑදීමට අපගේ ප්රතිශක්තිකරණ සෛල අවුලුවාලිය හැක. , H2O2, OH සහ HOCl, එහිදී නිරෝගී සෛල හානි වී දැවිල්ල සමඟ ප්රතිචාර දක්වයි. හෘදයාබාධ, ආඝාතය, පිළිකා සහ ඇල්සයිමර් රෝගය වැනි ස්නායු විකෘති තත්ත්වයන් ඇතුළු වයස්ගත වීම හා සම්බන්ධ රෝග ද ඔක්සිකාරක වර්ධනය, ආතතිය ජනනය කිරීම සහ දැවිල්ල ප්රතිචාර දැක්වීම වැඩි කරයි.
Nrf2 Activators යනු මොනවාද?
Nrf2 ප්රෝටීනය, එන්සයිම සහ ජානවලට සහය වන සහ පාලනය කළ හැකි ආකාරය හේතුවෙන් පිටපත් කිරීමේ සාධකයක් ලෙසද හැඳින්වේ, එය සෛලය තුළ ඇති ජෛව රසායනික ප්රතික්රියා අනුපිළිවෙලක රහස් මූලද්රව්යය වන අතර එය සංජානන සමතුලිතතාවයේ මෙන්ම ඔක්සිකාරක සමතුලිතතාවයේ වෙනස්වීම් වලට ප්රතික්රියා කරයි. මෙම මාර්ගයෙහි සංවේදී මූලද්රව්ය Nrf2 වෙනස් කර විසර්ජනය කරයි, එය ප්රේරණය කිරීම නිසා එය DNA දෙසට සෛලයේ න්යෂ්ටිය තුළට පැතිර යා හැක. Nrf2 මගින් සෛලය ආරක්ෂා කිරීමට සහය දක්වන ජාන සහ එන්සයිම විකල්ප වශයෙන් සක්රිය හෝ අක්රිය කළ හැක.
වාසනාවකට මෙන්, Nrf2 සක්රියකාරක වන විවිධ ද්රව්ය වර්ධනය වන්නේ ශතවර්ෂ ගණනාවකට පෙර චීන සහ ස්වදේශික ඇමරිකානු සාම්ප්රදායික ප්රතිකර්මවල භාවිතා කරන ලද ඇතැම් ශාක හා නිස්සාරණ පරිභෝජනය මගිනි. මෙම ශාක රසායනික ද්රව්ය අද භාවිතා වන Nrf2-සක්රීය ඖෂධ නිෂ්පාදන මෙන් අඩු අතුරු ආබාධ සහිත සමානව බලවත් බව පෙනේ.
න්යෂ්ටික සාධකය එරිත්රොයිඩ් 2-ආශ්රිත සාධකය, සාමාන්යයෙන් Nrf2 ලෙස හැඳින්වේ, ජාන, එන්සයිම සහ ප්රතිඔක්සිකාරක ප්රතිචාර නියාමනය කිරීමෙන් සෛලය ආරක්ෂා කරන පිටපත් කිරීමේ සාධකයකි. පිටපත් කිරීමේ සාධක යනු ග්ලූටතයෝන් එස්-ට්රාන්ස්ෆෙරේස් හෝ ජීඑස්ටී ඇතුළු විශේෂිත ද්රව්ය සහ රසායනික ද්රව්ය නිර්මාණය කිරීම ප්රවර්ධනය කිරීම සඳහා DNA වෙත සම්බන්ධ කරන ප්රෝටීන වර්ගයකි. Nrf2 සක්රීය කිරීම ඔක්සිකාරක ආතතිය අඩු කිරීමට උපකාරී වන ප්රබල ප්රතිඔක්සිකාරක ධාරිතාවක් ප්රදර්ශනය කරන ක්රියාකාරී ප්රෝටීන නිපදවීමට හේතු වේ.
ආචාර්ය ඇලෙක්ස් ජිමිනෙස් ඩීසී, සීසීඑස්ටී ඉන්සයිට්
Nrf2 සක්රීය කිරීම පිටුපස ඇති විද්යාව
2 දී ආරම්භක Nrf2004-සක්රීය ආහාර අතිරේකය නිර්මාණය කළ පසු, Nrf2 මාර්ගයෙහි ක්රියාකාරිත්වය සම්බන්ධයෙන් අවම තොරතුරු දැනගත හැකි විය. න්යෂ්ටික සාධකය වැනි 200 හෝ NFE2L2 ලෙසද හැඳින්වෙන Nrf2 පිළිබඳ සාහිත්යයේ ආසන්න වශයෙන් පුවත්පත් 2 ක් පමණ පැවති අතර පර්යේෂකයන් ක්ෂීරපායින් තුළ Nrf2 හි ප්රතිඔක්සිකාරක ප්රතිචාරය සොයා ගැනීමට පටන් ගත්තා පමණි. කෙසේ වෙතත්, 2017 වන විට, මෙම "ප්රධාන නියාමකය" පිළිබඳ ශාස්ත්රීය පර්යේෂණ අධ්යයන 9,300 කට අධික ප්රමාණයක් මුද්රණය කර ඇත.
යථාර්ථයේ දී, Nrf2 ජාන සමඟ සහසම්බන්ධ නොවන බොහෝ ප්රතිඔක්සිකාරක එන්සයිම නියාමනය කරයි, ඒ වෙනුවට, සෞඛ්ය සම්පන්න සහ ව්යාධි තත්ව යටතේ සෛල, අවයව සහ අවසානයේ ජීවීන් මුහුණ දෙන ආතතියට සම්බන්ධ විවිධ තත්වයන්ට එරෙහිව ආරක්ෂාව සපයයි. ප්රකාශිත ශාස්ත්රීය පර්යේෂණ අධ්යයනයන්හි මෙම නව තොරතුරු ප්රමාණය මත පදනම්ව, පර්යේෂකයන්ට දැන් වඩා හොඳින් වර්ධනය විය හැක Nrf2 ආහාරමය අතිරේක.
2007 වන විට, පර්යේෂණ අධ්යයනයන් මගින් Nrf2 මාර්ගයේ සංකීර්ණ ක්රියාකාරිත්වය පෙන්නුම් කර ඇත. Nrf2 සක්රියකාරක මිනිස් සිරුර තුළ විවිධ ව්යුහයන්ගේ සාධක අනුකරණය කරන බව සොයාගෙන ඇත. මෙම මාර්ග හරහා, සමතුලිතතාවය පවත්වා ගැනීමට සහ ජානවල විකාශනය වන අවශ්යතාවලට ප්රතිචාර දැක්වීම සඳහා සෛලය පුරා වෙනස් වන තත්වයන් දැනීමට Nrf2 සක්රීය කරන්නන් සන්නද්ධ කර ඇත.
Nrf2-සක්රීය කිරීමේ අතිරේක භාවිතා කරන්නේ ඇයි?
Nrf2-සක්රීය කිරීමේ හැකියාව ජීවීන්ගේ වයසත් සමඟ අඩු වන බැවින්, වෙනස්කම් සිදු වීමට පටන් ගත හැකිය. පර්යේෂණ අධ්යයනවලින් පෙන්නුම් කර ඇත්තේ සෛලවල Nrf2 හි අවධානය වයස සමඟ අඩු වන අතර ඔක්සිකාරක ආතතියේ වැඩි සලකුණු පෙන්නුම් කරන බවයි. ධමනි සිහින් වීම සහ හෘද වාහිනී රෝග, ආතරයිටිස්, පිළිකා, තරබාරුකම, දෙවන වර්ගයේ දියවැඩියාව, අධි රුධිර පීඩනය, ඇසේ සුද සහ ඇල්සයිමර් රෝගය මෙන්ම පාකින්සන් රෝග වැනි වයස් ආශ්රිත රෝග ගණනාවක් මෙම වෙනස්කම් හේතුවෙන් වර්ධනය විය හැකිය. මෙම සෞඛ්ය ගැටළු සමඟ ඔක්සිකාරක ආතතිය සොයාගෙන ඇත.
Nrf2 සක්රියකාරක නිෂ්පාදනය වැඩි කිරීමට සෛලයේ ධාරිතාව උත්තේජනය කිරීමෙන්, Nrf2 ආහාරමය අතිරේක ඔක්සිකාරක ආතතියේ බලපෑම් වලට එරෙහි වීමට මිනිස් සිරුරට ඇති හැකියාව නැවත පණ ගැන්වීමට උපකාරී වේ. බහු අසංතෘප්ත මේද අම්ල, හෝ PUFAs, ඉතා පහසුවෙන් ඔක්සිකරණය වන අණු වලින් එකක් වන අතර ඒවා විශේෂයෙන් මුක්ත ඛණ්ඩක වලින් හානි වීමට ගොදුරු වේ. Thiobarbituric අම්ලය, හෝ TBARS, නිෂ්පාදනය වයස සමඟ වැඩි විය හැක, Nrf2-නියාමනය කරන ලද මාර්ගවල පහත වැටීමක් සමඟ ඔක්සිකාරක ආතතිය වැඩි වීම පෙන්නුම් කරයි.
ජීව විද්යාත්මකව, ජාන ප්රේරණය සැබවින්ම මන්දගාමී යාන්ත්රණයකි, සාමාන්යයෙන් මාර්ගයක් හරහා මාරු වීමට පැය ගණනක් අවශ්ය වේ. එහි ප්රතිඵලයක් වශයෙන්, විවිධ නියාමන එන්සයිම මගින් මිනිත්තු කිහිපයකින් ක්රියා විරහිත කළ හැකි බොහෝ එන්සයිමවලට තමන්ගේම සක්රිය/ අක්රිය ස්විච ඇත. පර්යේෂකයන් විසින් Nrf2 සක්රියකාරකවල හිමිකාර සංයුතීන් වර්ධනය කර ඇති අතර ඒවා සක්රීය කිරීමේ මෙම දැනුම පදනම භාවිතා කරයි. Nrf2 සක්රීය කිරීම සමන්විත වන්නේ Nrf2 පිටපත් කිරීමේ සාධකය එහි නිෂේධකයෙන් මුදා හැර සෛල න්යෂ්ටිය වෙත සංක්රමණය වීමෙන් පමණක් නොව, සයිටොප්රොටෙක්ටිව් ජාන ප්රකාශනය දිරිමත් කිරීම සඳහා නිශ්චිත DNA අනුක්රමවලට බැඳී, Nrf2 න්යෂ්ටියෙන් පිටතට ගන්නා වේගය නියාමනය කරයි.
තුරන් කිරීමේ ක්රියා පටිපාටිය සහ මිනිස් සිරුරේ Nrf2 සක්රිය කිරීම අවබෝධ කර ගැනීම, ජානවල ප්රතිබිම්බය එහි මොඩියුලේෂන් හරහා ඉටු කිරීම සඳහා විවිධ Nrf2 සක්රියකාරකවල සංයෝජන ගොඩනැගීමට පර්යේෂකයන්ට ඉඩ ලබා දී ඇත. දැනුම පදනමේ සංකලනය, අනෙකුත් විවිධ පර්යේෂණ අධ්යයනයන් සමඟ එක්ව ආහාරමය අතිරේක ලෙස භාවිතා කිරීම සඳහා Nrf2 සක්රියකාරක නිපදවීමට උපකාරී වී ඇත. අපගේ තොරතුරු වල විෂය පථය චිරොක්ට්රැක්ටික් සහ කොඳු ඇට පෙළේ සෞඛ්ය ගැටළු වලට සීමා වේ. විෂය කරුණු සාකච්ඡා කිරීම සඳහා, කරුණාකර ආචාර්ය ජිමිනෙස්ගෙන් විමසීමට හෝ අපව සම්බන්ධ කර ගන්න915-850-0900 .
ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස් විසින් පාලනය කරන ලදී
අතිරේක මාතෘකා සාකච්ඡාව: ශල්යකර්මයකින් තොරව දණහිසේ වේදනාව සමනය කිරීම
දණහිසේ වේදනාව යනු දණහිස් තුවාල සහ/හෝ විවිධ තත්වයන් නිසා ඇතිවිය හැකි ප්රසිද්ධ රෝග ලක්ෂණයකි.ක්රීඩා තුවාල ලබා ඇත. දණහිස මිනිස් සිරුරේ වඩාත් සංකීර්ණ සන්ධිවලින් එකකි, එය අස්ථි හතරක්, බන්ධන හතරක්, විවිධ කණ්ඩරාවන්, මෙනිස්කි දෙකක් සහ කාටිලේජවල ඡේදනය වීමෙන් සෑදී ඇත. පවුලේ වෛද්යවරුන්ගේ ඇමරිකානු ඇකඩමියට අනුව, දණහිසේ වේදනාවට වඩාත් පොදු හේතු වන්නේ පැටලර් උපලුක්සේෂන්, පැටලර් ටෙන්ඩිනයිටිස් හෝ ජම්පර්ගේ දණහිස සහ ඔස්ගුඩ්-ෂ්ලැටර් රෝගයයි. දණහිස් වේදනාව බොහෝ විට අවුරුදු 60 ට වැඩි පුද්ගලයින් තුළ ඇති වුවද, දණහිසේ වේදනාව ළමුන් හා නව යොවුන් වියේ දී ද ඇති විය හැක. දණහිසේ වේදනාව RICE ක්රම අනුගමනය කරමින් නිවසේදී ප්රතිකාර කළ හැක, කෙසේ වෙතත්, දරුණු දණහිස් තුවාල සඳහා චිරොක්ට්රැක්ටික් ප්රතිකාර ඇතුළුව වහාම වෛද්ය ප්රතිකාර අවශ්ය විය හැකිය.
***
by ආචාර්ය ඇලෙක්ස් ජිමිනෙස් | චිකෝාපැක්, පෝෂණ, ඔක්සිකාරක ආතතිය, පර්යේෂණ අධ්යයන, ප්රතිකාර
ප්රතිඔක්සිකාරක විද්යාත්මකව මිනිස් සිරුරේ ඔක්සිකරණ ක්රියාවලිය සීමා කරන සංයෝග ලෙස හඳුන්වනු ලබන අතර, එය පාලනය නොකළහොත්, සෛලීය හානි ඇති කළ හැකි දාම ප්රතික්රියා ගණනාවක් වර්ධනය කළ හැකි නිදහස් රැඩිකලුන් නිර්මාණය කළ හැකිය. වාසනාවකට මෙන්, මිනිස් සිරුරට එවැනි බිල්ට් ප්රතිශක්තිකරණ යාන්ත්රණයක් නිර්මාණය කළ හැකිය, කෙසේ වෙතත්, ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ හෝ ROS සවි කිරීමට නොහැකි වූ විට, ඔක්සිජන් සමඟ පුරවන විට පාලනයෙන් තොර කුඩා දැල්ලක් ගැන සිතන්න, හානියක් සිදුවනු ඇත. .
දැල්ලෙහි රූපකය දිගට දිගට ප්රසාරණය කිරීම සඳහා, ROS හෝ ප්රතික්රියාශීලී ඔක්සිජන් විශේෂවල බලපෑම උදාසීන කිරීමට හැකියාවක් නොමැති වීමේ අවසාන නිෂ්පාදනය වන්නේ හානිය මෙන්ම දැවිල්ලයි, වෙනත් වචන වලින් කිවහොත්, මිනිස් සිරුර වචනාර්ථයෙන් ගිනි ගනී. විශ්මයජනක දෙය නම් මෙම සෞඛ්ය ගැටලුවට එරෙහිව සටන් කිරීමට ඉමහත් ලෙස උපකාරී වන ප්රතිඔක්සිකාරක ඇති අතර මෙම ප්රතිඔක්සිකාරකය ග්ලූටතයෝන් වේ. 1889 දී සොයාගත් නමුත් ග්ලූටතයෝන්ගේ ප්රතිඔක්සිකාරක බලපෑම නවීන පර්යේෂණ අධ්යයනයන්හි වඩාත් සිත්ගන්නා මාතෘකාවක් බවට පත්ව ඇත.
ප්රතිඔක්සිකාරක වල ප්රධානියා: ග්ලූටතයෝන්
ප්රබල ද්රව්ය වන්නේ සිස්ටීන්, ග්ලූටමික් අම්ලය සහ ග්ලයිසීන් වලින් වර්ධනය වන ට්රයිපෙප්ටයිඩයකි. නිදහස් රැඩිකලුන් සෑදීමට එරෙහිව මිනිස් සිරුර ආරක්ෂා කිරීමට ඇති හැකියාව නිසා ග්ලූටතයෝන් අවසානයේ නිරෝගී ප්රතිශක්තිකරණ පද්ධතියක් ප්රවර්ධනය කිරීමට උපකාරී වේ. මත පදනම්ව 2015 දී විද්යාත්මක වාර්තා, පෙරොක්සිරෙඩින් සහ කැටලේස් සමඟ සහයෝගීව ක්රියා කිරීමට ග්ලූටතයෝන්ගේ හැකියාව හයිඩ්රජන් පෙරොක්සයිඩ් වලට එරෙහිව සෛල ආරක්ෂා කිරීමට උපකාරී වන බව තීරණය විය. මෙම සහයෝගීතා සූත්රය ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ හෝ ROS වලට එරෙහිව ක්රියා කරයි. ග්ලූටතයෝන්, පෙරොක්සිඩ්රෙඩින් සහ කැටලේස් යනු සෞඛ්ය සම්පන්න සෛල, පටක සහ අවයවවල අත්යවශ්ය ක්රියාවලියක් වන සෛලීය හෝමියස්ටැසිස් වැඩි කිරීම සඳහා අත්යවශ්ය මූලද්රව්ය වේ.
මීට අමතරව, ග්ලූටතයෝන් සමස්ත ප්රතිශක්තිකරණ පද්ධතියේ ව්යුහය සහ ක්රියාකාරිත්වය වැඩි කරන අතර ලිම්ෆොසයිට් ක්රියාකාරිත්වයට එහි වැදගත් බලපෑම භාවිතා කරයි. අනුව ප්රතිශක්තිකරණ දෙපාර්තමේන්තුව, මිනිස් සිරුරේ ග්ලූටතයෝන් මට්ටම නිසි ලෙස පරිපූරණය කිරීමෙන් ප්රතිශක්තිකරණ ප්රතික්රියා බෙහෙවින් වැඩි දියුණු කළ හැක. උදාහරණයක් ලෙස, සසම්භාවී ප්ලේසෙබෝ පාලිත පරීක්ෂණ දෙකකින් පෙන්නුම් කළේ N-acetyl-cysteine හෝ NAC සමඟ ප්රතිශක්තිකරණ අවදානමට ලක් වූ රෝගීන්ගේ චිකිත්සක ප්රතිකාරය, අවස්ථා දෙකේදීම, සම්පූර්ණ පුනර්ජීවනයක් ඇතුළත් බොහෝ ප්රතිශක්තිකරණ ක්රියාවලීන්හි සැලකිය යුතු වර්ධනයක් ඇති කළ බවයි. ස්වභාවික ඝාතක සෛල ක්රියාකාරිත්වය. N-acetyl-cysteine, හෝ NAC, ග්ලූටතයෝන් වලින් සල්ෆර් භාවිතා කර එය විෂ සහිත අණු සමඟ ඒකාබද්ධ කරයි, පසුව එය ජලයේ ද්රාව්ය බවට පත් වී මිනිස් සිරුරෙන් බැහැර කරයි.
නිදහස් රැඩිකලුන් උදාසීන කිරීම සඳහා ඉලෙක්ට්රෝන යැවීමෙන් ඇතැම් පද්ධති ක්රියාවලීන් ආරම්භ කිරීම සඳහා අවශ්ය වන ලිපොයික් අම්ලය පුනර්ජීවනය කිරීමට මෙන්ම විටමින් C සහ E ප්රතිචක්රීකරණය කිරීමටද Glutathione හැකියාව ඇත. වෙතින් පර්යේෂණ අධ්යයනයක් මත පදනම්ව PLOS ONE, ග්ලූටතයෝන් දියවැඩියා මෙටිලස්, හෝ T2DM, සහ mycobacterium tuberculosis ඇති රෝගීන්ට බලපෑවේය. සාමාන්යයෙන්, දුර්වල ප්රතිශක්තිකරණ පද්ධතියක් ඇති පුද්ගලයින්ට M. tb, හෝ mycobacterium tuberculosis, රෝග හෝ ආසාදනයට වැඩි නිරාවරණයක් පෙන්වීමේ ප්රවණතාවක් ඇත. තවද, T2DM නොමැති පුද්ගලයින්ට වඩා T2 වර්ගයේ දියවැඩියා මෙටිලස් හෝ T2DM ඇති පුද්ගලයින් TB රෝගයට ගොදුරු වීමේ ප්රවණතාවය දෙතුන් ගුණයකින් වැඩිය. T2DM සහිත රෝගීන්ගෙන් හුදකලා වූ මැක්රෝෆේජ්වල ග්ලූටතයෝන් මට්ටම ඉහළ නැංවීම M.Tb රෝගය හෝ ආසාදනය වැඩි දියුණු කිරීමට හේතු වූ බව පර්යේෂණ අධ්යයනය යෝජනා කළේය. මෙම ප්රතිඵලවලින් පෙන්නුම් කරන්නේ T2DM රෝගීන්ගේ ග්ලූටතයෝන් මට්ටම අඩුවීම M. tb රෝගය හෝ ආසාදනය වීමේ ඉහළ සම්භාවිතාවකට දායක වන බවයි. එපමණක්ද නොව, රඳා පවතී බ්රයිටන් සහ සසෙක්ස් වෛද්ය විද්යාලයේ Dietro Ghezzi, ඔක්සිකාරක ආතතිය අවසානයේ දුර්වල ප්රතිශක්තිකරණ පද්ධතියේ ව්යුහය හා ක්රියාකාරිත්වය ඇති විය හැක.
වාසනාවකට මෙන්, ප්රතිශක්තිකරණය ශක්තිමත් කිරීම සහ පාලනය කිරීම සඳහා ග්ලූටතයෝන් අත්යවශ්ය කාර්යභාරයක් ඉටු කරයි. උදාහරණයක් ලෙස, ටී-ලිම්ෆොසයිට් ප්රගුණනය, බහු අවයවික නියුට්රොෆිලවල ෆාගෝසයිටික ක්රියාකාරකම් සහ ඩෙන්ඩ්රිටික් සෛල ක්රියාකාරිත්වය ඇතුළුව ප්රතිශක්තිකරණ පද්ධතිය තුළ සහජ සහ අනුවර්තන ක්රියාවලීන් සඳහා ග්ලූටතයෝන් අත්යවශ්ය වේ, මේවා ප්රතිදේහජනක ඉදිරිපත් කරන සෛල වලින් සෑදී ඇති නිසා මූලික විය හැකිය. . සෛල මෙනෙහි කරන ලද ප්රතිශක්තිකරණයට ප්රෝටීන් ප්රතිදේහජනක ඇතුළත් වන අතර එය මුලින් මැක්රෝෆේජ් සහ ඩෙන්ඩ්රිටික් සෛලවල අන්තරාසර්ග වෙසිලිකා තුළ ක්ෂය වීමට පටන් ගනී, එබැවින් කුඩා පෙප්ටයිඩ ප්රතිදේහජනක-විශේෂිත ටී සෛල ප්රගුණනය සක්රීය කිරීම සඳහා මතුපිටින් නිරූපණය කෙරේ. මීට අමතරව, ග්ලූටතයෝන් සයිටොකයින් සෑදීමට උපකාරී වන අතර ඩෙන්ඩ්රිටික් සෛල මගින් ඉන්ටර්ෆෙරෝන්-ගැමා නිෂ්පාදනය පවත්වා ගැනීම අවශ්ය වන අතර එය මයිකොබැක්ටීරියා ඇතුළු අන්තර් සෛලීය රෝග කාරක වලින් ආරක්ෂා වීමට වැදගත් වේ.
Glutathione හි පූර්වගාමියා ලෙස විද්යාත්මකව හඳුන්වන N-acetyl-cysteine නොහොත් NAC, නිදහස් රැඩිකල් ස්කැවෙන්ජර් ප්රතිඔක්සිකාරකයක් ලෙස භාවිතා කරන ඉතා ප්රබල සෛලීය ප්රතිඔක්සිකාරකයකි. එහි භූමිකාව සඳහා පොදුවේ පිළිගැනේ ඇසිටමිනොෆෙන් විෂ වීම වැළැක්වීම, NAC, or'N-acetyl-cysteine, සෞඛ්ය සහ සුවතා ප්රතිලාභ කිහිපයක් ඇති බව පෙන්නුම් කර ඇත. අනුව සෛල සඟරාව, NAC සෞඛ්ය සම්පන්න ගිනි අවුලුවන ප්රතිචාරයකට සහාය වන අතර මානව කාලීන සහ නොමේරූ දරු ප්රසූතියට ධනාත්මක ලෙස බලපෑ හැකිය. පර්යේෂණ අධ්යයනයේ නිගමනය වූයේ පෙර නොමේරූ දරු උපත් සහ බැක්ටීරියා වැජිනෝසිස් ඇති කාන්තාවන් තුළ දිනකට NAC ග්රෑම් 0.6 ක් ප්රොජෙස්ටරෝන් සමඟ 16 වන සතියෙන් පසු වාචිකව ගැනීමෙන් නොමේරූ උපත් නැවත ඇතිවීම වැළැක්වීම සහ නව ජන්ම ප්රතිඵල වැඩිදියුණු කළ බවයි. අවසාන වශයෙන්, මාංශ පේශි ගොඩනැගීමට NAC හි ධනාත්මක බලපෑම් ද අනාවරණය විය. මිනිත්තු තුනක අඛණ්ඩ හැකිලීම් වලින් පසුව, සියයට 15 කින් වැඩි දියුණු කළ නිමැවුමක්, මාංශ පේශි ගොඩනැගීම වැඩි දියුණු කිරීමේදී සහ ශ්රමයේදී සමස්ත තෙහෙට්ටුව අඩු කිරීමේදී NAC මූලික කාර්යභාරයක් ඉටු කරන ආකාරය පෙන්නුම් කරයි.
NAC, or'N-acetyl-cysteine, polycystic ovarian syndrome හෝ PCOS ඇති අයට ප්රයෝජනවත් විය හැකි බව පර්යේෂකයන් විසින් සොයා ගන්නා ලදී. PCOS, or'polycystic ovarian syndrome, යනු ප්රජනක වයසේ කාන්තාවන්ගෙන් දළ වශයෙන් සියයට 5 සිට 10 දක්වා බලපාන අන්තරාසර්ග ග්රන්ථි ආශ්රිත පොදු රෝගයකි. එවැනි රෝගීන් තුළ, පරිවෘත්තීය සින්ඩ්රෝමය අත්විඳීමේ වැඩි අවදානමක් ඇත, NAC භාවිතය සෞඛ්ය සම්පන්න ඉන්සියුලින් මට්ටම් සහ සංවේදීතාව යථා තත්වයට පත් කිරීමට උපකාරී වේ.

ආචාර්ය ඇලෙක්ස් ජිමිනෙස්ගේ තීක්ෂ්ණ බුද්ධිය
ග්ලූටතයෝන් "ප්රතිඔක්සිකාරක වල ප්රධානියා" ලෙස හඳුන්වනු ලබන්නේ සමස්ත සෞඛ්යය සහ යහපැවැත්ම සාක්ෂාත් කර ගැනීම සහ පවත්වා ගැනීම සඳහා එහි මූලික කාර්යභාරය නිසාය. මිනිස් සිරුරට තමන්ගේම ග්ලූටතයෝන් නිපදවීමට හැකියාව ඇති අතර, දුර්වල පෝෂණය, දූෂණය, විෂ ද්රව්ය, ඖෂධ සහ/හෝ ඖෂධ අධික ලෙස භාවිතා කිරීම, ආතතිය, කම්පනය, වයසට යෑම, රෝග සහ විකිරණ යන සියල්ලම අපගේ ස්වභාවික ග්ලූටතයෝන් මට්ටම අඩු කළ හැකිය. මෙය ඔක්සිකාරක ආතතිය, මුක්ත ඛණ්ඩක, ආසාදන සහ පිළිකා වලින් සෛල හානිවලට පුද්ගලයන් වඩාත් ගොදුරු විය හැක. එබැවින් ග්ලූටතයෝන් අතිරේකය මිනිස් සිරුරට ඉමහත් ප්රතිලාභ ලබා දිය හැකිය. චිරොක්ට්රැක්ටික් සත්කාර වැනි විකල්ප ප්රතිකාර විකල්ප සමඟ එක්ව, යහපැවැත්ම වැඩිදියුණු කිරීම සඳහා ග්ලූටතයෝන් මට්ටම නැවත වරක් නියාමනය කළ හැකිය.
මීට අමතරව, සෞඛ්ය සේවා වෘත්තිකයන් වෙනත් විකල්ප ප්රතිකාර විකල්ප සමඟ ග්ලූටතයෝන් අතිරේකය භාවිතය ක්රියාත්මක කිරීමට යෝජනා කර ඇත. කිරීට ප්රතිකාරය, සමස්ත සෞඛ්යය සහ යහපැවැත්ම තවදුරටත් වැඩිදියුණු කිරීමට. ප්රතිඔක්සිකාරක උපරිම යහපැවැත්ම පවත්වා ගැනීමට මෙන්ම සෛල වලට හානි හෝ හානි සිදු කරන නිදහස් රැඩිකලුන් වල දාම ප්රතික්රියාව වැලැක්වීමට වැදගත් වේ. ග්ලූටතයෝන් වැනි ප්රබල ප්රතිඔක්සිකාරක, ඉහත සඳහන් කළ පරිදි, අවසානයේදී මෙම නිදහස් රැඩිකලුන් වර්ධනය නියාමනය කිරීමට සහ සෞඛ්ය සම්පන්න ප්රතිශක්තිකරණ පද්ධතියේ ප්රතිචාරයක් ලබා දීමට උපකාරී වේ. ඒ බව පර්යේෂණ අධ්යයනවලින් සොයාගෙන ඇත කිරීට ප්රතිකාරය මිනිස් සිරුරේ ප්රතිඔක්සිකාරකවල ක්රියාකාරිත්වය ස්වභාවිකව ඉහළ නංවමින් මෙම ක්රියාවලියේදී අත්යවශ්ය කාර්යභාරයක් ද ඉටු කළ හැකිය. චිරොක්ට්රැක්ටික් සත්කාරය යනු ඖෂධ/ඖෂධ සහ/හෝ ශල්යමය මැදිහත්වීම් භාවිතයෙන් තොරව මිනිස් සිරුරට ස්වභාවිකව සුවපත් වීමට ඉඩ සැලසීම සඳහා කොඳු ඇට පෙළේ නොගැලපීම් හෝ උපස්ථිති නිවැරදි කිරීම සඳහා කොඳු ඇට පෙළ ගැලපීම් සහ අතින් හැසිරවීම් භාවිතා කරන ආරක්ෂිත සහ ඵලදායී ප්රතිකාර ප්රවේශයකි.
අවසාන වශයෙන්, ප්රතිඔක්සිකාරක ඔවුන්ගේ ජීව විද්යාත්මක ගුණාංග විශාල සෞඛ්ය ප්රතිලාභ හරහා විදහා දක්වයි, එය අපගේ නවීන ලෝකයේ වැඩිවන ආතතිය, රෝග සහ දූෂණය යන සෑම ප්රහාරයක් සමඟම වෙන කවරදාටත් වඩා අවශ්ය විය හැකිය, ඒවා සියල්ලම සෛල හානිවලට සහ/හෝ හානිවලට දායක වේ. . Glutathione සහ එහි පූර්වගාමියා, NAC, or'N-acetyl-cysteine, ප්රතිඔක්සිකාරක ක්ෂේත්රය තුළ ඔවුන්ගේ ප්රබල තත්ත්වය දිගටම පෙන්නුම් කරයි. චිරොක්ට්රැක්ටික් සත්කාර වැනි විකල්ප ප්රතිකාර විකල්ප සමඟ එක්ව, මෙම ප්රබල ප්රතිඔක්සිකාරකය ලබා දෙන සියලුම ප්රතිලාභවලින් මිනිසුන්ට ප්රයෝජන ගත හැකිය. අපගේ තොරතුරු වල විෂය පථය චිරොක්ට්රැක්ටික් මෙන්ම කොඳු ඇට පෙළේ තුවාල සහ තත්වයන්ට සීමා වේ. විෂය කරුණු සාකච්ඡා කිරීමට, කරුණාකර වෛද්ය ජිමිනෙස්ගෙන් විමසීමට හෝ අපව අමතන්න915-850-0900 .
ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස් විසින් පාලනය කරන ලදී

අමතර මාතෘකා: පිටුපස වේදනාව
ආපහු වේදනාව ආබාධිතභාවයට සහ ලොව පුරා වැඩ කරන දින මග හැරීමට වඩාත් ප්රචලිත හේතුවකි. ඇත්ත වශයෙන්ම, වෛද්ය කාර්යාල චාරිකා සඳහා දෙවන වඩාත් පොදු හේතුව ලෙස කොන්දේ වේදනාව ආරෝපණය කර ඇති අතර එය ඉහළ ශ්වසන ආසාදනවලින් පමණක් වැඩි වේ. ජනගහනයෙන් ආසන්න වශයෙන් සියයට 80 කට පමණ ඔවුන්ගේ ජීවිත කාලය පුරාම අවම වශයෙන් එක් වරක්වත් යම් ආකාරයක පිටුපස වේදනාවක් අත්විඳිනු ඇත. කොඳු ඇට පෙළ යනු අනෙකුත් මෘදු පටක අතර අස්ථි, සන්ධි, බන්ධන සහ මාංශ පේශි වලින් සමන්විත සංකීර්ණ ව්යුහයකි. මේ නිසා, තුවාල සහ/හෝ උග්ර තත්ත්වයන්, වැනි හර්නිටීස් තැටි, අවසානයේ පිටුපස වේදනාවේ රෝග ලක්ෂණ ඇති විය හැක. ක්රීඩා තුවාල හෝ මෝටර් රථ අනතුරු තුවාල බොහෝ විට පිටුපස වේදනාව සඳහා නිතර නිතර හේතුව වේ, කෙසේ වෙතත්, සමහර විට සරලම චලනයන් වේදනාකාරී ප්රතිඵල ඇති විය හැක. වාසනාවකට මෙන්, චිරොක්ට්රැක්ටික් සත්කාර වැනි විකල්ප ප්රතිකාර විකල්ප, කොඳු ඇට පෙළ ගැලපීම් සහ අතින් හැසිරවීම් භාවිතයෙන් පිටුපස වේදනාව සමනය කිරීමට උපකාරී වන අතර අවසානයේ වේදනා සහන වැඩි දියුණු කරයි.

by ආචාර්ය ඇලෙක්ස් ජිමිනෙස් | ක්රියාකාරී වෛද්ය විද්යාව, ඔක්සිකාරක ආතතිය
විද්යාව පදනම් කරගත් චිරොක්ට්රැක්ටර් වෛද්ය ඇලෙක්සැන්ඩර් ජිමිනෙස් දෙස බලයි ඔක්සිකාරක ආතතිය, එය කුමක්ද, එය ශරීරයට බලපාන ආකාරය සහ තත්වයට පිළියමක් ලෙස ප්රතිඔක්සිකාරක ආරක්ෂාව.
Esra Birben PhD,1 Umit Murat Sahiner MD,1 Cansin Sackesen MD,1 Serpil Erzurum MD,2 සහ Omer Kalayci, MD1
සාරාංශය: ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ (ROS) සාමාන්ය සෛලීය පරිවෘත්තීය සහ වායු දූෂක හෝ සිගරට් දුම වැනි පාරිසරික සාධකවල ප්රතිඵලයක් ලෙස ජීවීන් විසින් නිපදවනු ලැබේ. ROS ඉතා ප්රතික්රියාශීලී අණු වන අතර කාබෝහයිඩ්රේට්, න්යෂ්ටික අම්ල, ලිපිඩ සහ ප්රෝටීන වැනි සෛල ව්යුහයන්ට හානි කළ හැකි අතර ඒවායේ ක්රියාකාරිත්වය වෙනස් කරයි. ඔක්සිකාරකවලට පක්ෂව ඔක්සිකාරක සහ ප්රතිඔක්සිකාරක අතර සමතුලිතතාවය වෙනස් වීම ඔක්සිකාරක ආතතිය ලෙස හැඳින්වේ. Aerobic ජීවීන්ට ඒකාබද්ධ ප්රතිඔක්සිකාරක පද්ධති ඇත, ඒවාට ROS හි හානිකර බලපෑම් අවහිර කිරීමට සාමාන්යයෙන් ඵලදායී වන එන්සයිම සහ එන්සයිම නොවන ප්රතිඔක්සිකාරක ඇතුළත් වේ. කෙසේ වෙතත්, ව්යාධිජනක තත්වයන් තුළ, ප්රතිඔක්සිකාරක පද්ධති යටපත් විය හැක. ඔක්සිකාරක ආතතිය පිළිකා, ස්නායු ආබාධ, ධමනි සිහින් වීම, අධි රුධිර පීඩනය, ischemia / perfusion, දියවැඩියාව, උග්ර ශ්වසන අපහසුතා සින්ඩ්රෝමය, idiopathic pulmonary fibrosis, නිදන්ගත බාධාකාරී පෙනහළු රෝග සහ ඇදුම ඇතුළු බොහෝ ව්යාධිජනක තත්වයන් සහ රෝග සඳහා දායක වේ. මෙම සමාලෝචනයේදී, අපි සෛලීය ඔක්සිකාරක සහ ප්රතිඔක්සිකාරක පද්ධති සාරාංශ කරන අතර ඔක්සිකාරක ආතතියේ සෛලීය බලපෑම් සහ යාන්ත්රණ සාකච්ඡා කරමු.
ප්රධාන වචන: ප්රතිඔක්සිකාරක, ඔක්සිකාරක, ඔක්සිකාරක ආතතිය, ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ, රෙඩොක්ස්
(WAO Journal 2012; 5:9-19)
ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ (ROS) සාමාන්ය සෛලීය පරිවෘත්තීය ප්රතිඵලයක් ලෙස ජීවීන් විසින් නිපදවනු ලැබේ. අඩු සිට මධ්යස්ථ සාන්ද්රණයකදී, ඒවා කායික සෛල ක්රියාවලීන්හි ක්රියා කරයි, නමුත් ඉහළ සාන්ද්රණයකදී, ලිපිඩ, ප්රෝටීන සහ DNA වැනි සෛල සංරචක වලට අහිතකර වෙනස් කිරීම් ඇති කරයි. ඔක්සිකාරක ආතතිය ලෙස හැඳින්වේ. ඔක්සිකාරක ආතතිය පිළිකා, ස්නායු ආබාධ, 1-6 ධමනි සිහින් වීම, අධි රුධිර පීඩනය, ඉෂ්මෙමියා / පර්ෆියුෂන්, 7-10 දියවැඩියාව, උග්ර ශ්වසන අපහසුතා සින්ඩ්රෝමය, මුග්ධ පෙනහළු ෆයිබ්රෝසිස්, නිදන්ගත පුඵ්ඵුසීය බාධාකාරී රෝග ඇතුළු බොහෝ ව්යාධි තත්වයන්ට දායක වේ. ,11 සහ ඇදුම.14-15 Aerobic ජීවීන්ට ඒකාබද්ධ ප්රතිඔක්සිකාරක පද්ධති ඇත, ඒවාට ROS හි හානිකර බලපෑම් අවහිර කිරීමට සාමාන්යයෙන් ඵලදායී වන එන්සයිම සහ එන්සයිම නොවන ප්රතිඔක්සිකාරක ඇතුළත් වේ. කෙසේ වෙතත්, ව්යාධිජනක තත්වයන් තුළ, ප්රතිඔක්සිකාරක පද්ධති යටපත් විය හැක. මෙම සමාලෝචනයේදී, අපි සෛලීය ඔක්සිකාරක සහ ප්රතිඔක්සිකාරක පද්ධති සහ සෞඛ්ය සහ රෝග තත්වයන් තුළ අඩු කිරීමේ සහ ඔක්සිකාරක (රෙඩොක්ස්) තත්ත්වය නියාමනය කිරීම සාරාංශ කරමු.
ඔක්සිඩන්ට්
ROS හි ආවේණික මූලාශ්ර
ROS සාමාන්ය සෛලීය පරිවෘත්තීය ප්රතිඵලයක් ලෙස අණුක ඔක්සිජන් වලින් නිපදවනු ලැබේ. ROS කණ්ඩායම් 2 කට බෙදිය හැකිය: නිදහස් රැඩිකලුන් සහ රැඩිකලුන් නොවන. යුගල නොකළ ඉලෙක්ට්රෝන එකක් හෝ කිහිපයක් අඩංගු වන අතර එමගින් අණුවට ප්රතික්රියාශීලීත්වය ලබා දෙන අණු නිදහස් රැඩිකලුන් ලෙස හැඳින්වේ. නිදහස් රැඩිකලුන් 2 ක් ඔවුන්ගේ යුගල නොකළ ඉලෙක්ට්රෝන බෙදා ගන්නා විට, රැඩිකල් නොවන ආකෘති නිර්මාණය වේ. භෞතික විද්යාත්මක වැදගත්කමක් ඇති ප්රධාන ROS 3 වන්නේ සුපර් ඔක්සයිඩ් ඇනායන (O22.), හයිඩ්රොක්සයිල් රැඩිකල් (OH) සහ හයිඩ්රජන් පෙරොක්සයිඩ් (H2O2) ය. ROS වගුව 1 හි සාරාංශ කර ඇත.
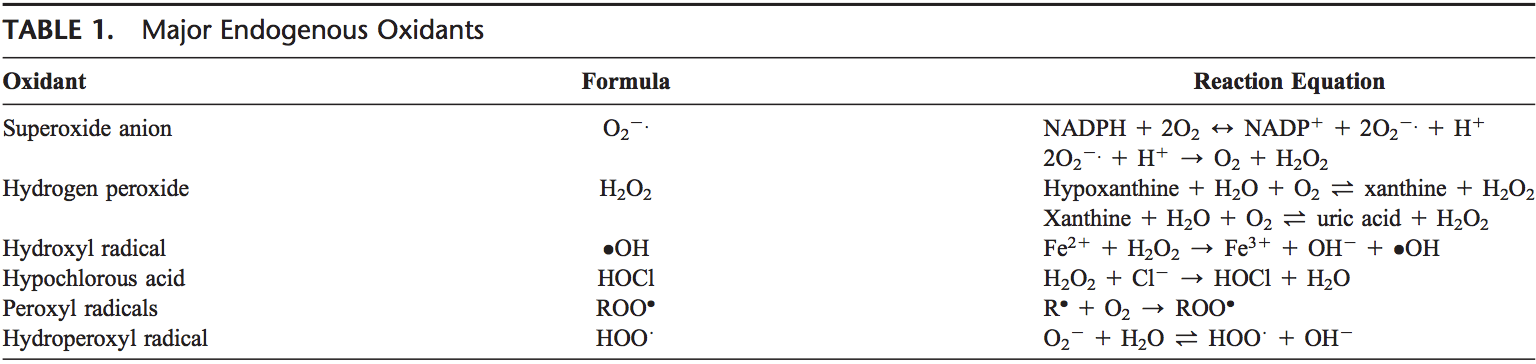
සුපර් ඔක්සයිඩ් ඇනායන සෑදී ඇත්තේ අණුක ඔක්සිජන් වලට ඉලෙක්ට්රෝන 1ක් එකතු වීමෙනි.22 මෙම ක්රියාවලිය නිකොටින් ඇඩිනීන් ඩයිනියුක්ලියෝටයිඩ පොස්පේට් [NAD(P)H] ඔක්සිඩේස් හෝ සැන්තයින් ඔක්සිඩේස් හෝ මයිටොකොන්ඩ්රියල් ඉලෙක්ට්රෝන ප්රවාහන පද්ධතිය මගින් මැදිහත් වේ. සුපර් ඔක්සයිඩ් ඇනායන නිපදවීමේ ප්රධාන ස්ථානය වන්නේ මයිටොකොන්ඩ්රියා, ඇඩිනොසීන් ට්රයිපොස්පේට් නිපදවීමට සෛලයේ යන්ත්ර සූත්රයයි. සාමාන්යයෙන්, ඔක්සිජන් ජලයට අඩු කිරීම සඳහා ඉලෙක්ට්රෝන මයිටොකොන්ඩ්රිය ඉලෙක්ට්රෝන ප්රවාහන දාමය හරහා මාරු කරනු ලැබේ, නමුත් දළ වශයෙන් සියලුම ඉලෙක්ට්රෝන වලින් 1 සිට 3% දක්වා පද්ධතියෙන් කාන්දු වී සුපර් ඔක්සයිඩ් නිපදවයි. NAD(P)H ඔක්සිඩේස් බහුරූප න්යෂ්ටික ලියුකෝසයිට්, මොනොසයිට් සහ මැක්රෝෆේජ් වල දක්නට ලැබේ. ෆාගෝසයිටෝසිස් මත, මෙම සෛල බැක්ටීරියා නාශක ක්රියාකාරිත්වයට තුඩු දෙන සුපර් ඔක්සයිඩ් පිපිරීමක් නිපදවයි. සුපර් ඔක්සයිඩ් ඩිස්මියුටේස් (SODs, EC 1.15.1.1) ක්රියාවෙන් සුපර් ඔක්සයිඩ් හයිඩ්රජන් පෙරොක්සයිඩ් බවට පරිවර්තනය වේ. හයිඩ්රජන් පෙරොක්සයිඩ් ප්ලාස්මා පටලය හරහා පහසුවෙන් විසරණය වේ. හයිඩ්රජන් පෙරොක්සයිඩ් නිපදවනු ලබන්නේ සැන්තයින් ඔක්සිඩේස්, ඇමයිනෝ අම්ල ඔක්සිඩේස් සහ NAD(P)H ඔක්සිඩේස්23,24 මගින් සහ පෙරොක්සිසෝම වල පරිවෘත්තීය ප්රතික්රියා වලදී අණුක ඔක්සිජන් පරිභෝජනය මගිනි. Haber-Weiss සහ Fenton ප්රතික්රියා ලෙස හැඳින්වෙන ප්රතික්රියා අනුප්රාප්තියකදී, Fe2 හෝ Cu2 වැනි සම්ප්රේෂණ ලෝහ හමුවේ H2O21 OH21.25 දක්වා බිඳ වැටිය හැක.
Fe31 +___.O2′?Fe2 +′O2 හේබර් වයිස්
Fe2 +′H2O2′?Fe3 +№OH+ .OH ෆෙන්ටන් ප්රතික්රියාව
O 2 H2 O2 සමඟ ප්රතික්රියා කර OH බහු අසංතෘප්ත මේද අම්ල වලින් ඉලෙක්ට්රෝනයක් ගැනීමෙන් ලිපිඩ පෙරොක්සයිඩනය ද ආරම්භ කළ හැක.
Granulocytic එන්සයිම eosinophil peroxidase සහ myeloperoxidase (MPO) හරහා H2O2 හි ප්රතික්රියාකාරිත්වය තවදුරටත් පුළුල් කරයි. සක්රීය නියුට්රොෆිලවල H2O2 MPO මගින් පරිභෝජනය කරයි. ක්ලෝරයිඩ් අයන හමුවේ H2O2 හයිපොක්ලෝරස් අම්ලය (HOCl) බවට පරිවර්තනය වේ. HOCl අධික ලෙස ඔක්සිකාරක වන අතර වාතයේ ඇති රෝග කාරක විනාශ කිරීමේදී වැදගත් කාර්යභාරයක් ඉටු කරයි. 28 කෙසේ වෙතත්, HOCl ට DNA සමඟ ප්රතික්රියා කර DNA ප්රෝටීන් අන්තර්ක්රියා ඇති කිරීමටත් පිරමිඩීන් ඔක්සිකරණ නිෂ්පාදන නිපදවීමටත් DNA භෂ්මවලට ක්ලෝරයිඩ් එකතු කිරීමටත් හැකිය.29,30 Eosinophil peroxidase සහ MPO ද ඔක්සිකාරක ආතතියට දායක වන්නේ හැලජනීකරණය, නයිට්රේෂන් සහ ප්රෝටීන හරස් සම්බන්ධක මගින් ටයිරොසිල් රැඩිකල් මගින් ප්රෝටීන වෙනස් කිරීමෙනි.31–33
අනෙකුත් ඔක්සිජන්-ව්යුත්පන්න නිදහස් රැඩිකලුන් වන්නේ පෙරොක්සිල් රැඩිකලුන් (ROO$) වේ. මෙම රැඩිකලයන්ගේ සරලම ආකාරය වන්නේ හයිඩ්රොපෙරොක්සයිල් රැඩිකල් (HOO$) වන අතර මේද අම්ල පෙරොක්සිකරණයෙහි භූමිකාවක් ඇත. පැති දාම මෙතිලීන් කාබන් වලින් හයිඩ්රජන් පරමාණුවක් වියුක්ත කිරීමෙන් නිදහස් රැඩිකලුන්ට ලිපිඩ පෙරොක්සිකරණ දාම ප්රතික්රියා ඇති කළ හැක. ලිපිඩ රැඩිකල් ඔක්සිජන් සමඟ ප්රතික්රියා කර පෙරොක්සයිල් රැඩිකල් නිපදවයි. පෙරොක්සිල් රැඩිකල් දාම ප්රතික්රියාවක් ආරම්භ කරන අතර බහු අසංතෘප්ත මේද අම්ල ලිපිඩ හයිඩ්රොපෙරොක්සයිඩ් බවට පරිවර්තනය කරයි. ලිපිඩ හයිඩ්රොපෙරොක්සයිඩ් ඉතා අස්ථායී වන අතර ඇල්ඩිහයිඩ් (4-හයිඩ්රොක්සි-2,3-නෝනෙනල් වැනි) සහ මැලොන්ඩියල්ඩිහයිඩ් (MDAs) වැනි ද්විතියික නිෂ්පාදනවලට පහසුවෙන් වියෝජනය වේ. Isoprostanes යනු arachidonic අම්ලයේ පෙරොක්සිකරණය හරහා ජනනය වන ලිපිඩ පෙරොක්සයිඩ් නිෂ්පාදන සමූහයක් වන අතර එය ඇදුම රෝගයේ ප්ලාස්මා සහ හුස්ම ඝනීභවනයන්හි ඉහළ ගොස් ඇති බව සොයාගෙන ඇත. පටල ව්යුහය.
හයිඩ්රජන් පෙරොක්සයිඩ්, සුපර් ඔක්සයිඩ් රැඩිකල්, ඔක්සිකරණය වූ ග්ලූටතයෝන් (ජීඑස්එස්ජී), එම්ඩීඒ, අයිසොප්රොස්ටේන්, කාබොනයිල් සහ නයිට්රොටිරොසීන් ප්රමිතිගත විශ්ලේෂණයන් මගින් ඔක්සිකරණයේ ජෛව සලකුණු ලෙස ප්ලාස්මා, රුධිරය හෝ බ්රොන්කොඇල්වෙයෝලර් වොජ් සාම්පල වලින් පහසුවෙන් මැනිය හැක.
ඔක්සිකාරකවල බාහිර මූලාශ්රය
සිගරට් දුම
සිගරට් දුමෙහි සුපර් ඔක්සයිඩ් සහ නයිට්රික් ඔක්සයිඩ් වැනි බොහෝ ඔක්සිකාරක සහ නිදහස් රැඩිකලුන් සහ කාබනික සංයෝග අඩංගු වේ. 36 මීට අමතරව, සිගරට් දුමාරය පෙණහලුවලට ආශ්වාස කිරීමෙන් නියුට්රොෆිල් සහ මැක්රෝෆේජ් සමුච්චය වීම වැනි අන්තරාසර්ග යාන්ත්රණයන් ද ක්රියාත්මක වන අතර එමඟින් ඔක්සිකාරක තුවාලය තවදුරටත් වැඩි වේ. .
ඕසෝන් නිරාවරණය
ඕසෝන් නිරාවරණයෙන් ලිපිඩ පෙරොක්සයිඩ්කරණයට හේතු විය හැකි අතර නියුට්රොෆිල්ස් වාතයේ එපිටිලියම් වලට ගලා ඒම ඇති කරයි. ඕසෝන් වලට කෙටි කාලීනව නිරාවරණය වීමෙන් MPO, eosinophil කැටානික් ප්රෝටීන සහ ලැක්ටේට් ඩිහයිඩ්රොජිනේස් සහ ඇල්බියුමින් වැනි ගිනි අවුලුවන මැදිහත්කරුවන් මුදා හැරීමට ද හේතු වේ. අංශු ද්රව්ය (ඝන අංශු මිශ්රණය සහ වාතයේ ඇති ද්රව බිංදු මිශ්රණය) ඔක්සිජන් අඩු කිරීම උත්ප්රේරණය කරයි.
හයිපෙරොක්සියා
Hyperoxia යනු පෙණහලුවල හෝ අනෙකුත් ශරීර පටකවල ඔක්සිජන් වල සාමාන්ය ආංශික පීඩනයට වඩා ඉහළ ඔක්සිජන් මට්ටම් තත්ත්වයන් වේ. එය ප්රතික්රියාශීලී ඔක්සිජන් සහ නයිට්රජන් විශේෂ වැඩි වශයෙන් නිෂ්පාදනය කිරීමට මග පාදයි.40,41
අයනීකරණ විකිරණ
අයනීකරණ විකිරණ, O2 හමුවේ, හයිඩ්රොක්සයිල් රැඩිකල්, සුපර් ඔක්සයිඩ් සහ කාබනික රැඩිකල් හයිඩ්රජන් පෙරොක්සයිඩ් සහ කාබනික හයිඩ්රොපෙරොක්සයිඩ් බවට පරිවර්තනය කරයි. මෙම හයිඩ්රොපෙරොක්සයිඩ් විශේෂ Fenton ප්රතික්රියා හරහා Fe සහ Cu වැනි රෙඩොක්ස් ක්රියාකාරී ලෝහ අයන සමඟ ප්රතික්රියා කරන අතර එමඟින් ඔක්සිකාරක ආතතිය ඇති කරයි.42,43 නාරායනන් et al44 පෙන්නුම් කළේ ඇල්ෆා අංශුවලට නිරාවරණය වූ ෆයිබ්රොබ්ලාස්ට් අන්තර් සෛලීය O2 2. සහ H2O2 හි සැලකිය යුතු වැඩි වීමක් ඇති බවයි. ප්ලාස්මා පටල-බැඳුනු NADPH ඔක්සිඩේස් හරහා නිෂ්පාදනය. 44 බාහිර සෛලීය සංඥා නියාමනය කරන ලද kinase 1 සහ 2 (ERK1/2), c-Jun N-terminal kinase (JNK) වැනි සංඥා සම්ප්රේෂණ අණු සහ p38, සහ පිටපත් කිරීමේ සාධක සක්රියකාරක ප්රෝටීන්-1 (AP-1), න්යෂ්ටික සාධකය-kB (NF-kB) සහ p53, සක්රිය කර ඇති අතර, එහි ප්රතිඵලයක් ලෙස විකිරණ ප්රතිචාරය ආශ්රිත ජාන ප්රකාශ වේ. 45–50 පාරජම්බුල A (UVA) ෆෝටෝන ඔක්සිකාරක ප්රතික්රියා අවුලුවන පෝර්ෆිරින්, NADPH ඔක්සිඩේස් සහ රයිබොෆ්ලැවින් වැනි ආවේණික ප්රභාසංවේදක උද්දීපනය කිරීමෙනි. 8-Oxo-7,8- dihydroguanine (8-oxoGua) යනු OH රැඩිකල්, 1-ඉලෙක්ට්රෝන ඔක්සිකාරක, සහ ප්රධාන වශයෙන් ගුවානීන් සමඟ ප්රතික්රියා කරන සිංගල්ට් ඔක්සිජන් ඔක්සිකරණය වීමෙන් සාදන ලද ප්රධාන UVA-මැදිහත් වූ DNA ඔක්සිකරණ නිෂ්පාදනයයි.51 ගුවානීන් සෑදීම හුදකලා DNA වල රැඩිකල් කැටායන අයනීකරණ විකිරණවල සෘජු බලපෑම හරහා කාර්යක්ෂමව සිදු වන බව පෙන්වා දී ඇත.
බැර ලෝහ අයන
යකඩ, තඹ, කැඩ්මියම්, රසදිය, නිකල්, ඊයම් සහ ආසනික් වැනි බැර ලෝහ අයන, ප්රතික්රියාශීලී රැඩිකලුන් උත්පාදනය කිරීමට හේතු විය හැකි අතර ලිපිඩ පෙරොක්සිකරණය සහ න්යෂ්ටික ප්රෝටීන සහ DNA සමඟ ප්රතික්රියා කිරීම හරහා එන්සයිම ක්රියාකාරකම් ක්ෂය වීම හරහා සෛලීය හානි සිදු කළ හැක.
ලෝහ-මැදිහත් වූ නිදහස් රැඩිකල් උත්පාදනයේ වඩාත් වැදගත් යාන්ත්රණයක් වන්නේ ෆෙන්ටන් ආකාරයේ ප්රතික්රියාවකි. සුපර් ඔක්සයිඩ් අයන සහ හයිඩ්රජන් පෙරොක්සයිඩ් වලට යකඩ සහ තඹ වැනි සංක්රාන්ති ලෝහ සමඟ අන්තර්ක්රියා කළ හැකි අතර, ලෝහ උත්ප්රේරක Haber-Weiss/Fenton ප්රතික්රියාව හරහා OH රැඩිකලුන් සෑදිය හැක.
Metal31 1 $O2 /Metal21 1 O2 Haber Weiss Metal21 1 H2 O2 /Metal31 1 OH 2 1 $OH Fenton ප්රතික්රියාව
Fenton-type සහ Haber-Weiss-type යාන්ත්රණයන්ට අමතරව, තයෝල් රැඩිකලුන් වැනි නිදහස් රැඩිකලුන් ජනනය කිරීමට හෝ සෛල සංඥා මාර්ග ප්රේරණය කිරීමට ඇතැම් ලෝහ අයන සෛලීය අණු සමඟ සෘජුවම ප්රතික්රියා කළ හැක. මෙම රැඩිකලුන් O22.. O22 ජනනය කිරීමට අනෙකුත් තයෝල් අණු සමඟ ප්රතික්රියා කරයි. අතිරේක ඔක්සිජන් රැඩිකල් උත්පාදනය ඇති කරන H2O2 බවට පරිවර්තනය වේ. ආසනයිට් වැනි සමහර ලෝහ, සෛල තුළ රැඩිකල් නිෂ්පාදන පද්ධති සක්රීය කිරීම මගින් වක්රව ROS සෑදීම ප්රේරණය කරයි.56
ආසනික් යනු සුපර් ඔක්සයිඩ් (O2 2), සිංගල්ට් ඔක්සිජන් (1O2), පෙරොක්සයිල් රැඩිකල් (ROO), නයිට්රික් ඔක්සයිඩ් (NO), හයිඩ්රජන් පෙරොක්සයිඩ් (H2O2) සහ ඩයිමෙතිලර්සිනික් පෙරොක්සයිල් රැඩිකල් ඇතුළු විවිධ ROS නිපදවන අධික විෂ සහිත මූලද්රව්යයකි. CH3)2AsOO ].57–59 ආසනික් (III) සංයෝග මගින් ප්රතිඔක්සිකාරක එන්සයිම, විශේෂයෙන්ම GSH මත යැපෙන එන්සයිම, එනම් glutathione-S-transferases (GSTs), glutathione peroxidase (GSH-Px) සහ GSH reductase, bind හරහා වළක්වයි. - ඔවුන්ගේ සල්ෆයිඩ්රයිල් (šSH) කාණ්ඩවලට.60,61
ඊයම් lipid peroxidation වැඩි කරයි.62 ඊයම් නිරාවරණයෙන් පසු පටක SOD සහ මොළයේ GPx වල ක්රියාකාරිත්වයේ සැලකිය යුතු අඩුවීමක් වාර්තා වී ඇත.63,64 ඊයම් මගින් බොහෝ එන්සයිම සඳහා සහකාරකයක් ලෙස ක්රියා කරන සින්ක් ප්රතිස්ථාපනය එවැනි එන්සයිම අක්රිය කිරීමට හේතු වේ. ඊයම් නිරාවරණය පටක තයෝල් වලට බලපෑම් කිරීමෙන් GST නිෂේධනය වීමට හේතු විය හැක.
ලෝහ උත්ප්රේරක ප්රතික්රියා මගින් ජනනය වන ROS හට DNA භෂ්ම වෙනස් කළ හැක. Fe21, Cu21, සහ Ni21 වැනි ලෝහ අයන මගින් ඔක්සිකාරක හානි හේතුවෙන් G/C, G/T, සහ C/T යන මූලික ආදේශන තුනක් සිදු විය හැක. Reid et al65 පෙන්නුම් කළේ G / C ප්රධාන වශයෙන් Fe21 විසින් නිෂ්පාදනය කරන ලද අතර C / T ආදේශනය Cu21 සහ Ni21 විසින් සිදු කරන ලදී.
ප්රතිඔක්සිකාරක
මිනිස් සිරුර විවිධ ප්රතිඔක්සිකාරක වලින් සමන්විත වන අතර එය ඔක්සිකාරකවල බලපෑම සමතුලිත කිරීමට උපකාරී වේ. සියලුම ප්රායෝගික අරමුණු සඳහා, මේවා කාණ්ඩ 2 කට බෙදිය හැකිය: එන්සයිම (වගුව 2) සහ එන්සයිම නොවන (වගුව 3).
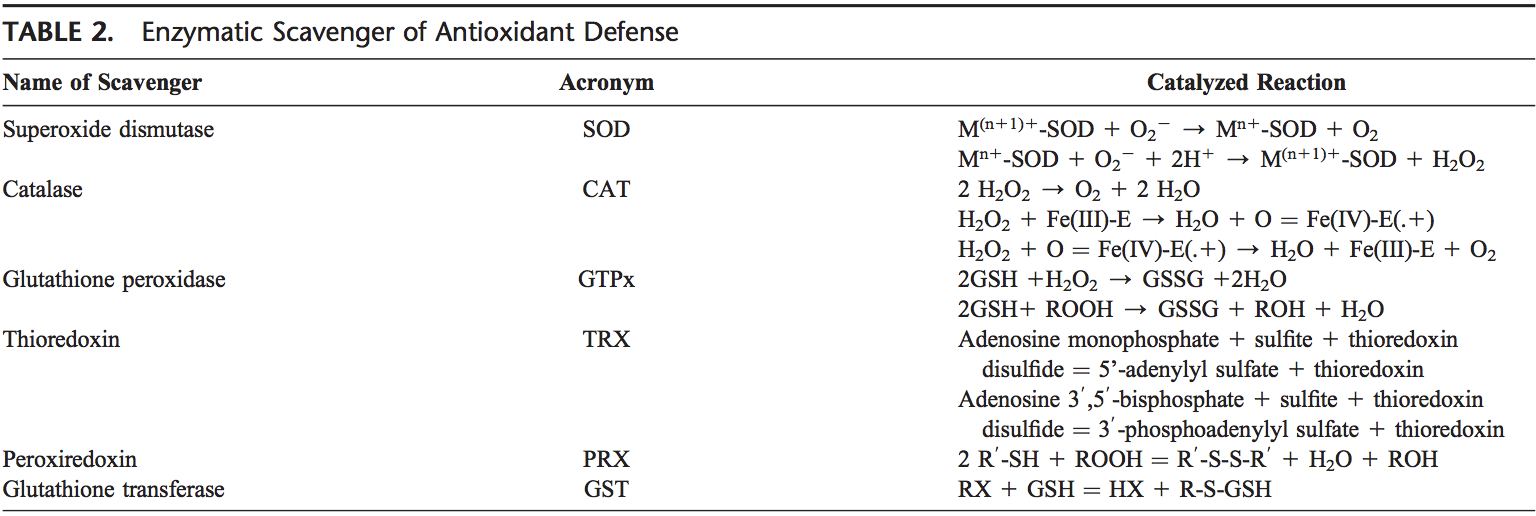
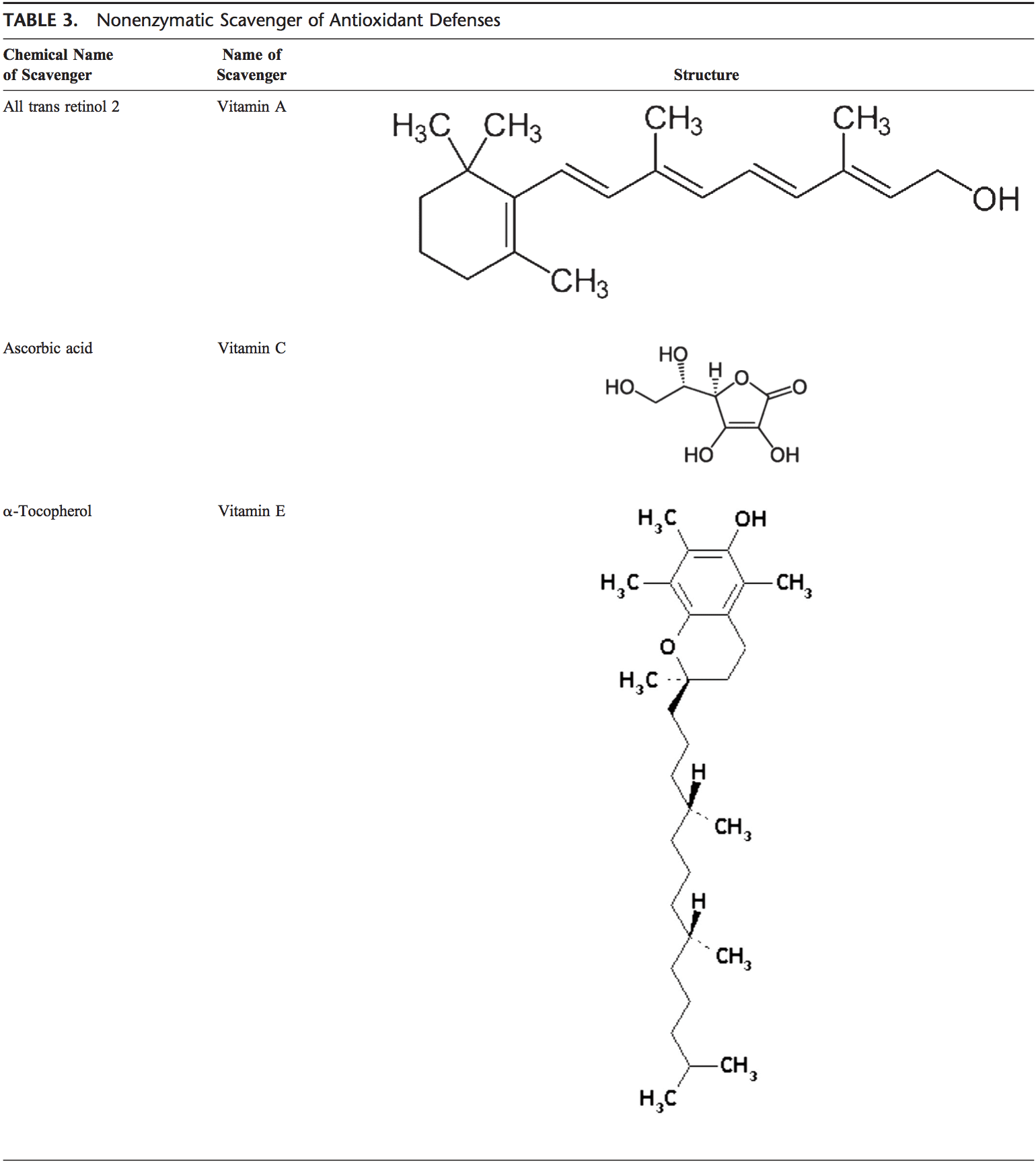
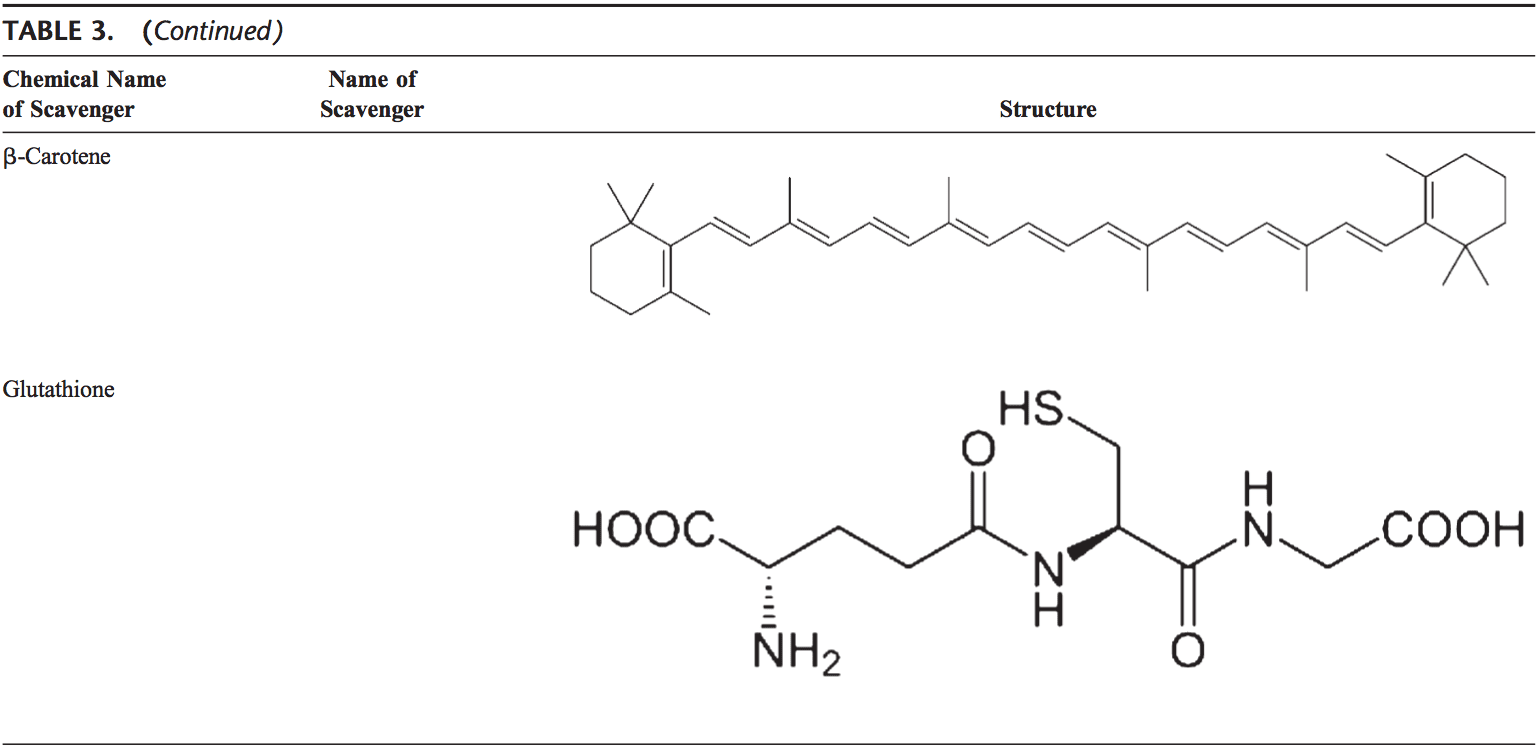
එන්සයිම ප්රතිඔක්සිකාරක
පෙනහළු වල ප්රධාන එන්සයිම ප්රතිඔක්සිකාරක වන්නේ SODs (EC 1.15.1.11), කැටලේස් (EC 1.11.1.6) සහ GSH-Px (EC 1.11.1.9) ය. මෙම ප්රධාන එන්සයිම වලට අමතරව, හීම් ඔක්සිජන්-1 (EC 1.14.99.3) ඇතුළු අනෙකුත් ප්රතිඔක්සිකාරක, සහ thioredoxins (TRXs, EC 1.8.4.10), peroxiredoxins (PRXs, EC 1.11.1.15) සහ glutaredoxins වැනි රෙඩොක්ස් ප්රෝටීන. , පෙනහළු ප්රතිඔක්සිකාරක ආරක්ෂාව සඳහා තීරණාත්මක කාර්යභාරයක් ඉටු කරන බව ද සොයාගෙන ඇත.
සුපර් ඔක්සයිඩ් විවිධ ප්රභවයන්ගෙන් නිපදවන ප්රාථමික ROS වන බැවින්, SOD මගින් එහි විකෘති කිරීම එක් එක් සෛල සඳහා මූලික වැදගත්කමක් දරයි. SOD හි සියලුම ආකාර 3, එනම් CuZn-SOD, Mn-SOD සහ EC-SOD, මිනිස් පෙනහළු තුළ බහුලව ප්රකාශ වේ. Mn-SOD මයිටොකොන්ඩ්රියා අනුකෘතියේ ස්ථානගත කර ඇත. EC-SOD මූලික වශයෙන් බාහිර සෛල අනුකෘතියේ ස්ථානගත කර ඇත, විශේෂයෙන් I වර්ගයේ කොලජන් තන්තු ඉහළ ප්රමාණයක් අඩංගු ප්රදේශවල සහ පෙනහළු සහ පද්ධතිමය භාජන අවට. එය බ්රොන්පයිල් එපිටිලියම්, ඇල්වෙයෝලර් එපිටිලියම් සහ ඇල්වෙයෝලර් මැක්රෝෆේජ් වලද හඳුනාගෙන ඇත.66,67 සමස්තයක් ලෙස, CuZn-SOD සහ Mn-SOD සාමාන්යයෙන් සුපර් ඔක්සයිඩ් රැඩිකල්වල තොග ඉවත් කරන්නන් ලෙස ක්රියා කරයි. පෙනහළු වල සාපේක්ෂ ඉහළ EC-SOD මට්ටම බාහිර සෛල අනුකෘති සංරචක වලට නිශ්චිත බන්ධනය සමඟ පෙනහළු න්යාස ආරක්ෂණයේ මූලික අංගයක් නියෝජනය කරයි.68
SOD වල ක්රියාකාරිත්වය හෝ Xanthine ඔක්සිඩේස් වැනි ඔක්සිඩේස් වල ක්රියාකාරිත්වය මගින් නිපදවන H2O2, උත්ප්රේරක සහ GSH-Px මගින් ජලය බවට අඩු කරයි. කැටලේස් එක සමාන මොනෝමර 4 කින් සමන්විත ටෙට්රාමර් ලෙස පවතී, ඒ සෑම එකක්ම සක්රීය ස්ථානයේ හීම් කාණ්ඩයක් අඩංගු වේ. කැටලේස්-ෆෙරිකටලේස් (ජලයට සම්බන්ධිත යකඩ) සහ I සංයෝගය (ඔක්සිජන් පරමාණුවක් සමඟ සංකීර්ණ වූ යකඩ) 2 අනුකූලතා අතර පරිවර්තනය හරහා H2O2 ක්ෂය වීම සිදු වේ. කැටලේස් එන්සයිමයේ ඔක්සිකාරක අක්රිය වීම (II සංයෝගය සෑදීම) H2O2 මගින් ජලයට අඩු වීම නිසා NADPH අඩු කිරීමේ සමානකමක් ලෙස බන්ධනය කරයි.69
H2O2 සහ ලිපිඩ හයිඩ්රොපෙරොක්සයිඩ් අඩු කිරීම සඳහා වගකිව යුතු රෙඩොක්ස් චක්රයේ එන්සයිම (පටල ලිපිඩ පෙරොක්සයිඩයේ ප්රතිඵලයක් ලෙස ජනනය කරන ලද) GSH-Pxs ඇතුළත් වේ. සක්රීය ස්ථාන සහ H70O2 සහ ලිපිඩ පෙරොක්සයිඩ් ඒවායේ අනුරූප ඇල්කොහොල් වලට අඩු කිරීමට GSH වැනි අඩු අණුක බර තයෝල් භාවිතා කරයි. GSH-Pxs හතරක් විස්තර කර ඇත, විවිධ ජාන මගින් කේතනය කර ඇත: GSH- Px-2 (සෛලීය GSH-Px) සර්වසම්පූර්ණ වන අතර H1O2 සහ මේද අම්ල පෙරොක්සයිඩ් අඩු කරයි, නමුත් එස්ටරීකරණය නොකළ peroxyl lipids.2 Esterified ලිපිඩ පටල-බැඳි GSH මගින් අඩු වේ. -Px-71 (ෆොස්ෆොලිපිඩ් හයිඩ්රොපෙරොක්සයිඩ් GSH-Px), විවිධ අඩු අණුක බර තයෝල් කිහිපයක් අඩු කිරීමේ සමානතා ලෙස භාවිතා කළ හැක. GSH-Px-4 (ආමාශ ආන්ත්රයික GSH-Px) ආහාර පෙරොක්සයිඩ් අඩු කිරීමට සේවය කරන ආමාශ ආන්ත්රයික අපිච්ඡද සෛල තුළ ස්ථානගත කර ඇත.2 GSH-Px-72 (බාහිර GSH-Px) යනු GSH-Px පවුලේ එකම සාමාජිකයා වේ. බාහිර සෛලීය මැදිරිය සහ ක්ෂීරපායීන්ගේ වඩාත් වැදගත් බාහිර සෛල ප්රතිඔක්සිකාරක එන්සයිමයක් ලෙස විශ්වාස කෙරේ. මෙයින්, බාහිර සෛල GSH-Px වඩාත් පුළුල් ලෙස විමර්ශනය කරනු ලබන්නේ මිනිස් පෙනහළු වලය.3
මීට අමතරව, H2O2 බැහැර කිරීම තයෝල් අඩංගු එන්සයිම කිහිපයක් සමඟ සමීපව සම්බන්ධ වේ, එනම්, TRXs (TRX1 සහ TRX2), thioredoxin reductases (EC 1.8.1.9) (TRRs), PRXs (thioredoxin peroxidases) සහ glutaredoxs.74.
සයිටොසෝල් සහ මයිටොකොන්ඩ්රියා යන දෙකෙහිම පවතින මානව සෛල තුළ TRX සහ TRR දෙකක් සංලක්ෂිත වේ. පෙනහළු තුළ, TRX සහ TRR බ්රොන්පයිල් සහ ඇල්ටෙයෝලර් එපිටිලියම් සහ මැක්රෝෆේජ් වල ප්රකාශිත වේ. මිනිස් සෛල තුළ විවිධ PRX හයක් සොයාගෙන ඇති අතර, ඒවායේ අතිව්යුහාත්මක කොටස්කරණයේ වෙනස් වේ. පර්යේෂණාත්මක අධ්යයන මගින් ඇල්ටෙයෝලර් එපිටිලියම් ආරක්ෂා කිරීමේදී PRX VI හි වැදගත්කම අනාවරණය කර ඇත. මිනිස් පෙනහළු බ්රොන්පයිල් එපිටිලියම්, ඇල්ටෙයෝලර් එපිටිලියම් සහ මැක්රෝෆේජ් වල සියලුම පීආර්එක්ස් ප්රකාශ කරයි.75 පීආර්එක්ස් වී මෑතකදී පෙරොක්සයිනයිට්රයිට් රිඩක්ටේස් ලෙස ක්රියා කරන බව සොයාගෙන ඇත, එයින් අදහස් වන්නේ එය ROS-මැදිහත් පෙනහළු තුවාල වර්ධනයේ විභව ආරක්ෂිත සංයෝගයක් ලෙස ක්රියා කළ හැකි බවයි. .76
මෙම ප්රතිඔක්සිකාරක සඳහා පොදු වන්නේ NADPH හි අවශ්යතාවය අඩු කිරීමේ සමාන වේ. NADPH සක්රීය ස්වරූපයෙන් උත්ප්රේරකයක් පවත්වා ගෙන යන අතර GSH-Pxs සඳහා සම උපස්ථරයක් වන GSSG GSH බවට පරිවර්තනය කරන TRX සහ GSH reductase (EC 1.6.4.2) මගින් සහකාරකයක් ලෙස භාවිතා කරයි. අන්තර් සෛලීය NADPH, අනෙක් අතට, ග්ලූකෝස්-1-පොස්පේට් 6-ෆොස්පොග්ලුකොනොලැක්ටෝන් බවට පරිවර්තනය කිරීමේදී පෙන්ටෝස් පොස්පේට් මාර්ගයේ පළමු සහ අනුපාත සීමා කරන එන්සයිමය වන ග්ලූකෝස්-6-පොස්පේට් ඩිහයිඩ්රොජිනේස් මගින් NADP6 අඩු කිරීම මගින් ජනනය වේ. NADPH උත්පාදනය කිරීමෙන්, ග්ලූකෝස්-6-පොස්පේට් ඩිහයිඩ්රොජිනේස් යනු සයිටොසොලික් GSH ස්වාරක්ෂක ධාරිතාවයේ (GSH/GSSG) තීරණාත්මක නිර්ණායකයක් වන අතර, එබැවින්, අත්යවශ්ය, නියාමන ප්රතිඔක්සිකාරක එන්සයිමයක් ලෙස සැලකිය හැකිය.78,79
GSTs (EC 2.5.1.18), තවත් ප්රතිඔක්සිකාරක එන්සයිම පවුලක්, අසංතෘප්ත ඇල්ඩිහයිඩ්, ඉපොක්සයිඩ් සහ හයිඩ්රොපෙරොක්සයිඩ් වැනි ද්විතියික පරිවෘත්තීය අක්රිය කරයි. ජීඑස්ටී වල ප්රධාන පවුල් තුනක් විස්තර කර ඇත: සයිටොසොලික් ජීඑස්ටී, මයිටොකොන්ඩ්රියල් ජීඑස්ටී, 80,81 සහ අයිකොසැනොයිඩ් සහ ජීඑස්එච් පරිවෘත්තීය සඳහා භූමිකාවක් ඇති පටල ආශ්රිත මයික්රොසෝමල් ජීඑස්ටී. 82 ක්ෂීරපායින්, නම් කරන ලද ඇල්ෆා, මු, Pi, Sigma, Theta, Omega, and Zeta.83~86 ආතතියෙන් තොර තත්ත්වයන්හිදී, පන්තියේ Mu සහ Pi GSTs පිළිවෙළින් Ask1 සහ JNK යන kinases සමඟ අන්තර්ක්රියා කරන අතර, මෙම kinases වලක්වනු ලබයි. ඔක්සිකාරක ආතතියට ප්රතිචාර වශයෙන් JNK. 87 GSTP89 PRX VI සමඟ භෞතිකව අන්තර්ක්රියා කරන අතර ඔක්සිකරණය වූ ප්රෝටීන් ග්ලූටතයෝනයිලීකරණය හරහා PRX එන්සයිම ක්රියාකාරීත්වය යථා තත්ත්වයට පත් කරයි.1
එන්සයිම නොවන ප්රතිඔක්සිකාරක
එන්සයිම නොවන ප්රතිඔක්සිකාරකවලට විටමින් (විටමින් C සහ E), බී-කැරොටින්, යූරික් අම්ලය සහ GSH, ට්රයිපෙප්ටයිඩ (Lg-glutamyl-L-cysteinyl-L-glycine) වැනි අඩු අණුක බර සංයෝග ඇතුළත් වේ. සල්ෆයිඩ්රයිල්) කණ්ඩායම.
විටමින් C (ඇස්කෝර්බික් අම්ලය)
ජල-ද්රාව්ය විටමින් C (ඇස්කෝර්බික් අම්ලය) මූලික වශයෙන් ඔක්සිජන් නිදහස් රැඩිකලුන් ඉවත් කිරීම මගින් අන්තර් සෛලීය සහ බාහිර සෛලීය ජලීය-අදියර ප්රතිඔක්සිකාරක ධාරිතාව සපයයි. එය විටමින් E නිදහස් රැඩිකලුන් නැවත විටමින් E බවට පරිවර්තනය කරයි. එහි ප්ලාස්මා මට්ටම වයස සමඟ අඩු වන බව පෙන්වා දී ඇත.91,92
විටමින් ඊ (ඒ-ටොකෝෆෙරෝල්)
ලිපිඩ-ද්රාව්ය විටමින් E සෛල පටලයේ ජලභීතික අභ්යන්තර ස්ථානයේ සංකේන්ද්රණය වී ඇති අතර ඔක්සිකාරක-ප්රේරිත පටල තුවාල වලට එරෙහිව ප්රධාන ආරක්ෂාව වේ. විටමින් E ලිපිඩ පෙරොක්සයිඩ් කිරීමේදී නිපදවන පෙරොක්සිල් රැඩිකල් වෙත ඉලෙක්ට්රෝන පරිත්යාග කරයි. a-Tocopherol යනු විටමින් E හි වඩාත් සක්රීය ආකාරය වන අතර සෛලයේ ඇති ප්රධාන පටලයට බැඳී ඇති ප්රතිඔක්සිකාරකයයි. විටමින් E පිළිකා සෛලවල ඇපොප්ටෝසිස් අවුලුවාලන අතර මුක්ත ඛණ්ඩක සෑදීම වළක්වයි.93
ග්ලූටතයෝන්
GSH සියලුම සෛල මැදිරිවල බහුලව පවතින අතර ප්රධාන ද්රාව්ය ප්රතිඔක්සිකාරකය වේ. GSH/GSSG අනුපාතය ඔක්සිකාරක ආතතියේ ප්රධාන නිර්ණායකයකි. GSH ක්රම කිහිපයකින් එහි ප්රතිඔක්සිකාරක බලපෑම් පෙන්වයි.94 එය GSH-Px ක්රියාව හරහා හයිඩ්රජන් පෙරොක්සයිඩ් සහ ලිපිඩ පෙරොක්සයිඩ් විෂ ඉවත් කරයි. GSH එහි ඉලෙක්ට්රෝනය H2O2 වෙත පරිත්යාග කර එය H2O සහ O2 බවට පත් කරයි. ඉලෙක්ට්රෝන පරිත්යාගශීලියා ලෙස NAD(P)H භාවිතා කරන GSH reductase මගින් GSSG නැවතත් GSH බවට අඩු කරයි. GSH-Pxs ලිපිඩ පෙරොක්සිකරණයෙන් සෛල පටල ආරක්ෂා කිරීම සඳහා ද වැදගත් වේ. අඩු කරන ලද ග්ලූටතයෝන් පටල ලිපිඩවලට ප්රෝටෝන පරිත්යාග කරන අතර ඔක්සිකාරක ප්රහාරවලින් ඒවා ආරක්ෂා කරයි.95
GSH යනු GSH-Px සහ ට්රාන්ස්පෙරේස් වැනි විස නැති කරන එන්සයිම කිහිපයක් සඳහා සහකාරකයකි. විටමින් C සහ E නැවත ඒවායේ ක්රියාකාරී ස්වරූපයට පරිවර්තනය කිරීමේ කාර්යභාරයක් ඇත. GSH ප්රෝපොප්ටෝටික් සහ ප්රති-පොප්ටොටික් සංඥා මාර්ග සමඟ අන්තර්ක්රියා කිරීමෙන් සෛල ඇපොප්ටෝසිස් වලට එරෙහිව ආරක්ෂා කරයි.94 එය AP-1, NF-kB, සහ Sp-1 වැනි පිටපත් කිරීමේ සාධක කිහිපයක් නියාමනය කර සක්රීය කරයි.
කැරොටිනොයිඩ් (b-කැරොටින්)
කැරොටිනොයිඩ් යනු ශාකවල දක්නට ලැබෙන වර්ණක වේ. මූලික වශයෙන්, b-කැරොටින් පෙරොක්සිල් (ROO), හයිඩ්රොක්සයිල් (OH) සහ සුපර් ඔක්සයිඩ් (O22.) රැඩිකල් සමඟ ප්රතික්රියා කරන බව සොයාගෙන ඇත. සාන්ද්රණයන්.96 කැරොටිනොයිඩ් සහ රෙටිනොයික් අම්ල (RAs) යන දෙකම පිටපත් කිරීමේ සාධක නියාමනය කිරීමේ හැකියාව ඇත.97 b-කැරොටීන් ඔක්සිකාරක-ප්රේරිත NF-kB සක්රීය කිරීම සහ ඉන්ටර්ලියුකින් (IL)-98 සහ tumor necrosis factor-a නිෂ්පාදනය වළක්වයි. කැරොටිනොයිඩ් සෛලවල ඇපොප්ටෝසිස් වලටද බලපායි. RA හි Antiproliferative බලපෑම් අධ්යයන කිහිපයකින් පෙන්වා දී ඇත. RA හි මෙම බලපෑම ප්රධාන වශයෙන් රෙටිනොයික් අම්ල ප්රතිග්රාහක මගින් මැදිහත් වන අතර සෛල වර්ග අතර වෙනස් වේ. ක්ෂීරපායී පිළිකා සෛල තුළ, රෙටිනොයික් අම්ල ප්රතිග්රාහකය සෛල චක්රය නැවැත්වීම, ඇපොප්ටෝසිස් හෝ දෙකම ඇති කිරීම මගින් වර්ධනය නිෂේධනය කරන බව පෙන්නුම් කරන ලදී.6
ඔක්සිකාරක ආතතියේ බලපෑම: ජානමය, කායික විද්යාත්මක සහ ජෛව රසායනික යාන්ත්රණ
ප්රතිඔක්සිකාරක ක්ෂය වීම හෝ ROS සමුච්චය වීම නිසා ප්රතිඔක්සිකාරක සහ ROS අතර සමතුලිතතාවය කඩාකප්පල් වූ විට ඔක්සිකාරක ආතතිය ඇතිවේ. ඔක්සිකාරක ආතතිය ඇති වූ විට, සෛල ඔක්සිකාරක බලපෑම් වලට ප්රතිරෝධය දැක්වීමට සහ ජාන කේතනය කරන ආරක්ෂක එන්සයිම, පිටපත් කිරීමේ සාධක සහ ව්යුහාත්මක ප්රෝටීන සක්රිය කිරීම හෝ නිශ්ශබ්ද කිරීම මගින් රෙඩොක්ස් සමතුලිතතාවය යථා තත්ත්වයට පත් කිරීමට උත්සාහ කරයි. ශරීරයේ ඔක්සිකාරක ආතතියේ වැදගත් නිර්ණායක වලින්. ශරීරයේ ROS නිෂ්පාදනය ඉහළ යාමෙන් DNA ව්යුහය වෙනස් විය හැක, ප්රෝටීන සහ ලිපිඩ වෙනස් කිරීම, ආතති-ප්රේරිත පිටපත් කිරීමේ සාධක කිහිපයක් සක්රීය කිරීම සහ ප්රෝ-ගිනි අවුලුවන සහ ප්රති-ගිනි අවුලුවන සයිටොකයින් නිෂ්පාදනය කිරීම.
DNA මත ඔක්සිකාරක ආතතියේ බලපෑම්
ROS හට ක්රම කිහිපයකින් DNA වෙනස් කිරීම් වලට මඟ පෑදිය හැක, එයට භෂ්ම පිරිහීම, තනි හෝ ද්විත්ව නූල් සහිත DNA බිඳීම්, පියුරීන්, පිරමිඩීන් හෝ සීනි සමඟ බැඳුනු වෙනස් කිරීම්, විකෘති කිරීම්, මකාදැමීම් හෝ ස්ථාන මාරු කිරීම් සහ ප්රෝටීන සමඟ හරස් සම්බන්ධ කිරීම ඇතුළත් වේ. මෙම DNA වෙනස් කිරීම් බොහොමයක් (රූපය 1) පිළිකා කාරක, වයස්ගත වීම සහ ස්නායු විකෘතිතා, හෘද වාහිනී සහ ස්වයං ප්රතිශක්තිකරණ රෝග සඳහා බෙහෙවින් අදාළ වේ. දුම්කොළ දුම, රෙඩොක්ස් ලෝහ සහ යකඩ, කැඩ්මියම්, ක්රෝම් සහ ආසනික් වැනි නොවන රෙඩොක්ස් ලෝහ ද නිදහස් රැඩිකලුන් ජනනය කිරීමෙන් හෝ තයෝල් කාණ්ඩ සමඟ බන්ධනය වීමෙන් පිළිකා කාරක සහ වයස්ගත වීමට සම්බන්ධ වේ. 8-OH-G සෑදීම ඔක්සිකාරක ආතතිය හරහා සිදුවන හොඳම DNA හානිය වන අතර එය පිළිකා කාරක සඳහා විභව ජෛව සලකුණු කාරකයකි.
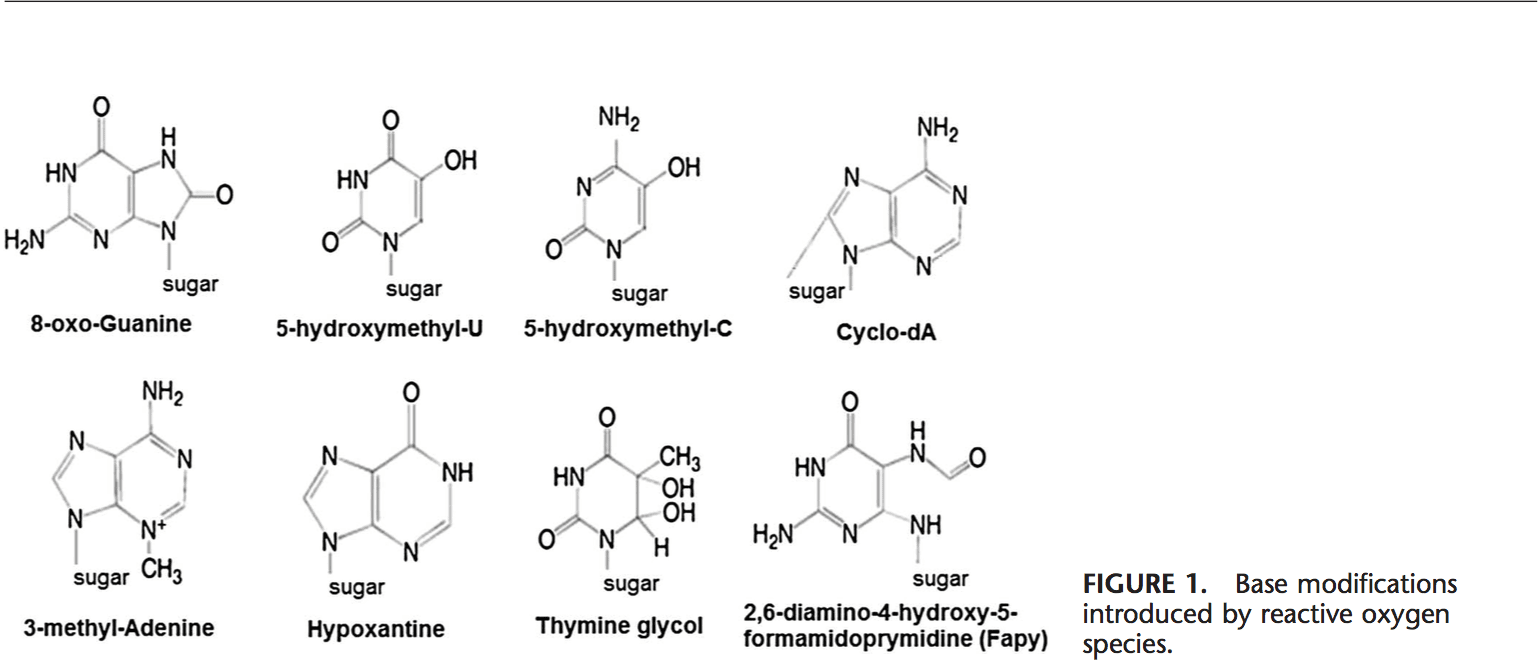
ජානවල ප්රවර්ධක කලාපවල පිටපත් කිරීමේ සාධක සඳහා සම්මුති අනුපිළිවෙල අඩංගු වේ. මෙම පිටපත් කිරීමේ සාධක බන්ධන අඩවි වල ඔක්සිකාරක ප්රහාරවලට ගොදුරු විය හැකි GC පොහොසත් අනුපිළිවෙලවල් අඩංගු වේ. පිටපත් කිරීමේ සාධක බන්ධන අඩවිවල 8-OH-G DNA සෑදීමෙන් පිටපත් කිරීමේ සාධක බන්ධනය වෙනස් කළ හැකි අතර එමඟින් AP-1 සහ Sp-1 ඉලක්ක අනුපිළිවෙල සඳහා පෙන්වා ඇති පරිදි අදාළ ජානවල ප්රකාශනය වෙනස් කළ හැකිය.103 8-OH-G හැර, 8,59 -cyclo-29 -deoxyadenosine (cyclo-dA) ටාටා පෙට්ටියක පිහිටා තිබේ නම් සෛල පද්ධතියක වාර්තාකරු ජානයකින් පිටපත් කිරීම වළක්වන බව ද පෙන්වා දී ඇත. . ටාටා-බන්ධන ප්රෝටීන් බන්ධනය සයික්ලෝ-ඩීඒ පැවතීම නිසා අඩාල විය හැක.
ඔක්සිකාරක ආතතිය මයික්රොසැටලයිට් (කෙටි ටැන්ඩම් පුනරාවර්තන) කලාපවල අස්ථාවරත්වය ඇති කරයි. රෙඩොක්ස් සක්රීය ලෝහ අයන, හයිඩ්රොක්සයිල් රැඩිකලුන් මයික්රොසැටලයිට් අස්ථාවරත්වය වැඩි කරයි. 105 ඔක්සිකාරක තුවාල හේතුවෙන් ඇති වන තනි කෙඳි DNA බිඳීම් සෛලවලට පහසුවෙන් දරාගත හැකි වුවද, අයනීකරණ විකිරණ මගින් ප්රේරණය වන ද්විත්ව නූල් DNA බිඳීම් සෛල පැවැත්මට සැලකිය යුතු තර්ජනයක් විය හැකිය.106
DNA හි CpG දූපත් වල මෙතිලේෂන් යනු ජාන නිශ්ශබ්දතාවයට හේතු විය හැකි වැදගත් එපිජෙනටික් යාන්ත්රණයකි. 5-MeCyt සිට 5-hydroxymethyl uracil (5-OHMeUra) දක්වා ඔක්සිකරණය thymine හෝ 5-hydroxymethyl සයිටොසීන් අතරමැදි වල deamination/oxidation ප්රතික්රියා හරහා සිදු විය හැක. ඔක්සිකාරක ප්රහාර මගින් ප්රේරණය වන විකෘති DNA මෙතිලේෂන් රටා DNA අළුත්වැඩියා කිරීමේ ක්රියාකාරකම් වලටද බලපායි.
ලිපිඩ මත ඔක්සිකාරක ආතතියේ බලපෑම්
ROS හට ලිපිඩ පෙරොක්සයිඩනය ඇති කළ හැකි අතර පටල-බන්ධිත ප්රතිග්රාහක සහ එන්සයිම අක්රිය කළ හැකි සහ පටක පාරගම්යතාව වැඩි කළ හැකි පටල ලිපිඩ ද්වී ස්ථර සැකැස්ම කඩාකප්පල් කළ හැකිය. -linkages.109–110 112-Hydroxy-4-nonenal අන්තර් සෛලීය GSH ක්ෂය වීමට හේතු වන අතර පෙරොක්සයිඩ් නිෂ්පාදනය ප්රේරණය කරයි, 2 epidermal growth factor receptor සක්රීය කරයි, 113,114 සහ ෆයිබ්රොනෙක්ටින් නිෂ්පාදනය ප්රේරණය කරයි. , ඔක්සිකාරක ආතතියේ වක්ර ජෛව සලකුණු ලෙස භාවිතා කර ඇති අතර, නිදන්ගත බාධාකාරී පුඵ්ඵුසීය රෝග රෝගීන්ගේ හෝ දුම් පානය කරන්නන්ගේ ප්රශ්වාස කරන ලද හුස්ම ඝනීභවනය හෝ බ්රොන්කොල්වෝලර් ලෙවේජ් තරලය හෝ පෙනහළුවල වැඩි මට්ටම් පෙන්නුම් කරයි.115-116
ප්රෝටීන් මත ඔක්සිකාරක ආතතියේ බලපෑම්
ROS මගින් පෙප්ටයිඩ දාමයේ ඛණ්ඩනය, ප්රෝටීන වල විද්යුත් ආරෝපණ වෙනස් කිරීම, ප්රෝටීන හරස් සම්බන්ධ කිරීම සහ නිශ්චිත ඇමයිනෝ අම්ල ඔක්සිකරණය සිදු විය හැකි අතර එබැවින් විශේෂිත ප්රෝටීස් මගින් ක්ෂය වීමෙන් ප්රෝටියෝලිසිස් වලට වැඩි සංවේදීතාවයක් ඇති කරයි. විශේෂයෙන් ඔක්සිකරණයට ගොදුරු වේ.120 සල්ෆයිඩ්රයිල් කාණ්ඩවල ඔක්සිකරණය හෝ ප්රෝටීන වල මෙතියොනීන් අපද්රව්ය අනුරූප වෙනස්වීම්, ප්රෝටීන දිගහැරීම සහ හායනය ඇති කරයි. එන්සයිමවල ඔක්සිකාරක වෙනස් කිරීම ඔවුන්ගේ ක්රියාකාරකම් වලක්වන බව පෙන්වා දී ඇත.121
සමහර අවස්ථාවලදී ප්රෝටීන වල නිශ්චිත ඔක්සිකරණයක් සිදු විය හැක. උදාහරණයක් ලෙස, මෙතියොනීන් මෙතියොනීන් සල්ෆොක්සයිඩ්126 සහ ෆීනයිලලනීන් o-tyrosine127 දක්වා ඔක්සිකරණය කළ හැක. ඩයිසල්ෆයිඩ් බන්ධන සෑදීමට සල්ෆයිඩ්රයිල් කාණ්ඩ ඔක්සිකරණය කළ හැක;128 සහ කාබොනයිල් කාණ්ඩ ප්රෝටීන වල පැති දාමයට හඳුන්වා දිය හැක. ගැමා කිරණ, ලෝහ උත්ප්රේරක ඔක්සිකරණය, HOCl සහ ඕසෝන් කාබොනයිල් කාණ්ඩ සෑදීමට හේතු විය හැක.129
සංඥා සම්ප්රේෂණය මත ඔක්සිකාරක ආතතියේ බලපෑම්
ROS හට සංඥා සම්ප්රේෂණයට සම්බන්ධ ජාන කිහිපයක ප්රකාශනයක් ඇති කළ හැක. මෙම අනුපාතය කඩාකප්පල් කිරීම, ගිනි අවුලුවන ප්රතිචාරයට සම්බන්ධ වන NF-kB, AP-1,130, සක්රිය T සෛලවල න්යෂ්ටික සාධකය සහ hypoxia-inducible factor 1 වැනි රෙඩොක්ස් සංවේදී පිටපත් කිරීමේ සාධක සක්රිය කිරීමට හේතු වේ. ROS හරහා පිටපත් කිරීමේ සාධක සක්රිය කිරීම සංඥා සම්ප්රේෂණ කඳුරැල්ල මගින් සාක්ෂාත් කරගනු ලබන අතර එමඟින් පිටත සිට සෛලය තුළට තොරතුරු සම්ප්රේෂණය කරයි. Tyrosine kinase receptors, epidermal growth factor receptor, vascular endothelial growth factor receptor, සහ පට්ටිකා-ව්යුත්පන්න වර්ධන සාධකය සඳහා ප්රතිග්රාහක, ප්රෝටීන් tyrosine phosphatases සහ serine/threonine kinases වැනි වර්ධන සාධක ප්රතිග්රාහක බොහොමයක් ROS.1 හි ඉලක්ක වේ. මයිටොජන්-සක්රීය ප්රෝටීන් කයිනාස් පවුලේ සාමාජිකයන් වන සහ සෛල ප්රගුණනය, අවකලනය සහ ඇපොප්ටෝසිස් ඇතුළු ක්රියාවලීන් කිහිපයකට සම්බන්ධ වන බාහිර සෛලීය සංඥා-නියාමනය කරන ලද kinases, JNK සහ p131 ද ඔක්සිකාරක මගින් නියාමනය කළ හැකිය.
ඔක්සිකාරක ආතති තත්වයන් යටතේ, c-Jun හි DNA බන්ධන ස්ථානයේ ඇති cysteine අවශේෂ, සමහර AP-1 උප ඒකක සහ inhibitory kB kinase ප්රතිවර්ත කළ හැකි S-glutathiolation වලට භාජනය වේ. Glutaredoxin සහ TRX NF-kB සහ AP-1, p38 mitogen-activated protein kinase, සහ JNK.134-137 වැනි රෙඩොක්ස්-සංවේදී සංඥා මාර්ග නියාමනය කිරීමේදී වැදගත් කාර්යභාරයක් ඉටු කරන බව වාර්තා වී ඇත.
ROS, නිදහස් රැඩිකලුන් සහ UV විකිරණ වැනි ඔක්සිකාරක ආතති තත්වයන්ට ප්රතිචාර වශයෙන් NF-kB සක්රිය කළ හැක.138 IkB හි පොස්පරීකරණය NF-kB නිදහස් කර ජාන පිටපත් කිරීම සක්රිය කිරීමට න්යෂ්ටියට ඇතුළු වීමට ඉඩ සලසයි. 139 kinases ගණනාවක් ඇත. සෙරීන් අපද්රව්යවල ෆොස්ෆොරයිලේට් IkB වලට වාර්තා වී ඇත. මෙම kinases NF-kB සක්රිය කිරීම සඳහා ඔක්සිකාරක සංඥා වල ඉලක්ක වේ.140 අඩු කිරීමේ නියෝජිතයන් NF-kB DNA බන්ධනය වැඩි දියුණු කරන අතර ඔක්සිකාරක නියෝජිතයන් NF-kB DNA බන්ධනය වළක්වයි. TRX විසින් NF-kB නියාමනය කිරීමේදී ප්රතිවිරුද්ධ ක්රියා 2ක් සිදු කළ හැක: සයිටොප්ලාස්මයේ, එය IkB හි පිරිහීම අවහිර කරන අතර NF-kB සක්රිය වීම වළක්වයි නමුත් න්යෂ්ටියේ NF-kB DNA බන්ධනය වැඩි දියුණු කරයි. IkB හි ප්රතිඵලයක් ලෙස ප්රතිඔක්සිකාරක ආරක්ෂක ආශ්රිත ජාන කිහිපයක් සක්රීය කරයි. NF-kB මගින් IL-141b, IL-1, tumor necrosis factor-a, IL-6, සහ adhesion අණු කිහිපයක් වැනි ප්රතිශක්තිකරණ ප්රතිචාරයට සහභාගී වන ජාන කිහිපයක ප්රකාශනය නියාමනය කරයි.8 NF-kB මගින් ඇන්ජියෝජෙනසිස් සහ ව්යාප්තිය සහ සෛල වෙනස් කිරීම.
AP-1 රෙඩොක්ස් තත්වය මගින් ද නියාමනය කරනු ලැබේ. H2O2 පවතින විට, සමහර ලෝහ අයන AP-1 සක්රිය කිරීමට පෙළඹවිය හැක. GSH/GSSG අනුපාතයේ වැඩි වීම AP-1 බන්ධනය වැඩි දියුණු කරන අතර GSSG මගින් AP-1.144 DNA බන්ධනය වළක්වයි Fos/Jun heterodimer DNA බන්ධනය එක් එක් DNA බන්ධන වසමෙහි තනි සංරක්ෂිත සිස්ටීන් අඩු කිරීම මගින් වැඩි වේ. ප්රෝටීන, 145 අතර AP-1 DNA බන්ධනය බොහෝ සෛල වර්ග වල GSSG මගින් නිෂේධනය කළ හැකි අතර, සිස්ටීන් අවශේෂ මගින් ඩයිසල්ෆයිඩ් බන්ධන සෑදීම AP-1 DNA බන්ධනය වළක්වන බව යෝජනා කරයි.146,147 ඔක්සිකාරක ආතතිය හරහා සංඥා සම්ප්රේෂණය රූප සටහන 2 හි සාරාංශ කර ඇත.
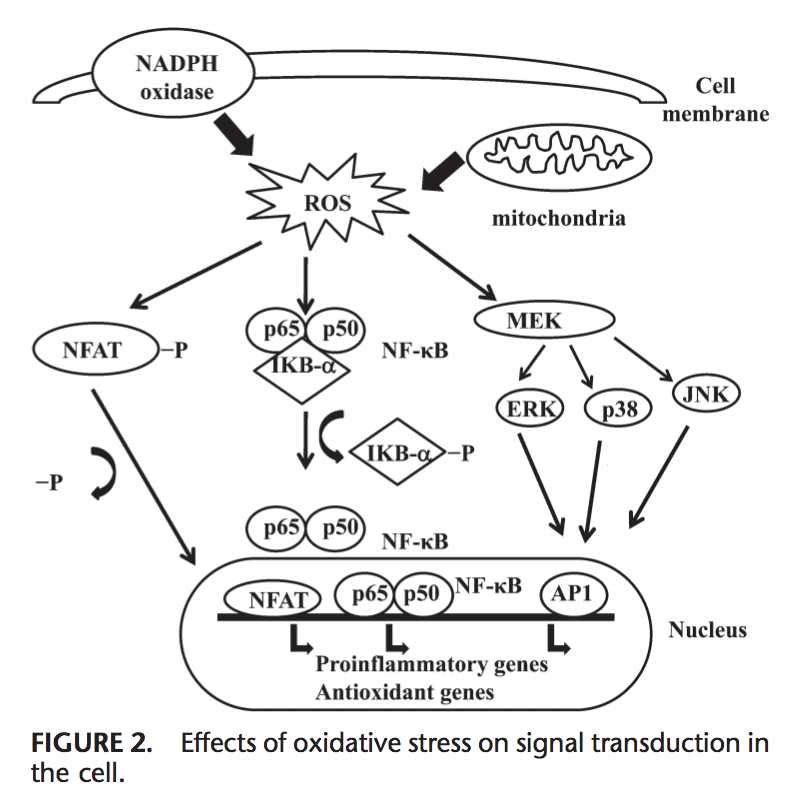
නිගමනය
ඔක්සිජන් භාවිතා කරන පරිවෘත්තීය ප්රතික්රියා මගින් ROS අධික ලෙස නිපදවීමෙන් ඔක්සිකාරක ආතතිය ඇති විය හැකි අතර ඒවා අතර සමතුලිතතාවය මාරු කරයි. ඔක්සිකාරක/ප්රතිඔක්සිකාරකය ඔක්සිකාරක වලට පක්ෂව තත්වයන්. ROS නිපදවනු ලබන්නේ සෛලීය පරිවෘත්තීය ක්රියාකාරකම් සහ වායු දූෂක හෝ සිගරට් දුම වැනි පාරිසරික සාධක මගිනි. ROS ඉතා ප්රතික්රියාශීලී අණු වන්නේ ඒවායේ ව්යුහයේ යුගල නොකළ ඉලෙක්ට්රෝන නිසා වන අතර සෛල තුළ ඇති කාබෝහයිඩ්රේට්, න්යෂ්ටික අම්ල, ලිපිඩ සහ ප්රෝටීන වැනි ජීව විද්යාත්මක සාර්ව අණු කිහිපයක් සමඟ ප්රතික්රියා කර ඒවායේ ක්රියාකාරිත්වය වෙනස් කරයි. රෙඩොක්ස් සංවේදී පිටපත් කිරීමේ සාධක නියාමනය කිරීම සහ histone acetylation/ deacetylation වෙනස් කිරීම හරහා chromatin ප්රතිනිර්මාණය කිරීම මගින් ROS ජාන කිහිපයක ප්රකාශනයට ද බලපායි. සෛල ශක්යතාව, සක්රීය කිරීම, ව්යාප්තිය සහ ඉන්ද්රිය ක්රියාකාරිත්වය සඳහා රෙඩොක්ස් තත්ත්වය නියාමනය කිරීම ඉතා වැදගත් වේ.
ආශ්රිත
1. Valko M, Rhodes CJ, Moncol J, Izakovic M, Mazur M. ඔක්සිකාරක ආතතියෙන් ඇතිවන පිළිකා වල නිදහස් රැඩිකලුන්, ලෝහ සහ ප්රතිඔක්සිකාරක. Chem Biol අන්තර්ක්රියා. 2006;160:1-40.
2. හැලිවෙල් බී, ගුටෙරිජ් ජේඑම්සී. ජීව විද්යාව සහ වෛද්ය විද්යාවේ නිදහස් රැඩිකලුන්. 3 වන සංස්කරණය නිව් යෝර්ක්: ඔක්ස්ෆර්ඩ් විශ්වවිද්යාල මුද්රණාලය;1999.
3. Marnett LJ. Malondialdehyde මගින් ලිපිඩ පෙරොක්සයිඩ් DNA හානි. Mutat Res. 1999;424:83-95.
4. Siems WG, Grune T, Esterbauer H. 4-Hydroxynonenal සෑදීමේදී ischemia සහ මීයන් කුඩා අන්ත්රයේ ප්රතිවර්තනය වීම. �ජීවිත විද්යාව. 1995;57:785-789.
5. ස්ටැඩ්මන් ඊආර්. වයසට යාමේදී ඔක්සිකාරක විශේෂවල කාර්යභාරය. Curr Med Chem. 2004;11:1105-1112.
6. Wang MY, Dhingra K, Hittelman WN, Liehr JG, deAndrade M, Li DH. ලිපිඩ පෙරොක්සයිඩ් ප්රේරිත මැලෝන්ඩියල්ඩිහයිඩ් DNA මිනිස් පියයුරු පටක වලට එකතු කරයි. පිළිකා වසංගත Biomarkers පෙර. 1996;5:705-710.
7. ජෙනර් පී. පාකින්සන් රෝගයේ ඔක්සිකාරක ආතතිය. ඈන් නියුරෝල්. 2003;53: S26-S36.
8. Lyras L, Cairns NJ, Jenner A, Jenner P, Halliwell B. ඇල්සයිමර් රෝගය ඇති රෝගීන්ගෙන් මොළයේ ඇති ප්රෝටීන, ලිපිඩ සහ DNA වලට ඔක්සිකාරක හානි තක්සේරු කිරීම. ජේ නියුරොකෙමි. 1997;68:2061-2069.
9. සයර් එල්එම්, ස්මිත් එම්ඒ, පෙරී ජී රසායන විද්යාව සහ ස්නායු විකෘතිතා රෝගයේ ඔක්සිකාරක ආතතියේ ජෛව රසායනය. Curr Med Chem. 2001;8:721-738.
10. Toshniwal PK, Zarling EJ. බහු ස්ක්ලේරෝසිස් වල ලිපිඩ පෙරොක්සයිඩ් වැඩි වීම සඳහා සාක්ෂි. Neurochem Res. 1992;17:205-207.
11. Dhalla NS, Temsah RM, Netticadan T. හෘද වාහිනී රෝග සඳහා ඔක්සිකාරක ආතතියේ භූමිකාව. ජේ හයිපර්ටෙන්ස්. 2000;18:655-673.
12. Kasparova S, Brezova V, Valko M, Horecky J, Mlynarik V, et al. නිදන්ගත මොළයේ හයිපෝපර්ෆියුෂන් හි මී ආකෘතියක ඔක්සිකාරක ආතතිය පිළිබඳ අධ්යයනය. Neurochem Int. 2005;46:601-611.
13. Kerr S, Brosnan MJ, McIntyre M, Reid JL, Dominiczak AF, Hamilton CA. ජාන අධි රුධිර පීඩනයේ ආකෘතියක් තුළ සුපර් ඔක්සයිඩ් ඇනායන නිෂ්පාදනය වැඩි වේ: එන්ඩොතලියම් වල භූමිකාව. අධි රුධිර පීඩනය. 1999;33:1353-1358.
14. Kukreja RC, Hess ML. ඔක්සිජන් නිදහස් රැඩිකල් පද්ධතිය: සමීකරණ සිට පටල ප්රෝටීන් අන්තර්ක්රියා හරහා හෘද වාහිනී තුවාල සහ ආරක්ෂාව දක්වා. හෘද වාහිනී Res. 1992;26:641-655.
15. Asami S, Manabe H, Miyake J, Tsurudome Y, Hirano T, et al. සිගරට් දුම්පානය මිනිස් පෙනහළු වල කේන්ද්රීය ස්ථානයක ඔක්සිකාරක DNA හානි, 8-hydroxydeoxyguanosine වැඩි වීමක් ඇති කරයි. පිළිකා කාරකය. 1997;18:1763-1766.
16. Andreadis AA, Hazen SL, Comhair SA, Erzurum SC. ඇදුම තුළ ඔක්සිකාරක සහ නයිට්රොසයිට් සිදුවීම්. නොමිලේ Radic Biol Med. 2003;35:213-225.
17. Comhair SA, Ricci KS, Arroliga M, Lara AR, Dweik RA, et al. පද්ධතිමය සුපර් ඔක්සයිඩ් ඩිස්මියුටේස් ඌනතාවය සහ ඇදුම තුළ වායු ප්රවාහ අවහිරතා අතර සහසම්බන්ධය. Am J Respir Crit Care Med. 2005;172:306-313.
18. Comhair SA, Xu W, Ghosh S, Thunnissen FB, Almasan A, et al. ඇදුම ශ්වසන මාර්ගය ප්රතිනිර්මාණය කිරීම සහ ප්රතික්රියාකාරිත්වය පිළිබඳ ව්යාධි භෞතවේදයේ සුපර් ඔක්සයිඩ් ඩිස්මියුටේස් අක්රිය වීම. ඇම් ජේ පතෝල්. 2005;166:663-674.
19. Dut R, Dizdar EA, Birben E, Sackesen C, Soyer OU, Besler T, Kalayci O. ඔක්සිකාරක ආතතිය සහ ඇදුම සහිත දරුවන්ගේ ශ්වසන මාර්ගයේ එහි නිර්ණායක. අසාත්මිකතා. 2008;63:1605-1609.
20. Ercan H, Birben E, Dizdar EA, Keskin O, Karaaslan C, et al. ළමා ඇදුම තුළ ඔක්සිකාරක තුවාලයේ ඔක්සිකාරක ආතතිය සහ ජානමය සහ වසංගත නිර්ණායක. J අසාත්මිකතා ක්ලින් Immunol. 2006;118:1097-1104.
21. Fitzpatrick AM, Teague WG, Holguin F, Yeh M, Brown LA. දරුණු ඇදුම පර්යේෂණ වැඩසටහන. දරුණු ඇදුම සහිත ළමුන් තුළ වාතයේ ග්ලූටතයෝන් හෝමියස්ටැසිස් වෙනස් වේ: ඔක්සිකාරක ආතතිය සඳහා සාක්ෂි. J අසාත්මිකතා ක්ලින් Immunol. 2009;123:146-152.
22. Miller DM, Buettner GR, Aust SD. "ස්වයංක්රීයකරණ" ප්රතික්රියා වල උත්ප්රේරක ලෙස සංක්රාන්ති ලෝහ. නොමිලේ Radic Biol Med. 1990;8:95-108.
23. Dupuy C, Virion A, Ohayon R, Kaniewski J, D'me D, Pommier J. තයිරොයිඩ් ප්ලාස්මා පටලයේ NADPH ඔක්සිඩේස් මගින් උත්ප්රේරක හයිඩ්රජන් පෙරොක්සයිඩ් සෑදීමේ යාන්ත්රණය. J Biol Chem. 1991;266:3739-3743.
24. Granger DN. ischemiareperfusion තුවාලයේ Xanthine oxidase සහ granulocytes වල කාර්යභාරය. ඇම් ජේ ෆිසියෝල්. 1988;255:H1269-H1275.
25. Fenton HJH. යකඩ ඉදිරියේ ටාටරික් අම්ලය ඔක්සිකරණය වීම. J Chem Soc. 1984;65:899-910.
26. Haber F, Weiss JJ. යකඩ ලවණ මගින් හයිඩ්රජන් පෙරොක්සයිඩ් උත්ප්රේරක වියෝජනය වීම. Proc R Soc Lond Ser A. 1934;147:332-351.
27. Liochev SI, Fridovich I. Haber'Weiss වසර 70කට පසු බයිසිකල් පැදීම: විකල්ප දැක්මක්. රෙඩොක්ස් රෙප් 2002;7:55-57.
28. ක්ලෙබනොෆ් එස්.ජේ. Myeloperoxidase: මිතුරා සහ සතුරා. J Leukoc Biol. 2005;77:598-625.
29. වයිට්මන් එම්, ජෙනර් ඒ, හැලිවෙල් බී. හුදකලා කැල්ෆ් තයිමස් ඩීඑන්ඒ හි හයිපොක්ලෝරස් අම්ල-ප්රේරිත පාදක වෙනස් කිරීම්. Chem Res Toxicol. 1997;10:1240-1246.
30. Kulcharyk PA, Heinecke JW. මානව ෆාගෝසයිට් වල මයිලෝපෙරොක්සිඩේස් පද්ධතිය මගින් නිපදවන හයිපොක්ලෝරස් අම්ලය DNA සහ ප්රෝටීන අතර සහසංයුජ හරස් සම්බන්ධතා ඇති කරයි. ජෛව රසායනය. 2001;40:3648-3656.
31. Brennan ML, Wu W, Fu X, Shen Z, Song W, et al. මතභේද දෙකක කතාවකි: eosinophil peroxidase සහ myeloperoxidase deficient මීයන් භාවිතයෙන් vivo තුළ නයිට්රොටිරොසීන් සෑදීමේදී පෙරොක්සිඩේස් වල භූමිකාව සහ පෙරොක්සිඩේස් ජනනය කරන ලද ප්රතික්රියාශීලී නයිට්රජන් විශේෂවල ස්වභාවය යන දෙකම නිර්වචනය කිරීම. J Biol Chem. 2002;277:17415-17427.
32. Denzler KL, Borchers MT, Crosby JR, Cieslewicz G, Hines EM, et al. පුඵ්ඵුසීය ප්රදාහයේ මූසික ඕවල්බුමින්-අභියෝග ආකෘතියක් තුළ පුළුල් eosinophil degranulation සහ ගුවන් මාර්ග ප්රෝටීන වල peroxidase-මැදිහත් ඔක්සිකරණය සිදු නොවේ. J Immunol. 2001;167:1672-1682.
33. van Dalen CJ, Winterbourn CC, Senthilmohan R, Kettle AJ. නයිට්රයිට් මයිලෝපෙරොක්සිඩේස් උපස්ථරයක් සහ නිෂේධකයක් ලෙස. දැවිල්ල ඇති ස්ථානවල නයිට්රේෂන් සහ හයිපොක්ලෝරස් අම්ල නිෂ්පාදනය සඳහා ඇඟවුම්. J Biol Chem. 2000;275:11638-11644.
34. Wood LG, Fitzgerald DA, Gibson PG, Cooper DM, Garg ML. ප්ලාස්මා අයිසොප්රොස්ටේන් විසින් තීරණය කරන ලද ලිපිඩ පෙරොක්සයිඩ් මෘදු ඇදුම රෝගයේ බරපතලකමට සම්බන්ධ වේ. ලිපිඩ. 2000;35:967-974.
35. Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. ඇදුම රෝගීන්ගේ පිට කරන ලද ඝනීභවනය තුළ ඔක්සිකාරක ආතතියේ සලකුණක් වන 8-isoprostane වැඩි වීම. Am J Respir Crit Care Med. 1999;160:216-220.
36. පල්ලියේ DF, ප්රියර් ඩබ්ලිව්.ඒ. සිගරට් දුමෙහි නිදහස් රැඩිකල් රසායනය සහ එහි විෂ විද්යාත්මක ඇඟවුම්. පාරිසරික සෞඛ්ය ඉදිරිදර්ශනය. 1985;64:111-126.
37. Hiltermann JT, Lapperre TS, van Bree L, Steerenberg PA, Brahim JJ, et al. ඇදුම රෝගීන්ගෙන් ස්පුටම් සහ බ්රොන්පයිල් වොජ් තරලය තුළ ඕසෝන් ප්රේරිත දැවිල්ල තක්සේරු කර ඇත: වායු දූෂණය සහ ඇදුම පිළිබඳ වසංගත රෝග අධ්යයනයන්හි නව ආක්රමණශීලී නොවන මෙවලමක්. නොමිලේ Radic Biol Med. 1999;27:1448-1454.
38. නයිටිංගේල් JA, Rogers DF, Barnes PJ. සාමාන්ය සහ ඇදුම රෝගීන් තුළ පිටවන නයිට්රික් ඔක්සයිඩ්, පෙනහළු ක්රියාකාරිත්වය සහ ප්රේරිත ස්පුටම් මත ආශ්වාස කරන ලද ඕසෝන් වල බලපෑම. තෝරැක්ස්. 1999;54:1061-1069.
39. Cho AK, Sioutas C, Miguel AH, Kumagai Y, Schmitz DA, et al. ලොස් ඇන්ජලීස් ද්රෝණියේ විවිධ ස්ථානවල වාතයේ ඇති අංශු ද්රව්යවල රෙඩොක්ස් ක්රියාකාරිත්වය. පරිසර Res. 2005;99:40-47.
40. Comhair SA, Thomassen MJ, Erzurum SC. 2% O(100) හෝ සිගරට් දුමකට නිරාවරණය වන නිරෝගී පුද්ගලයන්ගේ ශ්වසන මාර්ගවල බාහිර සෛලීය ග්ලූටතයෝන් පෙරොක්සිඩේස් සහ නයිට්රික් ඔක්සයිඩ් සින්තේස් 2 වෙනස් ප්රේරණය කිරීම. Am J Respir Cell Mol Biol. 2000;23:350-354.
41. Matthay MA, Geiser T, Matalon S, Ischiropoulos H. උග්ර ශ්වසන අපහසුතා සින්ඩ්රෝමය තුළ ඔක්සිකාරක-මැදිහත් පෙනහළු තුවාල වීම. Crit Care Med. 1999;27:2028-2030.
42. Biaglow JE, Mitchell JB, Hold K. X-ray ප්රතිචාරයේ පෙරොක්සයිඩ් සහ සුපර් ඔක්සයිඩ් වල වැදගත්කම. Int J Radiat Oncol Biol Phys. 1992;22:665-669.
43. Chiu SM, Xue LY, Friedman LR, Oleinick NL. න්යෂ්ටික අනුකෘති ඇමිණුම් ස්ථානවල තඹ අයන මධ්යස්ථ සංවේදීකරණය අයනීකරණ විකිරණයට. ජෛව රසායනය. 1993;32:6214-6219.
44. නාරායනන් PK, Goodwin EH, Lehnert BE. ඇල්ෆා අංශු මිනිස් සෛල තුළ සුපර් ඔක්සයිඩ් ඇනායන සහ හයිඩ්රජන් පෙරොක්සයිඩ් ජීව විද්යාත්මක නිෂ්පාදනය ආරම්භ කරයි. පිළිකා Res. 1997;57:3963-3971.
45. Tuttle SW, Varnes ME, Mitchell JB, Biaglow JE. රසායනික ඔක්සිකාරක වලට සංවේදීතාව සහ ඔක්සිකාරක පෙන්ටෝස් චක්රයේ ක්රියාකාරිත්වයේ ඌනතාවයෙන් යුත් CHO සෛල රේඛා වල විකිරණ. Int J Radiat Oncol Biol Phys. 1992;22: 671-675.
46. Guo G, Yan-Sanders Y, Lyn-Cook BD, Wang T, Tamae D, et al. මැංගනීස්
විකිරණ ප්රේරිත සුපර් ඔක්සයිඩ් ඩිස්මියුටේස්-මැදිහත් ජාන ප්රකාශනය
අනුවර්තන ප්රතිචාර. Mol සෛල Biol. 2003;23:2362-2378.
47. Azzam EI, de Toledo SM, Spitz DR, Little JB. ඔක්සිකාරක පරිවෘත්තීය
සංඥා සම්ප්රේෂණය සහ ක්ෂුද්ර න්යෂ්ටිය සැදීම මොඩියුලේට් කරයි
a-අංශු විකිරණ සාමාන්ය මානව ෆයිබ්රොබ්ලාස්ට් වලින් සෛල. පිළිකා Res.
2002;62:5436-5442.
48. Leach JK, Van Tuyle G, Lin PS, Schmidt-Ullrich R, Mikkelsen RB.
අයනීකරණ විකිරණ ප්රේරිත, මයිටොකොන්ඩ්රියා මත යැපෙන ප්රතික්රියා උත්පාදනය
ඔක්සිජන් / නයිට්රජන්. පිළිකා Res. 2001;61:3894-3901.
49. Dent P, Yacoub A, Fisher PB, Hagan MP, Grant S. MAPK මාර්ග
විකිරණ ප්රතිචාර. ඔන්කොජීන්. 2003;22:5885-5896.
50. Wei SJ, Botero A, Hirota K, Bradbury CM, Markovina S, et al. තයොරෙඩොක්සින්
න්යෂ්ටික මාරු කිරීම සහ රෙඩොක්ස් සාධකය-1 සමඟ අන්තර්ක්රියා කිරීම අයනීකරණ විකිරණවලට ප්රතිචාර වශයෙන් AP-1 පිටපත් කිරීමේ සාධකය සක්රීය කරයි. පිළිකා Res. 2000;60:6688-6695.
51. කැඩෙට් ජේ, ඩූකි ටී, ගස්පරුට්ටෝ ඩී, රාවනාට් ජේඑල්. DNA වලට ඔක්සිකාරක හානි: ගොඩනැගීම, මැනීම සහ ජෛව රසායනික ලක්ෂණ. Mutat Res. 2003;531:5-23.
52. Yokoya A, Cunniffe SM, O'Neill P. ගැමරේඩියේෂන් මගින් ප්ලාස්මිඩ් DNA පටලවල නූල් බිඳීම් සහ පාදක තුවාල ඇතිවීමට සජලනය කිරීමේ බලපෑම. J Am Chem Soc. 2002;124:8859-8866.
53. Janssen YM, Van Houten B, Borm PJ, Mossman BT. ඔක්සිකාරක හානි සඳහා සෛල හා පටක ප්රතිචාර. රසායනාගාර ආයෝජන. 1993;69:261-274.
54. Iwanaga M, Mori K, Iida T, Urata Y, Matsuo T, et al. T98G මානව ග්ලියෝබ්ලාස්ටෝමා සෛලවල අයනීකරණ විකිරණ මගින් ගැමා ග්ලූටමිල්සයිස්ටයින් සින්තටේස් න්යෂ්ටික සාධකය කප්පා බී මත යැපෙන ප්රේරණය. නොමිලේ Radic Biol Med. 1998;24:1256-1268.
55. Stohs SJ, Bagchi D. ලෝහ අයනවල විෂ සහිත ඔක්සිකාරක යාන්ත්රණ. නොමිලේ Radic Biol Med. 1995;18:321-336.
56. ලෙනාඩ් එස්එස්, හැරිස් ජීකේ, ෂි එක්ස්. ලෝහ ප්රේරිත ඔක්සිකාරක ආතතිය සහ සංඥා සම්ප්රේෂණය. නොමිලේ Radic Biol Med. 2004;37:1921-1942.
57. Shi H, Shi X, Liu KJ. ආසනික් විෂ වීම සහ පිළිකා කාරක ඔක්සිකාරක යාන්ත්රණය. Mol සෛල ජෛව රසායනය. 2004;255:67-78.
58. Pi J, Horiguchi S, Sun Y, Nikaido M, Shimojo N, Hayashi ටී නිදහස් Radic Biol Med.2003;35:102-113.
59. Rin K, Kawaguchi K, Yamanaka K, Tezuka M, Oku N, Okada S. අකාබනික ආසනික් වල පරිවෘත්තීය ද්රව්යයක් වන dimethylarsinic අම්ලය මගින් ප්රේරිත DNAstrand බිඳීම්, superoxide anion radicals මගින් දැඩි ලෙස වැඩි දියුණු කර ඇත. Biol Pharm Bull. 1995;18:45-58.
60. Waalkes MP, Liu J, Ward JM, Diwan LA. ආසනික් පිළිකා කාරකයට යටින් පවතින යාන්ත්රණ: ගර්භණී සමයේදී අකාබනික ආසනික් වලට නිරාවරණය වන මීයන්ගේ අධි සංවේදීතාව. විෂ විද්යාව. 2004;198:31-38.
61. Schiller CM, Fowler BA, Woods JS. පයිරුවේට් ඩිහයිඩ්රොජිනේස් සක්රීය කිරීම කෙරෙහි ආසනික් වල බලපෑම. පාරිසරික සෞඛ්ය ඉදිරිදර්ශනය. 1977;19:205-207.
62. Monterio HP, Bechara EJH, Abdalla DSP. ස්නායු පෝර්ෆිරියා සහ ඊයම් විෂ වීම සඳහා නිදහස් රැඩිකලුන් සම්බන්ධ වීම. Mol සෛල ජෛව රසායනය. 1991;103:73-83.
63. Tripathi RM, Raghunath R, Mahapatra S. රුධිර ඊයම් සහ Cd, Cu, Zn, Fe සහ දරුවන්ගේ හිමොග්ලොබින් මට්ටම් කෙරෙහි එහි බලපෑම. Sci සමස්ත පරිසරය. 2001;277:161-168.
64. Nehru B, Dua R. ඊයම් නියුරෝටොක්සිසිටි මත ආහාර සෙලේනියම් වල බලපෑම. J Environ Pathol Toxicol Oncol. 1997;16:47-50.
65. රීඩ් ටීඑම්, ෆීග් ඩීඅයි, ලෝබ් එල්ඒ. ලෝහ ප්රේරිත ඔක්සිජන් රැඩිකල් මගින් විකෘති වීම. පාරිසරික සෞඛ්ය ඉදිරිදර්ශනය. 1994;102(සැපයුම 3):57-61.
66. කින්නුල වීඑල්, ක්රාපෝ ජේඩී. පෙනහළු සහ මිනිස් පෙනහළු රෝග වල Superoxide dismutases. Am J Respir Crit Care Med. 2003;167:1600-1619.
67. කින්නුල වී.එල්. මිනිස් පෙනහළු වල ඇතිවන ගිනි අවුලුවන තත්වයන් තුළ ඔක්සිජන් පරිවෘත්තීය නිෂ්පාදනය හා ක්ෂය වීම. Curr ඖෂධය ගිනි අවුලුවන අසාත්මිකතාව ඉලක්ක කරයි. 2005;4:465-470.
68. Zelko IN, Mariani TJ, Folz RJ. Superoxide dismutase multigene පවුල: CuZn-SOD (SOD1), Mn-SOD (SOD2) සහ EC-SOD (SOD3) ජාන ව්යුහයන්, පරිණාමය සහ ප්රකාශනය සංසන්දනය කිරීම. නොමිලේ Radic Biol Med. 2002;33:337-349.
69. කිර්ක්මන් එච්එන්, රොල්ෆෝ එම්, ෆෙරාරිස් ඒඑම්, ගීතානි ජීඑෆ්. NADPH මගින් කැටලේස් ආරක්ෂා කිරීමේ යාන්ත්රණ. චාලක විද්යාව සහ ස්ටෝචියෝමිතිය. J Biol Chem. 1999;274:13908-13914.
70. ෆ්ලෝහ් L. ග්ලූටතයෝන් පෙරොක්සිඩේස්. මූලික ජීවිත විද්යාව. 1988;49:663-668.
71. ආතර් ජේ.ආර්. ග්ලූටතයෝන් පෙරොක්සිඩේස්. සෛල Mol Life Sci. 2000;57:1825-1835.
72. Chu FF, Doroshow JH, Esworthy RS. නව සෛලීය සෙලේනියම් මත යැපෙන ග්ලූටතයෝන් පෙරොක්සිඩේස්, GSHPx-GI ප්රකාශනය, ගුනාංගීකරනය සහ පටක ව්යාප්තිය. J Biol Chem. 1993;268:2571-2576.
73. Comhair SA, Bhathena PR, Farver C, Thunnissen FB, Erzurum SC. ඇදුම පෙණහලුවල බාහිර සෛලීය ග්ලූටතයෝන් පෙරොක්සයිඩේස් ප්රේරණය: මානව වාහක එපිටිලියල් සෛලවල ප්රකාශනය රෙඩොක්ස් නියාමනය සඳහා සාක්ෂි. FASEB J. 2001;15:70-78.
74. Gromer S, Urig S, Becker K. The thioredoxin systemdd from science to clinic. මෙඩ් රෙස් 2004;24:40-89.
75. Kinnula VL, Lehtonen S, Kaarteenaho-Wiik R, Lakari E, P''kk' P, et al. මිනිස් පෙනහළු සහ පෙනහළු සාර්කොයිඩෝසිස් වල පෙරොක්සිරෙඩොක්සින් වල සෛල විශේෂිත ප්රකාශනය. තෝරැක්ස්. 2002;57:157-164.
76. Dubuisson M, Vander Stricht D, Clippe A, Etienne F, Nauser T, et al. මානව පෙරොක්සිරෙඩොක්සින් 5 යනු පෙරොක්සයිනයිට්රයිට් නිශ්පාදනයකි. FEBS Lett. 2004;571:161-165.
77. Holmgren A. thioredoxin සහ glutaredoxin පද්ධතිවල ප්රතිඔක්සිකාරක ක්රියාකාරිත්වය. ප්රතිඔක්සිකාරක රෙඩොක්ස් සංඥාව. 2000;2:811-820.
78. ඩිකින්සන් ඩීඒ, ෆෝමන් එච්. Glutathione ආරක්ෂා කිරීම සහ සංඥා කිරීම: කුඩා thiol වලින් පාඩම්. Ann NY Acad Sci. 2002;973:488-504.
79. Sies H. Glutathione සහ සෛලීය ක්රියාකාරකම් වල එහි කාර්යභාරය. නොමිලේ Radic Biol Med. 1999;27:916-921.
80. Ladner JE, Parsons JF, Rife CL, Gilliland GL, Armstrong RN. ග්ලූටතයෝන් මාරු කිරීම් සඳහා සමාන්තර පරිණාමීය මාර්ග: මයිටොකොන්ඩ්රියල් පන්තියේ කප්පා එන්සයිම rGSTK1-1 හි ව්යුහය සහ යාන්ත්රණය. ජෛව රසායනය. 2004;43:52-61.
81. රොබින්සන් ඒ, හට්ලි ජීඒ, බූත් එච්එස්, බෝඩ් පීජී. මානව කප්පා පන්තියේ ග්ලූටතයෝන් ට්රාන්ස්ෆෙරේස් හි ආකෘති නිර්මාණය සහ ජෛව තොරතුරු අධ්යයනයන් මගින් ප්රොකැරියෝටික් 2-හයිඩ්රොක්සික්රෝමීන්-2-කාබොක්සිලේට් සමාවයවිකයට සමජාතීය විද්යාව සහිත නව තෙවැනි ට්රාන්ස්ෆෙරේස් පවුලක් පුරෝකථනය කරයි. Biochem J. 2004;379:541-552.
82. Jakobsson PJ, Morgenstern R, Mancini J, Ford-Hutchinson A, Persson B. Eicosanoid සහ glutathione පරිවෘත්තීය ක්රියාවලියේ ඉතා අපසරන ක්රියාකාරකම් සහිත පටල ආශ්රිත ප්රෝටීන වල MAPEGda පුලුල්ව පැතිරුනු සුපිරි පවුලක පොදු ව්යුහාත්මක ලක්ෂණ. ප්රෝටීන Sci. 1999;8:689-692.
83. Hayes JD, Pulford DJ. Glutathione S-transferase supergene පවුල: GST නියාමනය සහ පිළිකා රසායනික ආරක්ෂණය සහ ඖෂධ ප්රතිරෝධය සඳහා isoenzymes වල දායකත්වය. Crit Rev Biochem Mol Biol. 1995;30:445-600.
84. ආම්ස්ට්රෝං ආර්එන්. ග්ලූටතයෝන් මාරුකිරීම්වල ව්යුහය, උත්ප්රේරක යාන්ත්රණය සහ පරිණාමය. Chem Res Toxicol. 1997;10:2-18.
85. Hayes JD, McLellan LI. ග්ලූටතයෝන් සහ ග්ලූටතයෝන් මත යැපෙන එන්සයිම ඔක්සිකාරක ආතතියට එරෙහිව සම්බන්ධීකරණයෙන් නියාමනය කරන ලද ආරක්ෂාවක් නියෝජනය කරයි. නොමිලේ Radic Res. 1999;31:273-300.
86. Sheehan D, Meade G, Foley VM, Dowd CA. ග්ලූටතයෝන් මාරුකිරීම්වල ව්යුහය, ක්රියාකාරිත්වය සහ පරිණාමය: පුරාණ එන්සයිම සුපිරි පවුලක ක්ෂීරපායී නොවන සාමාජිකයන් වර්ගීකරණය සඳහා ඇඟවුම්. Biochem J. 2001;360:1-16.
87. Cho SG, Lee YH, Park HS, Ryoo K, Kang KW, et al. Glutathione S-transferase Mu, apoptosis signal-regulating kinase 1. J Biol Chem මර්දනය කිරීම මගින් ආතති සක්රිය සංඥා මොඩියුලේට් කරයි. 2001;276:12749-12755.
88. Dorion S, Lambert H, Landry J. තාප කම්පනය මගින් p38 සංඥා මාර්ගය සක්රිය කිරීම Ask1 වෙතින් glutathione S-transferase Mu විඝටනය කිරීම ඇතුළත් වේ. J Biol Chem. 2002;277:30792-30797.
89. Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L, et al. GSTp මගින් JNK සංඥා නියාමනය කිරීම. EMBO J. 1999;18:1321-1334.
90. Manevich Y, Feinstein SI, Fisher AB. ප්රතිඔක්සිකාරක එන්සයිමය 1-CYS පෙරොක්සිරෙඩොක්සින් සක්රීය කිරීම සඳහා pGST සමඟ විෂමකරණය මගින් මැදිහත් වන ග්ලූටතයෝනයිලේෂන් අවශ්ය වේ. Proc Natl Acad Sci US A. 2004;101:3780–3785.
91. බංකර් VW. නිදහස් රැඩිකලුන්, ප්රතිඔක්සිකාරක සහ වයස්ගත වීම. Med Lab Sci. 1992;49:299-312.
92. Mezzetti A, Lapenna D, Romano F, Costantini F, Pierdomenico SD, et al. පද්ධතිමය ඔක්සිකාරක ආතතිය සහ වයස සහ රෝග සමඟ එහි සම්බන්ධතාවය. J Am Geriatr Soc. 1996;44:823-827.
93. White E, Shannon JS, Patterson RE. විටමින් සහ අතර සම්බන්ධතාවය
කැල්සියම් අතිරේක භාවිතය සහ මහා බඩවැලේ පිළිකා. පිළිකා වසංගත Biomarkers පෙර. 1997;6:769-774.
94. Masella R, Di Benedetto R, Vari R, Filesi C, Giovannini C. ජීව විද්යාත්මක පද්ධතිවල ස්වභාවික ප්රතිඔක්සිකාරක සංයෝගවල නව යාන්ත්රණ: ග්ලූටතයෝන් සහ ග්ලූටතයෝන් ආශ්රිත එන්සයිම සම්බන්ධ වීම. J Nutr Biochem. 2005;16:577-586.
95. Curello S, Ceconi C, Bigoli C, Ferrari R, Albertini A, Guarnieri C. ischemia සහ reperfusion පසු හෘද ග්ලූටතයෝන් තත්ත්වයෙහි වෙනස්කම්. අත්දැකීම්. 1985;41:42-43.
96. El-Agamey A, Lowe GM, McGarvey DJ, Mortensen A, Phillip DM, Truscott TG. කැරොටිනොයිඩ් රැඩිකල් රසායන විද්යාව සහ ප්රතිඔක්සිකාරක/ප්රෝ-ඔක්සිකාරක ගුණ. Arch Biochem Biophys. 2004;430:37-48.
97. රයිස්-එවාන්ස් සීඒ, සැම්ප්සන් ජේ, බ්රැම්ලි පීඑම්, හොලෝවේ ඩීඊ. vivo තුළ කැරොටිනොයිඩ් ප්රතිඔක්සිකාරක වනු ඇතැයි අප අපේක්ෂා කරන්නේ ඇයි? නොමිලේ Radic Res. 1997;26:381-398.
98. නයිල්ස් ආර්.එම්. රෙටිනොයිඩ් රසායනික නිවාරණය සහ පිළිකා සඳහා ප්රතිකාර කිරීමේදී සංඥා මාර්ග. Mutat Res. 2004;555:81-96.
99. ඩොනාටෝ එල්ජේ, නොයි එන්. රෙටිනොයික් අම්ලය මගින් ක්ෂීරපායී පිළිකා වර්ධනය මර්දනය කිරීම: ප්රෝපොප්ටෝටික් ජාන යනු රෙටිනොයික් අම්ල ප්රතිග්රාහක සහ සෛලීය රෙටිනොයික් අම්ල-බන්ධන ප්රෝටීන් II සංඥා සඳහා ඉලක්ක වේ. පිළිකා Res. 2005;65:8193-8199.
100. Niizuma H, Nakamura Y, Ozaki T, Nakanishi H, Ohira M, et al. Bcl-2 යනු නියුරොබ්ලාස්ටෝමා හි රෙටිනොයික් අම්ල ප්රේරිත ඇපොප්ටෝටික් සෛල මරණය සඳහා ප්රධාන නියාමකයකි. ඔන්කොජීන්. 2006;25:5046-5055.
101. Dalton TP, Shertzer HG, Puga A. ප්රතික්රියාශීලී ඔක්සිජන් මගින් ජාන ප්රකාශනය නියාමනය කිරීම. Ann Rev Pharmacol Toxicol. 1999;39:67-101.
102. Scandalios JG. ඔක්සිකාරක ආතතියට ජානමය ප්රතිචාර. In: Meyers RA, ed. අණුක සෛල ජීව විද්යාව සහ අණුක වෛද්ය විද්යාව පිළිබඳ විශ්වකෝෂය. වෙළුම 5. 2වන සංස්කරණය. Weinheim, ජර්මනිය: Wiley-VCH; 2004: 489-512.
103. Ghosh R, Mitchell DL. පිටපත් කිරීමේ සාධක බන්ධනය මත ප්රවර්ධක මූලද්රව්යවල ඔක්සිකාරක DNA හානිවල බලපෑම. න්යෂ්ටික අම්ල Res. 1999;27:3213-3218.
104. Marietta C, Gulam H, Brooks PJ. TATA පෙට්ටියක ඇති තනි 8, 50-cyclo-20-deoxyadenosine තුවාලයක් TATA බන්ධන ප්රෝටීන් බන්ධනය වීම වළක්වන අතර vivo තුළ පිටපත් කිරීම දැඩි ලෙස අඩු කරයි. DNA අළුත්වැඩියා කිරීම (Amst). 2002;1:967-975.
105. ජැක්සන් ඒඑල්, චෙන් ආර්, ලෝබ් එල්ඒ. ක්ෂුද්ර චන්ද්රිකා අස්ථායීතාවයේ ප්රේරණය
ඔක්සිකාරක DNA හානි මගින්. Proc Natl Acad Sci US A. 1998;95:12468–12473.
106. Caldecott KW. ක්ෂීරපායී DNA තනි නූල් බිඳීම අලුත්වැඩියා කිරීමේදී ප්රෝටීන්-ප්රෝටීන් අන්තර්ක්රියා. Biochem Soc Trans. 2003;31:247-251.
107. Cooke MS, Evans MD, Dizdaroglu M, Lunec J. ඔක්සිකාරක DNA හානි: යාන්ත්රණ, විකෘති සහ රෝග. FASEB J. 2003;17:1195-1214.
108. ජෝන්ස් පීඑල්, වුල්ෆ් ඒපී. ජාන ප්රකාශනය තීරණය කිරීමේදී ක්රොමැටින් සංවිධානය සහ DNA මෙතිලේෂන් අතර සම්බන්ධතා. සෙමින් පිළිකා Biol. 1999;9:339-347.
109. Girotti AW. ලිපිඩ පෙරොක්සයිඩ් යාන්ත්රණය. J නිදහස් Radic Biol Med. 1985;1:87-95.
110. Siu GM, Draper HH. vivo සහ in vitro තුළ මැලෝනල්ඩිහයිඩ් පරිවෘත්තීය. ලිපිඩ. 1982;17:349-355.
111. Esterbauer H, Koller E, Slee RG, Koster JF. ප්රතිදීප්ත ක්රොමොලිපිඩ් සෑදීමේදී ලිපිඩ-පෙරොක්සයිඩ් නිෂ්පාදන 4-හයිඩ්රොක්සිනොනල් වල ඇති විය හැකි සම්බන්ධය. Biochem J. 1986;239:405-409.
112. Hagihara M, Nishigaki I, Maseki M, Yagi K. මානව සෙරුමයේ lipoprotein භාගවල ලිපිඩ පෙරොක්සයිඩ් මට්ටමේ වයස් මත රඳා පවතින වෙනස්කම්. ජේ ජෙරොන්ටෝල්. 1984;39:269-272.
113. Keller JN, Mark RJ, Bruce AJ, Blanc E, Rothstein JD, et al. 4- හයිඩ්රොක්සිනොනනල්, පටල ලිපිඩ පෙරොක්සයිඩීකරණයේ ඇල්ඩිහයිඩික් නිෂ්පාදනයක්, ග්ලූටමේට් ප්රවාහනය සහ උපාගමවල මයිටොකොන්ඩ්රිය ක්රියාකාරිත්වය අඩාල කරයි. ස්නායු විද්යාව. 1997;806:85-96.
114. Uchida K, Shiraishi M, Naito Y, Torii Y, Nakamura Y, Osawa T. ලිපිඩ පෙරොක්සිඩීකරණයේ අවසාන නිෂ්පාදනය මගින් ආතති සංඥා මාර්ග සක්රිය කිරීම. 4-hydroxy-2-nonenal යනු අන්තර් සෛලීය පෙරොක්සයිඩ් නිෂ්පාදනයේ විභව ප්රේරකයකි. J Biol Chem. 1999;274:2234-2242.
115. Suc I, Meilhac O, Lajoie-Mazenc I, Vandaele J, Jurgens G, Salvayre R, Negre-Salvayre A. ඔක්සිකරණය වූ LDL මගින් EGF ප්රතිග්රාහක සක්රීය කිරීම. FASEB J. 1998;12:665-671.
116. Tsukagoshi H, Kawata T, Shimizu Y, Ishizuka T, Dobashi K, Mori M. 4-Hydroxy-2-nonenal IMR-90 මානව පෙනහළු ෆයිබ්රොබ්ලාස්ට් මගින් ෆයිබ්රොනෙක්ටින් නිෂ්පාදනය වැඩි දියුණු කරයි. නියාමනය කරන ලද kinase p44/42 මාර්ගය. Toxicol Appl Pharmacol. 2002;184:127-135.
117. Montuschi P, Collins JV, Ciabattoni G, Lazzeri N, Corradi M, Kharitonov SA, Barnes PJ. COPD සහ සෞඛ්ය සම්පන්න දුම් පානය කරන්නන් තුළ පෙනහළු ඔක්සිකාරක ආතතියේ ජීව විද්යාත්මක ජීව සලකුණු කාරකයක් ලෙස 8-isoprostane පිට කරයි. Am J Respir Crit Care Med. 2000;162:1175-1177.
118. Morrison D, Rahman I, Lanan S, MacNee W. දුම් පානය කරන්නන්ගේ වායු අවකාශයේ අපිච්ඡද පාරගම්යතාව, දැවිල්ල සහ ඔක්සිකාරක ආතතිය. Am J Respir Crit Care Med. 1999;159:473-479.
119. Nowak D, Kasielski M, Antczak A, Pietras T, Bialasiewicz P. ස්ථායී නිදන්ගත බාධාකාරී පුඵ්ඵුසීය රෝග සහිත රෝගීන්ගේ කල් ඉකුත් වූ හුස්ම ඝනීභවනය තුළ thiobarbituric අම්ලය-ප්රතික්රියාශීලී ද්රව්ය සහ හයිඩ්රජන් පෙරොක්සයිඩ්වල අන්තර්ගතය වැඩි වීම: දුම්වැටි පානයෙහි සැලකිය යුතු බලපෑමක් නැත. Respir Med. 1999;93:389-396.
120. Kelly FJ, Mudway IS. වායු-පෙනහළු අතුරු මුහුණතේ ප්රෝටීන් ඔක්සිකරණය. ඇමයිනෝ අම්ල. 2003;25:375-396.
121. ඩීන් ආර්ටී, රොබට්ස් සීආර්, ජෙසුප් ඩබ්ලිව්. නිදහස් රැඩිකලුන් මගින් බාහිර සෛල හා අන්තර් සෛලීය පොලිපෙප්ටයිඩ ඛණ්ඩනය කිරීම. Prog Clin Biol Res. 1985;180:341-350.
122. කෙක් ආර්ජී. ප්රෝටීන වල මෙතියොනීන් ඔක්සිකරණය සඳහා පරීක්ෂණයක් ලෙස ටී-බියුටයිල් හයිඩ්රොපෙරොක්සයිඩ් භාවිතය. ගුද ජෛව රසායනය. 1996;236:56-62.
123. ඩේවිස් කේ.ජේ. ඔක්සිජන් රැඩිකලුන් මගින් ප්රෝටීන් හානි හා හායනය. I. පොදු අංග. J Biol Chem. 1987;262:9895-9901.
124. ස්ටැඩ්මන් ඊආර්. ප්රෝටීන වල ලෝහ අයන උත්ප්රේරක ඔක්සිකරණය: ජෛව රසායනික යාන්ත්රණය සහ ජීව විද්යාත්මක ප්රතිවිපාක. නොමිලේ Radic Biol Med.
1990;9:315-325.
125. Fucci L, Oliver CN, Coon MJ, Stadtman ER. මිශ්ර ක්රියාකාරී ඔක්සිකරණ ප්රතික්රියා මගින් ප්රධාන පරිවෘත්තීය එන්සයිම අක්රිය කිරීම: ප්රෝටීන් පිරිවැටුම සහ වයසට යාමේ ඇති විය හැකි ඇඟවුම්. Proc Natl Acad Sci US A. 1983;80:1521-1525.
126. Stadtman ER, Moskovitz J, Levine RL. ප්රෝටීන වල මෙතියොනීන් අවශේෂ ඔක්සිකරණය: ජීව විද්යාත්මක ප්රතිවිපාක. ප්රතිඔක්සිකාරක රෙඩොක්ස් සංඥාව. 2003;5:577-582.
127. Stadtman ER, Levine RL. ප්රෝටීන වල නිදහස් ඇමයිනෝ අම්ල සහ ඇමයිනෝ අම්ල අපද්රව්ය නිදහස් රැඩිකල්-මැදිහත් ඔක්සිකරණය. ඇමයිනෝ අම්ල. 2003;25:207-218.
128. ස්ටැඩ්මන් ඊආර්. වයස්ගත වීම සහ වයස්ගත ආශ්රිත රෝග වල ප්රෝටීන් ඔක්සිකරණය වීම. Ann NY Acad Sci. 2001;928:22-38.
129. Shacter E. ජීව විද්යාත්මක සාම්පලවල ප්රෝටීන් ඔක්සිකරණයේ ප්රමාණකරණය සහ වැදගත්කම. Drug Metab Rev. 2000;32:307-326.
130. Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. ඔක්සිකාරක ආතතිය සහ සෛල සංඥා කිරීම. Curr Med Chem. 2004;11:1163-1182.
131. Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. සනාල එන්ඩොතලියල් වර්ධන සාධකය (VEGF) සහ එහි ප්රතිග්රාහක. FASEB J. 1999;13:9-22.
132. Sundaresan M, Yu ZX, Ferrans VJ, Sulciner DJ, Gutkind JS, et al. Rac1 මගින් ෆයිබ්රොබ්ලාස්ට් වල ප්රතික්රියාශීලී-ඔක්සිජන් විශේෂ උත්පාදනය නියාමනය කිරීම. Biochem J. 1996;318:379-382.
133. Sun T, Oberley LW. පිටපත් කිරීමේ සක්රියකාරකවල රෙඩොක්ස් නියාමනය. නොමිලේ Radic Biol Med. 1996;21:335-348.
134. Klatt P, Molina EP, De Lacoba MG, Padilla CA, Martinez-Galesteo E, Barcena JA, Lamas S. Reversible S-glutathiolation මගින් c-Jun DNA බන්ධනය රෙඩොක්ස් නියාමනය. FASEB J. 1999;13:1481-1490.
135. Reynaert NL, Ckless K, Guala AS, Wouters EF, van der Vliet A, Janssen Heininger
වයි.එම්. ග්ලූටරෙඩොක්සින්-1 උත්ප්රේරක සිස්ටීන් ව්යුත්පන්න කිරීමෙන් පසු S-ග්ලූටතයෝනයිලේටඩ් ප්රෝටීන ස්ථානීය හඳුනාගැනීමේදී. Biochim Biophys Acta. 2006;1760:380-387.
136. Reynaert NL, Wouters EF, Janssen-Heininger YM. ග්ලූටරෙඩොක්සින්-1 හි මොඩියුලේෂන්
අසාත්මික ගුවන් මාර්ග රෝගයේ මූසික ආකෘතියක ප්රකාශනය. Am J Respir Cell Mol Biol. 2007;36:147-151.
137. Filomeni G, Rotilio G, Ciriolo MR. සෛල සංඥා සහ ග්ලූටතයෝන් රෙඩොක්ස් පද්ධතිය. Biochem Pharmacol. 2002;64:1057-1064.
138. Pande V, Ramos MJ. න්යෂ්ටික සාධකය-කප්පා B සහ අනෙකුත් සෛලීය ප්රෝටීන මගින් 15-ඩියොක්සයිඩෙල්ටා (12,14) prostaglandin J(2) අණුක හඳුනාගැනීම. Bioorg Med Chem Lett. 2005;15:4057-4063.
139. පර්කින්ස් එන්ඩී. NF-kappaB සහ IKK ශ්රිතය සමඟ සෛල-සංඥා මාර්ග ඒකාබද්ධ කිරීම. Nat Rev Mol Cell Biol. 2007;8:49-62.
140. ගිල්මෝර් ටීඩී. NF-kappaB වෙත හැඳින්වීම: ක්රීඩකයින්, මාර්ග, ඉදිරිදර්ශන. ඔන්කොජීන්. 2006;25:6680-6684.
141. Hirota K, Murata M, Sachi Y, Nakamura H, Takeuchi J, Mori K, Yodoi J. සයිටොප්ලාස්මයේ සහ න්යෂ්ටියේ thioredoxin හි වෙනස් භූමිකාවන්. පිටපත් කිරීමේ සාධකය NF-kappaB හි රෙඩොක්ස් නියාමනය කිරීමේ ද්වි-පියවර යාන්ත්රණයක්. J Biol Chem. 1999;274:27891-27897.
142. වාට්ටුව පී.ඒ. උග්ර පෙනහළු තුවාල වලදී අනුපූරක, කෙමොකයින් සහ නියාමක සයිටොකයින් වල කාර්යභාරය. Ann NY Acad Sci. 1996;796:104-112.
143. සයිටොකයින් ජාන නියාමනයේ අකිරා එස්, කිෂිමොටෝ ඒ. එන්එෆ්-අයිඑල්6 සහ එන්එෆ්-කේබී. Adv Immunol. 1997;65:1-46.
144. Meyer M, Schreck R, Baeuerle PA. H2O2 සහ ප්රතිඔක්සිකාරක NF-kappa B සහ AP-1 නොවෙනස්ව සෛල තුළ සක්රිය කිරීම සඳහා ප්රතිවිරුද්ධ බලපෑම් ඇති කරයි: AP-1 ද්විතියික ප්රතිඔක්සිකාරක-ප්රතිචාරාත්මක සාධකයක් ලෙස. EMBO J. 1993;12:2005-2015.
145. Abate C, Patel L, Rausher FJ, Curran T. fos හි රෙඩොක්ස් නියාමනය සහ vitro තුළ ජූන් DNA-බන්ධන ක්රියාකාරකම්. විද්යාව. 1990;249:1157-1161.
146. Galter D, Mihm S, Droge W. න්යෂ්ටික පිටපත් කිරීමේ සාධක kB සහ සක්රියකාරක ප්රෝටීන්-1 මත ග්ලූටතයෝන් ඩයිසල්ෆයිඩ් වල වෙනස් බලපෑම්. යුර් ජේ ජෛව රසායනය. 1994;221:639-648.
147. Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. AP-1 පිටපත් කිරීමේ ක්රියාකාරකම් නියාමනය කරනු ලබන්නේ thioredoxin සහ Ref-1 අතර සෘජු සම්බන්ධයක් මගිනි. Proc Natl Acad Sci US A. 1997;94: 3633-3638.