ස්නායු ආසාධනය:
වියුක්ත
බහුවිධ සාක්ෂි මගින් මනෝචිකිත්සක රෝග වලදී ස්නායු ප්රදාහයේ ව්යාධිජනක භූමිකාවට සහාය වේ. පද්ධතිමය ස්වයං ප්රතිශක්තිකරණ රෝග ස්නායු මනෝචිකිත්සක ආබාධ සඳහා හොඳින් ලේඛනගත කර ඇති අතර, මනෝවිද්යාත්මක රෝග ලක්ෂණ සහිත උපාගම ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ බොහෝ විට හඳුනා නොගනී. මනෝචිකිත්සක රෝග ලක්ෂණ සහ ස්වයං ප්රතිශක්තිකරණ රෝග වල ස්වයං ප්රතිශක්තිය අතර සම්බන්ධයට සමාන්තරව, සම්භාව්ය මනෝචිකිත්සක ආබාධ (උදාහරණයක් ලෙස, ප්රධාන මානසික අවපීඩනය, බයිපෝල, භින්නෝන්මාදය සහ උමතු-සම්පීඩන ආබාධ) ස්නායු ප්රතිශක්තිකරණ අසාමාන්යතා සිදු වේ. මෙම තත්ත්වයන්ගේ ව්යාධි භෞතවේදය පිළිබඳ විමර්ශනය මගින් ග්ලූටමැටර්ජික් සහ මොනොඇමිනර්ජික් පද්ධතිවල අක්රමිකතාව සාම්ප්රදායිකව අවධාරණය කරන ලද නමුත් මෙම ස්නායු සම්ප්රේෂක අසාමාන්යතා ඇති කරන යාන්ත්රණ නොපැහැදිලි විය. අපි ස්වයං ප්රතිශක්තිය සහ ස්නායු මනෝචිකිත්සක ආබාධ අතර සම්බන්ධය සහ තෝරාගත් සම්භාව්ය මනෝචිකිත්සක ආබාධවල ස්නායු ප්රදාහයේ ව්යාධිජනක භූමිකාවට සහාය දක්වන මානව සහ පර්යේෂණාත්මක සාක්ෂි සමාලෝචනය කරමු. මනෝ සමාජීය, ප්රවේණික, ප්රතිශක්තිකරණ සහ ස්නායු සම්ප්රේෂක පද්ධති අන්තර්ක්රියා කරන ආකාරය අවබෝධ කර ගැනීමෙන් ව්යාධිජනක ඉඟි හෙළි කිරීමට සහ නව වැළැක්වීමේ සහ රෝග ලක්ෂණ ප්රතිකාර ඉලක්ක කිරීමට උපකාරී වේ.
ප්රධාන වචන:
- ස්නායු ආසාධනය,
- Psychoneuroimmunology,
- ඇස්ට්රොසයිට්,
- මයික්රොග්ලියා,
- සයිටොකයින්,
- ඔක්සිකාරක ආතතිය,
- මානසික අවපීඩනය,
- උමතු-සම්පීඩන ආබාධ,
- බයිපෝල ආබාධ, භින්නෝන්මාදය
අන්තර්ගතය
හැදින්වීම
මනෝචිකිත්සක ආබාධ සහිත රෝගීන් අතර ජීව විද්යාත්මක අසාමාන්යතා වැඩි වැඩියෙන් හඳුනාගෙන ඇති හෙයින්, ස්නායු හා මානසික රෝග අතර වෙනස මැකී යයි. මනෝචිකිත්සක ප්රකාශනයන් හා සම්බන්ධ පද්ධතිමය ස්වයං ප්රතිශක්තිකරණ රෝග වලට අමතරව (උදාහරණයක් ලෙස, ලූපස්) [1], වඩාත් මෑතකදී, උග්ර හුදකලා මනෝවිද්යාව ඇති රෝගීන් උපාගමික ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ (වගුව 1) [2-6] සමඟ හඳුනාගෙන ඇත. මෙම රෝගීන් බොහෝ විට වර්තන ප්රාථමික මනෝචිකිත්සක ආබාධ සමඟ වැරදි ලෙස රෝග විනිශ්චය කරනු ලැබේ, ඵලදායී ප්රතිශක්තිකරණ ප්රතිකාර ආරම්භ කිරීම ප්රමාද කරයි (වගුව 1). මීට අමතරව, වර්ධනය වන සාක්ෂි ස්නායු මනෝචිකිත්සක ආබාධ [7] තුළ ප්රති-ස්නායු ප්රතිදේහවල ව්යාධිජනක භූමිකාවට සහාය වේ.
ස්නායු හා මනෝචිකිත්සක ආබාධ වෙන් කිරීම, Descartes ගේ සංකල්පය මගින් සහය වන "මනස" ජීව විද්යාත්මකව වෙනස් වූ ආයතනයක් ලෙස සහ ස්නායු ව්යාධි අසාමාන්යතා ප්රතිනිෂ්පාදනය කිරීම මගින් වෛද්ය විද්යාවේ ආධිපත්යය දැරීය.19 වන සහ 20 වන සියවසේ මුල් භාගයේ [8]. එතැන් සිට, නියුරෝසිෆිලිස්, හිස කම්පනය, ආඝාතය, ගෙඩියක්, ඩිමයිලිනේෂන් සහ තවත් බොහෝ ප්රතිනිෂ්පාදනය කළ හැකි ජීව විද්යාත්මක හේතු එකතුවක් සම්භාව්ය මනෝචිකිත්සක ආබාධ සමඟ අතිච්ඡාදනය වූ රෝග ලක්ෂණ සංකීර්ණ වීමට හේතු විය [9-11]. වඩාත් මෑතදී, සම්භාව්ය මනෝචිකිත්සක ආබාධ සහිත රෝගීන්ගේ ස්නායු ගිනි අවුලුවන සහ ප්රතිශක්තිකරණ අසාමාන්යතා ලේඛනගත කර ඇත.
පර්යන්ත ප්රතිශක්තිකරණ මොඩියුලේටරයන් සත්ව ආකෘති සහ මිනිසුන් තුළ මනෝචිකිත්සක රෝග ලක්ෂණ ඇති කළ හැක [12-19]. ප්රෝ-ගිනි අවුලුවන IL-1 එන්නත් කළ නිරෝගී සතුන්? සහ tumor necrosis factor alpha (TNF-?) සයිටොකයින මගින් සමාජ ඉවත් වීම හා සම්බන්ධ ‛අසනීප හැසිරීම’ පෙන්නුම් කරයි [12]. මිනිසුන් තුළ, අඩු-මාත්රා එන්ඩොටොක්සින් එන්නත් කිරීම, ප්රතිලාභ සැකසීම සඳහා තීරණාත්මක කලාපයක් වන උදරීය ස්ට්රයිටම් අක්රිය කරයි, ඇනෙඩෝනියාව දුර්වල කරන මානසික අවපීඩන රෝග ලක්ෂණයක් ඇති කරයි [14]. මානසික අවපීඩනයට ලක් නොවන හෙපටයිටිස් C සහ පිළිකා රෝගීන්ගෙන් ආසන්න වශයෙන් 45% IFN- සමඟ ප්රතිකාර ලබනවාද? සෙරුමය IL-6 මට්ටම් [12,15,17,18] වැඩි වීම හා සම්බන්ධ මානසික අවපීඩන රෝග ලක්ෂණ වර්ධනය වේ.
තරබාරුකම, දියවැඩියාව, විකෘතිතා, රූමැටොයිඩ් ආතරයිටිස් සහ බහු ස්ක්ලේරෝසිස් ඇතුළු නිදන්ගත ගිනි අවුලුවන සහ ප්රතිශක්තිකරණ අසාමාන්යතා සමඟ සම්බන්ධ වෛද්ය තත්වයන් මානසික අවපීඩනය සහ බයිපෝලර් ආබාධ සඳහා අවදානම් සාධක වේ [10,12,13,15,17,18]. ධනාත්මකමෙම වෛද්ය තත්වයන් සහ මනෝචිකිත්සක රෝග අතර සහසම්බන්ධතාවයෙන් ඇඟවෙන්නේ අනෙකුත් අවයව අතර මොළයට බලපාන පුලුල්ව පැතිරුනු යටින් පවතින ගිනි අවුලුවන ක්රියාවලියක් පවතින බවයි [10,19,20]. වසර 30ක ජනගහන පාදක අධ්යයනයකින් හෙළි වූයේ, ස්වයංසිද්ධිය හෝ බරපතල ආසාදනයක් සඳහා පූර්ව රෝහල්ගතවීම භින්නෝන්මාදය වර්ධනය වීමේ අවදානම පිළිවෙළින් 29% සහ 60% කින් වැඩි විය [16]. තවද, ගර්භණී සමයේදී හර්පීස් සිම්ප්ලෙක්ස් වෛරසය, ටොක්සොප්ලාස්මා ගොන්ඩි, සයිටෝමෙගෙලෝ වයිරස් සහ ඉන්ෆ්ලුවෙන්සා භින්නෝන්මාදය [16] වර්ධනය වීමේ අවදානම වැඩි කරයි.
පර්යන්ත සෛලීය [21,22] (වගුව 2), සහ හාස්යමය ප්රතිශක්තිකරණ අසාමාන්යතා [13,21-23] සෞඛ්ය සම්පන්න පාලනයන්ට සාපේක්ෂව මනෝචිකිත්සක රෝගීන් තුළ බහුලව දක්නට ලැබේ. නියමු (n = 34 ප්රධාන මානසික අවපීඩන ආබාධ සහිත රෝගීන් (MDD), n = 43 සෞඛ්ය සම්පන්න පාලනයන්) සහ අනුකරණ අධ්යයනයන් (n = 36 MDD, n = 43 සෞඛ්ය සම්පන්න පාලනයන්) යන දෙකෙහිම, සෙරුමය ජෛව සලකුණු 91.7 කින් සමන්විත සෙරුමය විශ්ලේෂණයක් මගින් MDD විෂයයන් නිරෝගී අයගෙන් වෙන්කර හඳුනා ගන්නා ලදී. 81.3% සංවේදිතාව සහ 1% විශේෂත්වය සහිත පාලනයන්; ස්නායු මනෝචිකිත්සක රෝග ලක්ෂණ සඳහා සැලකිය යුතු ලෙස ඉහළ ගිය ජෛව සලකුණු වූයේ ප්රතිශක්තිකරණ අණු ඇල්ෆා 23 ඇන්ටිට්රිප්සින්, මයිලෝපෙරොක්සිඩේස් සහ ද්රාව්ය TNF-? ප්රතිග්රාහක II [XNUMX].
 අපි පළමුව ස්වයං ප්රතිශක්තිය සහ ස්නායු මනෝචිකිත්සක ආබාධ අතර සම්බන්ධය සමාලෝචනය කරමු, ඇතුළුව: 1) පද්ධතිමය ස්වයං ප්රතිශක්තිකරණ රෝගයේ මූලාකෘතියක් ලෙස පද්ධතිමය ලුපුස් එරිටෙටෝමෝසස් (SLE); 2) සෙරුමය ප්රති උපාගමික සහ ග්ලූටමික් අම්ල ඩෙකාබොක්සිලේස් (GAD) ස්වයං ප්රතිදේහ සමඟ සම්බන්ධ ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ; සහ 3) ස්ට්රෙප්ටොකොකල් ආසාදන (PANDAS) හා සම්බන්ධ ළමා ස්නායු මනෝචිකිත්සක ස්වයං ප්රතිශක්තිකරණ ආබාධ සහ ප්රති-බාසල් ගැන්ග්ලියා/තාලමික් ස්වයං ප්රතිදේහ සමඟ සම්බන්ධ වූ පිරිසිදු උමතු-සම්පීඩන ආබාධ (OCD). MDD, bipolar disorder (BPD), භින්නෝන්මාදය සහ OCD ඇතුළු සම්භාව්ය මනෝචිකිත්සක ආබාධවල සහජ දැවිල්ල/ස්වයං ප්රතිශක්තියේ භූමිකාව අපි පසුව සාකච්ඡා කරමු.
අපි පළමුව ස්වයං ප්රතිශක්තිය සහ ස්නායු මනෝචිකිත්සක ආබාධ අතර සම්බන්ධය සමාලෝචනය කරමු, ඇතුළුව: 1) පද්ධතිමය ස්වයං ප්රතිශක්තිකරණ රෝගයේ මූලාකෘතියක් ලෙස පද්ධතිමය ලුපුස් එරිටෙටෝමෝසස් (SLE); 2) සෙරුමය ප්රති උපාගමික සහ ග්ලූටමික් අම්ල ඩෙකාබොක්සිලේස් (GAD) ස්වයං ප්රතිදේහ සමඟ සම්බන්ධ ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ; සහ 3) ස්ට්රෙප්ටොකොකල් ආසාදන (PANDAS) හා සම්බන්ධ ළමා ස්නායු මනෝචිකිත්සක ස්වයං ප්රතිශක්තිකරණ ආබාධ සහ ප්රති-බාසල් ගැන්ග්ලියා/තාලමික් ස්වයං ප්රතිදේහ සමඟ සම්බන්ධ වූ පිරිසිදු උමතු-සම්පීඩන ආබාධ (OCD). MDD, bipolar disorder (BPD), භින්නෝන්මාදය සහ OCD ඇතුළු සම්භාව්ය මනෝචිකිත්සක ආබාධවල සහජ දැවිල්ල/ස්වයං ප්රතිශක්තියේ භූමිකාව අපි පසුව සාකච්ඡා කරමු.
ස්වයං ප්රතිශක්තිය සමඟ සම්බන්ධ වූ ස්නායු මනෝචිකිත්සක ආබාධ
පද්ධතිමය Lupus Erythematosus
SLE රෝගීන්ගෙන් 25% ත් 75% ත් අතර ප්රමාණයක් මධ්යම ස්නායු පද්ධතියට (CNS) සම්බන්ධ වී ඇති අතර, මානසික රෝග ලක්ෂණ සාමාන්යයෙන් රෝගය ආරම්භ වී පළමු වසර දෙක තුළ සිදු වේ. මනෝචිකිත්සක රෝග ලක්ෂණ වලට කාංසාව, මනෝභාවය සහ මානසික කැළඹීම් ඇතුළත් විය හැකිය [97]. මොළයේ චුම්භක අනුනාද රූප (MRI) ස්නායු මනෝචිකිත්සක SLE රෝගීන්ගෙන් 42% ක් පමණ සාමාන්ය වේ [97]. මයික්රොඇන්ජියෝපති සහ රුධිර මොළයේ බාධක (BBB) බිඳවැටීම ස්වයං ප්රතිදේහ මොළයට ඇතුළු වීමට ඉඩ සලසයි [97]. මෙම ප්රතිදේහවලට ප්රති-රයිබොසෝමල් පී (මනෝවිද්යාත්මක SLE රෝගීන්ගෙන් 90%ක් තුළ ධනාත්මක වේ) [1], ප්රති-එන්ඩොතලියල් සෛල, ප්රති-ගැන්ග්ලියෝසයිඩ්, ප්රති-dsDNA, N-methyl-D-aspartate ප්රතිග්රාහකවල ප්රති-2A/2B අනු ඒකක ( NMDAR) සහ ප්රති-පොස්පොලිපිඩ් ප්රතිදේහ [97]. ප්රෝ-ගිනි අවුලුවන සයිටොකයින්-ප්රධාන වශයෙන් IL-6 [97], S100B[97], අන්තර්-සෛලීය ඇලවුම් අණු 1 [97] සහ matrix- metalloproteinase-9 [98] ද SLE හි වැඩි වේ. SLE, Sjo?gren's Disease, Susac's syndrome, CNS vasculitis, CNS Whipple's disease සහ Behc?et's disease හි මනෝචිකිත්සක ප්රකාශනයන් මෑතකදී සමාලෝචනය කරන ලදී [1].
ස්නායු මනෝචිකිත්සක ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ (Serum Anti-Synaptic & Glutamic Acid Decarboxylase) සමඟ සම්බන්ධ
ස්වයංජනනයි
ස්වයංක්රීය ප්රතිශක්තිකරණ එන්සෙෆලටයිඩවල තීව්ර ආරම්භය මගින් සංලක්ෂිත වේ තාවකාලික පෙති වලිප්පුව, මනෝචිකිත්සක ලක්ෂණ සහ සංජානන ඌනතා [2,3,99-108]. ව්යාධි කායික විද්යාව සාමාන්යයෙන් මැදිහත් වන්නේ පාරනියෝ ප්ලාස්ටික් හෝ පරනියෝප්ලාස්ටික් නොවන සම්භවයක් සමඟ සම්බන්ධ වී උපාගමික හෝ අන්තර් සෛලීය ස්වයං ප්රතිදේහ ඉලක්ක කරන ස්වයං ප්රතිදේහ මගිනි. ප්රති උපාගමික ස්වයංක්රීය ප්රතිදේහ NMDAR හි NR3 උප ඒකක ඉලක්ක කරයි [1], වෝල්ටීයතා-ගෙටඩ් පොටෑසියම් නාලිකා (VGKC) සංකීර්ණ (Kv100,108,109 උප ඒකක, ලියුසීන් බහුල ග්ලියෝමා අක්රිය (LGI1) සහ ස්පර්ශක ආශ්රිත ප්රෝටීන් 1 (CASPR2) [2) ඇමයිනෝ-101,102,106- hydroxy-1-methyl-l-2-isoxazolepropionic acid receptor (AMPAR) හි GluR3 උප ඒකක [5] සහ ?-aminobu-tyric අම්ලය B ප්රතිග්රාහක (GABABR) [4] හි B6,110,111 උප ඒකක. ප්රති-අන්තර් සෛලීය ස්වයං ප්රතිදේහ ඉලක්ක කරන්නේ onconeuronal සහ GAD-1 autoantigens [3,99,103].
ප්රති උපාගමික ස්වයංක්රීය ප්රතිදේහ, විශේෂයෙන් NMDAR-ස්වයං ප්රතිදේහ හා සම්බන්ධ දැවිල්ල සාමාන්යයෙන් GAD-ස්වයං ප්රතිදේහ හෝ පද්ධතිමය ස්වයං ප්රතිශක්තිකරණ ආබාධ හෝ paraneoplastic syndromes [2,107] සම්බන්ධ ප්රති-නියුරෝන ස්වයං ප්රතිදේහවලට වඩා මෘදු වේ.
ස්නායු රෝග ලක්ෂණ අවසානයේ මතු වුවද, කාංසාව [2,3] සිට භින්නෝන්මාදය අනුකරණය කරන මනෝ ව්යාධිය [2-6] දක්වා වූ මනෝචිකිත්සක ප්රකාශනයන්, මුලදී ආධිපත්යය දැරීමට හෝ ස්නායු රෝග ලක්ෂණ වලට පෙර ඇති විය හැක. ප්රති-එන්එම්ඩීඒආර් ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලයිටිස් ඇති රෝගීන්ගෙන් තුනෙන් දෙකක් දක්වා, මුලින් මනෝචිකිත්සක සේවාවන් වෙත ඉදිරිපත් වේ [5]. උග්ර මනෝචිකිත්සාවේ [2-6] අවකලනයේදී ප්රති උපාගමික ප්රතිදේහ-මැදිහත් ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ සලකා බැලිය යුතුය. මනෝචිකිත්සක ඉදිරිපත් කිරීම්වලට එන්සෙෆලෝපති හෝ ආක්රමණ [2,3,5,6,107] නොමැතිව සාමාන්ය මොළයේ MRI සහ මස්තිෂ්ක කොඳු ඇට පෙළේ තරල (CSF) විශ්ලේෂණය ඇතුළත් විය හැකිය. සාමාන්ය මොළයේ එම්ආර්අයි සහ සීඑස්එෆ් විශ්ලේෂණයන් නොතකා, බයොප්සි ඔප්පු කළ ස්නායු ප්රදාහය හා සම්බන්ධ සෙරොපොසිටිව් GAD ස්වයං ප්රතිදේහ පිළිබඳ සිද්ධියක් අපි වාර්තා කළෙමු, එහිදී රෝගියා මානසික ආබාධ පිළිබඳ රෝග විනිශ්චය සහ සංඛ්යාලේඛන අත්පොත මගින් භින්නෝන්මාදය ලෙස හඳුනාගෙන ඇති හුදකලා මනෝවිද්යාව ඉදිරිපත් කළෙමු, 4 වන සංස්කරණය (DSM-IV) [2]. තවද, seronegative autoimmune encephalitides ද කැපී පෙනෙන ස්නායු මනෝචිකිත්සක කැළඹීම් සමඟ ඉදිරිපත් විය හැකි අතර, රෝග විනිශ්චය වඩාත් නොපැහැදිලි කරයි [107,112,113]. ප්රති උපාගමික සහ GAD ස්වයංක්රීය ප්රතිදේහ හා සම්බන්ධ මනෝචිකිත්සක සහ ස්නායු රෝග ලක්ෂණ 1 වගුවේ [1-6,99-108,114] සාරාංශ කර ඇත.
පිරිසිදු මනෝචිකිත්සක ආබාධ [2,4,5,112,115-121] ඇති රෝගීන් තුළ සෙරුමය ප්රති-උපාගාමික සහ GAD ස්වයං ප්රතිදේහ ඇතිවිය හැක. භින්නෝන්මාදය සඳහා DSM-IV නිර්ණායක සපුරාලන අනාගත විෂයයන් 29 ක සමූහයක් තුළ, serum anti-NMDAR ස්වයංක්රීය ප්රතිදේහ විෂයයන් තුනකින් හමු වූ අතර, VGKC-සංකීර්ණ ස්වයං ප්රතිදේහ එක් විෂයකින් සොයා ගන්නා ලදී [5]. නිශ්චිත භින්නෝන්මාදයෙන් පෙළෙන රෝගීන් 1 දෙනෙකු තුළ immunoglobulin G (IgG) NR100 ස්වයංක්රීය ප්රතිදේහ හඳුනා ගැනීමට වඩාත් සංවේදී තාක්ෂණික ක්රම භාවිතා කරමින්, ස්වයං ප්රතිදේහ හඳුනාගෙන නොමැත [122]. කෙසේ වෙතත්, මෙම අධ්යයනය NMDAR හි NR2 අනු ඒකකය ඉලක්ක කරගත් ස්වයං ප්රතිදේහ තක්සේරු කළේ නැත. වෙනත් අධ්යයනයන් මගින් උග්ර උන්මාදය ඇති පුද්ගලයින් අතර (?90 වැනි ප්රතිශතයේ මනෝචිකිත්සක නොවන පාලන මට්ටම්) NR2 ප්රතිදේහ මට්ටම් (අසම්මත අනුපාතය (OR) 2.78, 95% විශ්වාසනීය පරතරය (CI) 1.26 සිට 6.14 දක්වා, P = 0.012) සැලකිය යුතු ලෙස වැඩි වී ඇති බව වාර්තා විය. n = 43), නමුත් නිදන්ගත උන්මාදය හෝ භින්නෝන්මාදය [116] තුළ නොවේ.
ප්රති-බාසල් ගැන්ග්ලියා/තාලමික් ස්වයං ප්රතිදේහ සමඟ සම්බන්ධ PANDAS සහ Pure Obsessive-Compulsive Disorder
OCD බොහෝ විට Sydenham's chorea, Huntington's disease සහ Parkinson's disease ඇතුළු බාසල් ගැන්ග්ලියා සම්බන්ධ ස්නායු ආබාධ සංකීර්ණ කරයි. ප්රති-බේසල් ගැන්ග්ලියා ප්රතිදේහ Sydenham's chorea [123] තුළ අන්තර්ගත වේ. PANDAS OCD රෝග ලක්ෂණ සහ/හෝ A ?-hemolytic streptococcal ආසාදනයකින් පසුව ඇතිවන මෝටර්/ෆොනික් ටික් උග්රවීම මගින් සංලක්ෂිත වේ. ව්යාධි කායික විද්යාවට ප්රති-ස්ට්රෙප්ටොකොකල් ප්රතිදේහ සහ බාසල් ගැන්ග්ලියා ප්රෝටීන අතර හරස් ප්රතික්රියාකාරිත්වය ඇතුළත් වේ යැයි සැලකේ [124]. PANDAS සහ pure OCD අතර සායනික අතිච්ඡාදනය පොදු හේතු විද්යාත්මක යාන්ත්රණයක් යෝජනා කරයි [125].
පිරිසිදු OCD රෝගීන් 21 දෙනෙකුගෙන් සමන්විත අහඹු කණ්ඩායමක් අතර, 91.3% කට CSF ප්රති-බේසල් ගැන්ග්ලියා (P <0.05) සහ 0.005 kDa [43] හි ප්රති-තලමික් ස්වයං ප්රතිදේහ (P <88), cortico-alamostriatal හි ක්රියාකාරී අසාමාන්යතා සමාන්තර විය. - OCD විෂයයන් වල කෝටිකෝ පරිපථය [84]. තවත් අධ්යයනයකින් ලේඛනගත කර ඇත්තේ OCD ළමා හා නව යොවුන් වියේ විෂයයන්ගෙන් 42% (n = 21) 40% සිට 45% දක්වා පාලන (P = 60) [2] ට සාපේක්ෂව 10, 0.001 සහ 7 kDa හි සෙරුමය ප්රති-බාසල් ගැන්ග්ලියා ස්වයං ප්රතිදේහ ඇති බවයි. ස්ට්රෙප්ටොකොකල්-ධනාත්මක/OCD-සෘණ පාලන (P <64) [14] 9% (n = 2) හා සසඳන විට PANDAS විෂයයන්ගෙන් 0.001% ක (n = 126) ප්රති-බාසල් ගැන්ග්ලියා ස්වයං ප්රතිදේහ අනාවරණය විය. එක් අධ්යයනයකින් OCD (5.4%, n = 4) සහ MDD පාලනයන් (0%) [127] හි ප්රති-බාසල් ගැන්ග්ලියා ස්වයං ප්රතිදේහ ව්යාප්තිය අතර වෙනසක් දක්නට නොලැබේ; කෙසේ වෙතත්, සීමාවක් වූයේ මී බාහිකයේ අහඹු ලෙස භාවිතා කිරීම සහ ගව බාසල් ගැන්ග්ලියා සහ බාහිකයේ සෙරොපොසිටිව් අවස්ථා හඳුනා ගැනීම සීමා කළ හැකි වීමයි.
බාසල් ගැන්ග්ලියා ස්වයං ප්රතිදේහජනක වන්නේ ඇල්ඩොලේස් සී (40 kDa), නියුරෝන-විශේෂිත/නියුරෝනල් නොවන එනොලේස් (45 kDa ද්විත්ව) සහ පයිරුවේට් කයිනාස් M1 (60 kDa) ස්නායු සම්ප්රේෂණය, ස්නායු සම්ප්රේෂණයට සම්බන්ධ ස්නායු ග්ලයිකොලයිටික් එන්සයිම ය.
3 හි 24 පිටුව සහ සෛල සංඥා [128]. මෙම එන්සයිම ස්ට්රෙප්ටොකොකල් ප්රෝටීන [129] වෙත සැලකිය යුතු ව්යුහාත්මක සමවිද්යාව ප්රදර්ශනය කරයි. නවතම අධ්යයනය (96 OCD, 33 MDD, 17 භින්නෝන්මාද විෂයයන්) විශේෂයෙන් pyruvate kinase, aldolase C සහ enolase වලට එරෙහිව රෝගියාගේ සෙරුමය පරීක්ෂා කරන ලදී; OCD විෂයයන්ගෙන් වැඩි ප්රතිශතයක් පාලනයන්ට සාපේක්ෂව සෙරෝ-ධනාත්මක විය (19.8% (n = 19) එදිරිව 4% [n = 2], P = 0.012) [130].
එහෙත්, එම අධ්යයනයේ දී, sero-positive OCD විෂයයන් 19 න් එකකට පමණක් ධනාත්මක ප්රති-ස්ට්රෙප්ටොලිසින් O ප්රතිදේහ ටයිටර තිබුණි, පිරිසිදු OCD හි ප්රති-ස්ට්රෙප්ටොලිසින් O ප්රතිදේහ සෙරොනෙගටිවිටි ප්රති-බැසල් ගැන්ග්ලියා ස්වයං ප්රතිදේහ පැවතීම බැහැර නොකරන බව යෝජනා කරයි. .
පිරිසිදු OCD වලදී, ප්රති-බේසල් ගැන්ග්ලියා / තලමික් ප්රතිදේහ සඳහා සේරෝ-පොසිටිවිටි CSF ග්ලයිසීන් (P = 0.03) [88] මට්ටම් සමඟ සම්බන්ධ වේ, මෙම ප්රතිදේහ OCD [84,88,131] හි නිරීක්ෂණය කරන ලද hyperglutamatergia සඳහා දායක වන බව යෝජනා කරයි. ප්රතිශක්තිකරණ ප්රතිකාර සමඟ ආසාදන-ප්රකෝප කරන ලද OCD වැඩිදියුණු කිරීම මෙම ස්වයං ප්රතිදේහවල ව්යාධිජනකතාවයට සහාය වේ [132]. උග්ර ලෙස ආරම්භ වන OCD සහ ප්රති-ස්ට්රෙප්ටොකොකල් ප්රතිදේහ සහිත ළමුන් සඳහා අභ්යන්තර ප්රතිශක්තිකරණ ප්රතිශක්තිකරණ (IVIG) වල කාර්යක්ෂමතාවය තක්සේරු කරන විශාල NIH පරීක්ෂණයක් සිදු වෙමින් පවතී (ClinicalTrials.gov: NCT01281969). කෙසේ වෙතත්, ධනාත්මක CSF ප්රතිදේහ සමඟ සසඳන විට සෘණ CSF ප්රති-බේසල් ගැන්ග්ලියා / thalamic ප්රතිදේහ සහිත OCD රෝගීන්ගේ CSF ග්ලූටමේට් මට්ටම් තරමක් වැඩි බව සොයාගැනීමෙන් ඇඟවෙන්නේ ප්රතිශක්තිකරණ නොවන යාන්ත්රණ OCD හි භූමිකාවක් ඉටු කළ හැකි බවයි. සයිටොකයින්-මැදිහත් වූ දැවිල්ල (වගුව 84) ඇතුළු අනෙකුත් යාන්ත්රණ ද උපකල්පනය කර ඇත.
සහජ දැවිල්ල සමඟ සම්බන්ධ වූ මානසික ආබාධ
සම්භාව්ය මනෝචිකිත්සක ආබාධ සහිත සමහර රෝගීන් තුළ සහජ දැවිල්ල / ස්වයං ප්රතිශක්තිකරණ ආබාධ ඇතිවේ. MDD, BPD, schizophrenia සහ භින්නෝන්මාදයෙහි ඇති ග්ලියල් ව්යාධිවේදය, ඉහළ සයිටොකයින් මට්ටම්, සයික්ලෝ-ඔක්සිජන්ස් මට්ටම්, සයික්ලෝ-ඔක්සිජන්ස් සක්රිය කිරීම, ග්ලූටමේට් අක්රමිකතා, S100B මට්ටම් වැඩි කිරීම, ඔක්සිකාරක ආතතිය වැඩි කිරීම සහ BBB අක්රිය වීම ඇතුළුව සහජ දැවිල්ල සම්බන්ධ CNS අසාමාන්යතා අපි සාකච්ඡා කරමු. මෙම ආබාධවල වාර්තා වන සාම්ප්රදායික මොනොඇමිනර්ජික් සහ ග්ලූටමැටර්ජික් අසාමාන්යතා සමඟ සහජ දැවිල්ල යාන්ත්රිකව සම්බන්ධ වන ආකාරය ද අපි විස්තර කරමු (රූපය 1 සහ 2). මනෝචිකිත්සක ආබාධවල ප්රති-ගිනි අවුලුවන කාරකයන්ගේ චිකිත්සක භූමිකාව ද සමාලෝචනය කෙරේ.
 Astroglial සහ Oligodendroglial Histopathology
Astroglial සහ Oligodendroglial Histopathology
Astroglia සහ oligodendroglia ස්නායු සඳහා අත්යවශ්ය වේ පරිවෘත්තීය homeostasis, හැසිරීම් සහ ඉහළ සංජානන කාර්යයන් [54-56,133-136]. සාමාන්ය නිශ්චල ඇස්ට්රොග්ලියා නියුරෝන වලට ශක්තිය සහ කුසලාන සහාය ලබා දෙයි, උපාගමික ස්නායු සම්ප්රේෂණය නියාමනය කරයි (රූපය 2), උපාගමනය, මස්තිෂ්ක රුධිර ප්රවාහය සහ BBB අඛණ්ඩතාව [134,136,137] පවත්වා ගනී. පරිණත oligodendroglia නියුරෝන සඳහා ශක්තිය සහ කුසලාන සහාය ලබා දෙන අතර BBB අඛණ්ඩතාව පවත්වා ගෙන යන අතර අක්ෂීය අලුත්වැඩියාව නියාමනය කරයි.සහ අන්තර් හා අන්තර් අර්ධගෝලීය සම්බන්ධතාවයක් සපයන සුදු පදාර්ථ පත්රිකා මයිලින් කිරීම [54-56]. astroglia සහ oligodendroglia යන දෙකම හානිකර ප්රදාහය පාලනය කළ හැකි ප්රති-ගිනි අවුලුවන සයිටොකයින් නිපදවයි [52,55].
MDD හි, ජ්යෝතිඃ ශාස්ත්රීය අලාභය යනු පූර්ව සින්ගුලේට් බාහිකය, ප්රෙෆ්රන්ටල් බාහිකය, ඇමිග්ඩලා සහ සුදු ද්රව්ය [35-38,42-46,55,138-147] ඇතුළුව ක්රියාකාරීව අදාළ ප්රදේශවල ස්ථාවර පශ්චාත් මරණ පරීක්ෂණයකි. ,42,43]. පශ්චාත් මරණ පරීක්ෂණ අධ්යයනයෙන් හෙළි වූයේ ග්ලියල් ෆයිබ්රිලරි ආම්ලික ප්රෝටීන් (GFAP)-ධනාත්මක තාරකා ඝනත්වය ප්රධාන වශයෙන් පූර්ව ඉදිරිපස බාහිකයේ [37,38] සහ ඇමිග්ඩලා [36] තුළ අඩු වී ඇති බවයි. මානසික අවපීඩනයෙන් පෙළෙන රෝගීන්ගෙන් ඉදිරිපස බාහිකයේ විශාල ප්රෝටෝමික් විශ්ලේෂණයක් GFAP සමස්ථානික තුනක සැලකිය යුතු අඩුවීමක් පෙන්නුම් කළේය [39]. සැලකිය යුතු ග්ලියල් අලාභයක් වාර්තා නොවූ එක් අධ්යයනයක වුවද, උප සමූහ විශ්ලේෂණයෙන් වයස අවුරුදු 75 ට අඩු අධ්යයන විෂයයන් අතර GFAP-ධනාත්මක තාරකා ඝනත්වයේ සැලකිය යුතු අඩුවීමක් (45%) අනාවරණය විය [35]. morphometric අධ්යයනයකින් ද ඒ හා සමානව ප්රමාද වූ MDD මොළයේ ග්ලියල් ඝනත්වයේ කිසිදු වෙනසක් පෙන්නුම් කර නොමැත [148]. වැඩිහිටි MDD රෝගීන් අතර පෙනෙන පරිදි ජ්යෝතිඃ ශාස්ත්රීය අලාභයක් නොමැතිකම සත්ය සෘණාත්මක අගයකට වඩා වැඩිහිටි වයස [35] සමඟ සම්බන්ධ වන ද්විතියික astrogliosis [42,50] පිළිබිඹු විය හැකි බව අපි උපකල්පනය කරමු.
සත්ව අධ්යයනයන් MDD හි ජ්යෝතිඃ ශාස්ත්රීය අලාභය පෙන්නුම් කරන මානව අධ්යයනයන්ට අනුකූල වේ. මානසික අවපීඩනය වැනි හැසිරීම් ප්රදර්ශනය කිරීමට ප්රසිද්ධ Wistar-Kyoto මීයන් මිනිසුන් තුළ නිරීක්ෂණය කරන ලද ප්රදේශවලම අඩු වූ තාරකා ඝනත්වය හෙළිදරව් කළේය [40]. Astroglial-විෂ කාරකය පරිපාලනය කිරීම, L-alpha-aminoadipic අම්ලය, මීයන් තුළ මානසික අවපීඩනය වැනි රෝග ලක්ෂණ ඇති කරයි, MDD හි තාරකා අලාභය ව්යාධිජනක බව යෝජනා කරයි [41].
MDD විෂයයන් පිළිබඳ පශ්චාත් මරණ අධ්යයනයන් මගින් ප්රෙෆ්රන්ටල් බාහිකයේ සහ amygdala [54-57,66] හි අඩු වූ ඔලිගොඩෙන්ද්රොග්ලියල් ඝනත්වය ලේඛනගත කර ඇත, සමහර MDD රෝගීන් තුළ විටින් විට සටහන් වන මොළයේ MRI නාභීය සුදු ද්රව්ය වෙනස්කම් සමඟ සහසම්බන්ධ විය හැකිය [57]. කෙසේ වෙතත්, ක්ෂුද්ර වාහිනී අසාමාන්යතා ද මෙම වෙනස්කම් වලට දායක විය හැක [57].
BPD හි, සමහර අධ්යයනයන් සැලකිය යුතු ග්ලියල් අලාභයක් [138,143,149,150] පෙන්නුම් කරන අතර අනෙක් ඒවා [37,44-46] නොවේ. මෙම නොගැලපෙන සොයාගැනීම් පාලනයක් නොමැතිකම නිසා ඇති විය හැක: 1) මනෝ ස්ථායීකාරක සමඟ ප්රතිකාර කිරීම, සමහර අධ්යයනයන් මගින් වාර්තා කරන ලද පශ්චාත්-විශ්ලේෂණ මගින් ලිතියම් සහ වැල්ප්රොයික් අම්ලය සමඟ ප්රතිකාර කිරීම පාලනය කිරීමෙන් පසුව පමණක් ග්ලියල් අලාභය සැලකිය යුතු ලෙස අඩු වී ඇති බැවින් [46]; 2) ශක්තිමත් පවුල් ඉතිහාසයක් ඇති BPD රෝගීන් අතර ග්ලියල් අලාභය විශේෂයෙන් කැපී පෙනෙන ලෙස BPD හි පවුල් ආකාර [143]; සහ/හෝ, 3) MDD [35-38,42-46,55,138-147] හි ග්ලියල් අලාභය නිතර සිදුවන බැවින් මානසික අවපීඩනයේ ප්රමුඛ තත්වය එදිරිව උමතුවයි. ග්ලියල් අලාභයෙන් වැඩි ප්රමාණයක් සඳහා ඇස්ට්රොග්ලියා හෝ ඔලිගොඩෙන්ඩ්රොග්ලියා ද යන්න පැහැදිලි නැත; ප්රෝටියෝමික් විශ්ලේෂණය මගින් එක් තාරකා GFAP සමස්ථානිකයේ සැලකිය යුතු අඩුවීමක් [39] හෙළිදරව් කරන ලද අතර, තවත් පශ්චාත් මරණ පරීක්ෂණ කිහිපයක් මගින් වෙනස් නොවූ [36,37] හෝ orbitrofrontal බාහිකයේ GFAP-ධනාත්මක තාරකා ප්රකාශනය අඩු වී ඇති බව [47], හෝ oligodendroglial ඝනත්වය අඩු වී ඇත. 54-56,58,59].
භින්නෝන්මාදයේ දී, ජ්යෝතිඃ ශාස්ත්රීය අලාභය අස්ථායී සොයා ගැනීමකි [48,150]. සමහර අධ්යයනවලින් සැලකිය යුතු තාරකා අලාභයක් [42,50,51] නොපෙන්වූ අතර, තවත් සමහරක් තාරකා ඝනත්වය [37,38,43,44,48,49,151] සහ GFAP සමස්ථානික දෙකක සැලකිය යුතු අඩු කිරීම් [39] සොයා ගත්හ. නොගැලපෙන සොයාගැනීම් ඇති විය හැක: 1) MDD comorbidity, බොහෝ විට glial අහිමි වීම සමඟ සම්බන්ධ වේ; 2) වයස් විචලනය, වැඩිහිටි රෝගීන් GFAP-ධනාත්මක astroglia [35,42,50] වැඩි වී ඇති බැවින්; 3) කලාපීය [150] සහ බාහික ස්ථරයේ විචල්යතාවය [48]; 4) පර්යේෂණාත්මක අධ්යයනවලින් පෙන්නුම් කරන පරිදි ප්රති-සයිකෝටික ඖෂධ සමඟ ප්රතිකාර කිරීම, නිදන්ගත ප්රති-මනෝචිකිත්සක ප්රතිකාරවලට සම්බන්ධ [152] සහ [153] ජ්යෝතිඃ-ඝනත්වය වැඩි වීම යන දෙකම පෙන්නුම් කරයි; සහ 70) රෝගී තත්ත්වය (උදාහරණයක් ලෙස, සියදිවි නසාගැනීම් සහ සියදිවි නසාගැනීම් නොවන හැසිරීම්) [5]. පශ්චාත් මරණ පරීක්ෂණ අධ්යයනයන් මගින් ඔලිගොඩෙන්ද්රොග්ලියල් අලාභය [154-54,56,60], විශේෂයෙන් පූර්ව ඉදිරිපස බාහිකයේ, ඉදිරිපස සින්ගුලේට් බාහිකයේ සහ හිපොකැම්පස් [65,148,155,156] තුළ වාර්තා විය. පූර්ව ප්රදේශයේ අල්ට්රා ව්යුහාත්මක පරීක්ෂණයේදී අළු සහ සුදු ද්රව්ය දෙකෙහිම අසාමාන්ය ලෙස මයිලිනේටඩ් කෙඳි පෙන්නුම් කරන ලදී; අසනීපයේ වයස සහ කාලසීමාව යන දෙකම සුදු පදාර්ථ අසාමාන්යතා සමඟ ධනාත්මකව සම්බන්ධ වී ඇත [148].
ජ්යෝතිඃ ශාස්ත්රීය ව්යාප්තිය [136] සමඟ පොදුවේ සම්බන්ධ වන ස්නායු විකෘතිතා ආබාධවලට ප්රතිවිරුද්ධව, මනෝචිකිත්සක ආබාධ ඒ වෙනුවට අඩු වූ හෝ නොවෙනස් වූ තාරකා ඝනත්වය සමඟ සම්බන්ධ වේ [138]. මුල්-ආරම්භක මනෝචිකිත්සක ආබාධ [44,138] හි වැඩි ග්ලියල් ඝනත්වය නොමැතිකම, මනෝචිකිත්සක රෝග වල පිරිහෙන ප්රගතියේ මන්දගාමී අනුපාතය පිළිබිඹු කරයි [138].
මනෝචිකිත්සක අක්රමිකතා හා සම්බන්ධ පරිහානීය වෙනස්කම් සූක්ෂම සහ ජ්යෝතිඃ ශාස්ත්රීය අන්තර් සෛලීය පිටපත් කිරීමේ සාධක අවුලුවාලීමට ප්රමාණවත් නොවන බව අපි උපකල්පනය කරමු, සම්ප්රේෂණ 3 හි සංඥා පරිවර්තක සක්රියකාරකය සහ න්යෂ්ටික සාධකය kappa B (NF-?B) [136] ඇතුළුව astrogliosis ධනාත්මකව නියාමනය කරයි.
පශ්චාත් මරණ පරීක්ෂණ අධ්යයනයන්හි බහුතරයක් MDD, BPD සහ භින්නෝන්මාදයෙහි ග්ලියල් ඝනත්වය වෙනස් කිරීම කෙරෙහි අවධානය යොමු කළ අතර, අනෙක් අය මිශ්ර සොයාගැනීම් සමඟ ග්ලියල් සෛල රූප විද්යාව වෙනස් කිරීම විස්තර කළහ. MDD සහ BPD වලදී, glial ප්රමාණය වැඩි වී හෝ වෙනස් නොවේ [55]. එක් අධ්යයනයකින් BPD සහ භින්නෝන්මාදයෙහි අඩු වූ glial ප්රමාණය සොයා ගන්නා ලද නමුත් MDD [43] තුළ නොවේ. සියදිවි නසාගත් මානසික අවපීඩනයෙන් පෙළෙන රෝගීන් පිළිබඳ පශ්චාත් මරණ පරීක්ෂණයකින් හෙළි වූයේ ඉදිරිපස සින්ගුලේට් සුදු පදාර්ථයේ තාරකා ප්රමාණය වැඩි වී ඇති නමුත් බාහිකයේ නොවේ [158]. භින්නෝන්මාද විෂයයන් පිළිබඳ එක් අධ්යයනයකින් හෙළි වූයේ පෘෂ්ඨවංශික පූර්ව ඉදිරිපස බාහිකයේ V ස්ථරයේ තාරකා ප්රමාණය කැපී පෙනෙන ලෙස අඩු වී ඇති නමුත් තාරකා ඝනත්වය එකම ස්ථරයේ පාලනයට වඩා දෙගුණයකි [48]. මිශ්ර ප්රතිඵල මගින් astroglia එදිරිව oligodendroglia [148] ලෙස සඳහන් නොකළ මානසික රෝගවල glial වෙනස්වීම් පිළිබඳ පූර්ව අධ්යයනයන් අර්ධ වශයෙන් පිළිබිඹු විය හැක.
මනෝචිකිත්සක රෝග වල ග්ලියල් නැතිවීම අසාමාන්ය සයිටොකීන් මට්ටම් (සයිටොකයින් අංශය බලන්න), අක්රමික ග්ලූටමේට් පරිවෘත්තීය (ග්ලූටමේට් අංශය බලන්න), උස් වූ S100B ප්රෝටීන් (S100B කොටස බලන්න) ඇතුළු යාන්ත්රණ කිහිපයක් හරහා ස්නායු ප්රදාහයට දායක විය හැක.සහ වෙනස් කරන ලද BBB ක්රියාකාරිත්වය (රුධිර මොළයේ බාධක අංශය බලන්න), එහි ප්රතිඵලයක් ලෙස සංජානනය සහ හැසිරීම දුර්වල වේ [44,45,54,133,159].
ක්ෂුද්ර ග්රහලෝක රෝග විද්යාව
Microglia යනු CNS හි නේවාසික ප්රතිශක්තිකරණ සෛල වේ. ඔවුන් අඛණ්ඩ ප්රතිශක්තිකරණ නිරීක්ෂණ සපයන අතර සංවර්ධන උපාගම කප්පාදුව නියාමනය කරයි [160,161]. CNS තුවාලය ramified Resting microglia සක්රිය දිගටි සැරයටිය හැඩැති සහ macrophage වැනි phagocytic amoeboid සෛල බවට පරිවර්තනය කරයි, එය chemotactic gradients (එනම්, micro-glial activation and proliferation (MAP)) [161] ඔස්සේ තුවාල වූ ස්ථානය දෙසට පැතිරී සංක්රමණය වේ. මානව ක්ෂුද්ර ග්ලියල් සෛල NMDAR ප්රකාශ කරන අතර එය නියුරෝන තුවාල වලට තුඩු දෙන MAP මැදිහත් විය හැකිය [162].
MDD, BPD සහ භින්නෝන්මාදය තුළ, MAP පවතින බව විමර්ශනය කරන පශ්චාත් මරණ පරීක්ෂණවල ප්රතිඵල මිශ්ර වේ. පශ්චාත් මරණ පරීක්ෂණ අධ්යයනයන් MDD විෂයයන් පහෙන් එකක පමණක් ඉහළ MAP අනාවරණය කර ඇත [67]. සමහර BPD ආබාධ සහිත රෝගීන් තුළ, මානව ලියුකෝසයිට් ප්රතිදේහජනක-ඩීආර්-ධනාත්මක මයික්රොග්ලියාව වැඩි වීම, ඝණීකෘත ක්රියාවලීන් පෙන්නුම් කිරීම ඉදිරිපස බාහිකයේ [69] ලේඛනගත කර ඇත. භින්නෝන්මාදයේදී, සමහර අධ්යයනයන් පාලනයන්ට සාපේක්ෂව ඉහළ MAP වාර්තා කර ඇති අතර, අනෙක් ඒවා කණ්ඩායම් [22,67,70] අතර වෙනසක් නොපෙන්වයි. MDD සහ BPD හි MAP තක්සේරු කරන පශ්චාත් මරණ පරීක්ෂණයකදී; පාලනයන්ට සාපේක්ෂව සියදිවි නසාගත් MDD සහ BPD රෝගීන්ගේ subgenual anterior සින්ගුලේට් බාහිකයේ සහ ඉදිරිපස මැද සින්ගුලේට් බාහිකයේ ක්විනොලිනික් අම්ල-ධනාත්මක මයික්රොග්ලියල් සෛල ඝනත්වය වැඩි විය [53]. පශ්චාත්-කාලීන විශ්ලේෂණයෙන් හෙළි වූයේ මෙම වැඩි වූ MAP තනිකරම MDD වලට මිස BPD වලට නොවන බවයි, මන්ද MDD විෂයයන් වල ධනාත්මක ක්ෂුද්ර ග්ලියල් ප්රතිශක්තිකරණ පැල්ලම් BPD උප කාණ්ඩයේ subgenual anterior cingulate සහ midcingulate cortices දෙකෙහිම වඩා සැලකිය යුතු ලෙස වැඩි වූ බැවිනි. මයික්රොග්ලියා ඝනත්වය BPD සහ පාලන කණ්ඩායම් දෙකෙහිම සමාන විය [53]. ආබාධ තුනම (එම්ඩීඩී නවයක්, බීපීඩී පහක්, භින්නෝන්මාදය දහහතරක්, සෞඛ්ය සම්පන්න පාලනයන් දහයක්) සංසන්දනය කරන ලද අධ්යයනයකින් කාණ්ඩ හතර හරහා ක්ෂුද්ර ග්ලියල් ඝනත්වයේ සැලකිය යුතු වෙනසක් පෙන්නුම් කර නොමැත [68].
මෙම මිශ්ර ප්රතිඵල විවිධ අධ්යයන [70] අතර භාවිතා කරන විචල්ය ක්ෂුද්ර ග්ලියල් ප්රතිශක්තිකරණ සලකුණු සහ/හෝ රෝගයේ බරපතලකම [22,53,68] පාලනය කිරීමට අසමත් වීම ආරෝපණය කළ හැකිය. සැලකිය යුතු ලෙස, MDD සහ භින්නෝන්මාද විෂයයන් පිළිබඳ පශ්චාත් මරණ අධ්යයනයන් තුනක් මනෝචිකිත්සක රෝග විනිශ්චය [22,53,68] මත පදනම්ව, පූර්ව සින්ගුලේට් බාහිකයේ සහ මධ්යස්ථ තලමස් හි MAP සහ සියදිවි නසාගැනීම් අතර ප්රබල ධනාත්මක සහසම්බන්ධයක් ලේඛනගත කර ඇත. මේ අනුව, MAP යනු MDD සහ භින්නෝන්මාදය සඳහා ලක්ෂණ සලකුණකට වඩා රාජ්යයක් විය හැකිය.
OCD හි, හෝමියෝබොක්ස් ට්රාන්ස්ක්රිප්ෂන් සාධකය සංකේතනය කරන Hoxb8 ජානය ප්රකාශ කිරීම වැනි ඇතැම් ක්ෂුද්ර ග්ලියල් ෆීනෝටයිප් අක්රිය වීම සහ අඩු කිරීම OCD වැනි හැසිරීම් ඇති කළ හැකි බව සත්ව ආකෘති යෝජනා කරයි.
Hoxb8 knockout මීයන් අඩු වූ ක්ෂුද්ර ග්ලියල් ඝනත්වය [71,72] ආශ්රිතව අධික මනරම් හැසිරීම් සහ කාංසාව ප්රදර්ශනය කරයි. මෙම අධික මනමාල හැසිරීම මානව OCD හි හැසිරීම් ලක්ෂණ වලට සමාන වේ. වැඩිහිටි Hoxb8 knockout මීයන් තුළ Hoxb8 එන්නත් කිරීම ක්ෂුද්ර ග්ලියල් පාඩුව ආපසු හරවා සාමාන්ය හැසිරීම යථා තත්වයට පත් කරයි [71,72]. මානව OCD හි මෙම විශේෂිත ක්ෂුද්ර ග්ලියල් ෆීනෝටයිප් වල කාර්යභාරය අපැහැදිලි ය.
පර්යේෂණාත්මක දත්ත යෝජනා කරන්නේ MAP විශේෂිත හානිකර සහ ස්නායු ආරක්ෂණ ෆීනෝටයිප් වලින් සමන්විත වන බවයි (රූපය 2). හානිකර microglia ප්රධාන histocompatibility සංකීර්ණ II (MHC-II) ප්රකාශ නොකරන අතර, එම නිසා, ප්රතිදේහජනක ඉදිරිපත් කරන සෛල (APC) [163,164] ලෙස ක්රියා කළ නොහැක; ඔවුන් ප්රෝඉන්ෆලමේටික් සයිටොකයින් නිෂ්පාදනය, නයිට්රික් ඔක්සයිඩ් සින්තේස් සිග්නල් කිරීම [17,69,165] හරහා හානිකර බලපෑම් [17,166] ප්රවර්ධනය කරයි, ග්ලියල් සහ බීබීබී-පෙරිසයිට්/එන්ඩොතලියල් සයික්ලොඔක්සිජෙනේස්-2 (COX-2) ප්රකාශනය [167] ප්රවර්ධනය කිරීම, S100eeB100 astrogliion ස්රාවය ප්රේරණය කිරීම කොටස), සහ ක්ෂුද්ර ග්ලූටමේට් මුදා හැරීම [17,136,168,169]. හානිකර මයික්රොග්ලියා ප්රොස්ටැග්ලැන්ඩින් E-2 (PGE-2) ස්රාවය කරයි, එය ප්රෝගිනි අවුලුවන සයිටොකයින් නිෂ්පාදනය ප්රවර්ධනය කරයි, එමඟින් පෝෂණ-ඉදිරි චක්රයක PGE-2 මට්ටම් වැඩි කරයි [29]. තවද, PGE-2 COX-2 ප්රකාශනය උත්තේජනය කරයි, එය වෙනත් පෝෂක-ඉදිරි චක්රයක් පිහිටුවීමට, අරකිඩොනික් අම්ලය PGE-2 බවට පරිවර්තනය කිරීම මැදිහත් කරයි [29].
Neuroprotective microglia ප්රතිවිරුද්ධ ලෙස දැක්විය හැක: 1) MHC-II in vivo සහ in vitro [163,166] සහ cognate APC ලෙස ක්රියා කරයි (රූපය 2) [163,164,166]; 2) ප්රති-ගිනි අවුලුවන සයිටොකයින් [17], මොළයේ ව්යුත්පන්න නියුරෝට්රොෆික් සාධකය [17], සහ ඉන්සියුලින් වැනි වර්ධන සාධකය-1 [166] ස්රාවය කිරීම ප්රවර්ධනය කිරීම මගින් සුව කිරීමට පහසුකම් සැලසීම සහ නියුරෝන තුවාල සීමා කිරීම; සහ 3) excitatory ඇමයිනෝ අම්ල වාහක-2 (EAAT2) අතිරික්ත බාහිර සෛල ග්ලූටමේට් ඉවත් කරයි [163,166], සහ neuroprotective T lymphocytic autoimmunity ප්රවර්ධනය කරයි (රූපය 2) [163,164]. කෙසේ වෙතත්, මිනිසුන්ගේ ස්නායු මනෝචිකිත්සක ආබාධ සඳහා ස්නායු ආරක්ෂණ මයික්රොග්ලියාගේ දායක භූමිකාව තහවුරු කිරීම සඳහා තවත් අධ්යයනයන් අවශ්ය වේ.
එන්නත් වේ සත්ව අධ්යයනවලින් පෙනී යන්නේ ගිනි අවුලුවන ප්රති-නියාමන යාන්ත්රණ [15,74,164,166] හි ශුද්ධ බලපෑම මගින් හානිකර එදිරිව ස්නායු ආරක්ෂක මයික්රොග්ලියා අනුපාතය බලපෑ හැකි බවයි. මෙම යාන්ත්රණයන්ට ස්නායු ආරක්ෂණ CD4+CD25+FOXP3+ T නියාමන සෛල ගණන ((T regs) Figure 1) [15,74,164,166] සහ මොළයේ සයිටොකීන් මට්ටම් ඇතුළත් වේ; අඩු IFN-? මට්ටම් ස්නායු ආරක්ෂණ ක්ෂුද්ර ග්ලියා ප්රවර්ධනය කළ හැකිය (රූපය 2) [166], නමුත් ඉහළ මට්ටම් මගින් හානිකර සංසිද්ධිය [166] ප්රවර්ධනය කළ හැකිය.
සයිටොකයින් වල කාර්යභාරය
ප්රෝඉෆ්ලමේටින සයිටොකයින්වලට IL-1?, IL-2, IL-6, TNF- ඇතුළත් වේ. සහ IFN-?. ඒවා ප්රධාන වශයෙන් ස්රාවය වන්නේ ක්ෂුද්ර ග්ලියා, Th1 ලිම්ෆොසයිට් සහ M1 ෆීනෝටයිප් මොනොසයිට්/මැක්රෝෆේජ් මගිනි (රූපය 1) [15,170]. ඔවුන් හානිකර දැවිල්ල ප්රවර්ධනය කරයි. ප්රති-ගිනි අවුලුවන සයිටොකයිනවලට IL-4, IL-5 සහ IL-10 ඇතුළත් වේ. ඒවා ප්රධාන වශයෙන් ස්රාවය වන්නේ astroglia මගින්Th2 lymphocytes, T regs සහ M2 phenotype monocytes/ macrophages [15,52,74]. ප්රෝගිනි අවුලුවන M15,74-ෆීනෝ-වර්ගය ප්රයෝජනවත් ප්රති-ගිනි අවුලුවන M1-ෆීනෝටයිප් [2] බවට පරිවර්තනය කිරීමෙන් සහ ස්නායු ආරක්ෂණ ක්ෂුද්ර ග්ලියල් ෆීනෝටයිප් [15] ප්රවර්ධනය කිරීමෙන් ඔවුන්ට හානිකර දැවිල්ල [15,17,74,163,166] සීමා කළ හැකිය. මනෝචිකිත්සක ආබාධ සඳහා ප්රෝගිනි අවුලුවන / ප්රති-ගිනි අවුලුවන සයිටොකයින් වල භූමිකාව සාක්ෂි රේඛා කිහිපයකින් සහාය දක්වයි (රූපය 1, වගුව 2) [15,17,29,52,74].
MDD හි, සෙරුමය ප්රෝඉන්ෆ්ලෙමිණි සයිටොකයින්වල නවතම මෙටා විශ්ලේෂණය (අධ්යයන 29, MDD, 822 සෞඛ්ය සම්පන්න පාලනයන්) ද්රාව්ය IL-726 ප්රතිග්රාහක, IL-2 සහ TNF-? MDD (ලක්ෂණ සලකුණු) [6] තුළ මට්ටම් වැඩි වන අතර, IL-91?, IL-1, IL-2, IL-4 සහ IL-8, පාලන වලින් සංඛ්යානමය වශයෙන් වෙනස් නොවේ [10]. MDD උප කණ්ඩායම් (91 සියදිවි නසාගැනීම්- MDD, 47-සියදිවි නසාගැනීම් නොවන MDD, 17 සෞඛ්ය පාලන) සංසන්දනය කරන ප්රාථමික සයිටොකයින් අධ්යයනයකදී, සේරා IL-16 සහ TNF- දෙකම? අනෙකුත් කණ්ඩායම් දෙකටම සාපේක්ෂව සියදිවි නසාගත් MDD විෂයයන් තුළ IL-6 මට්ටම් සැලකිය යුතු ලෙස අඩු වූ අතර [2]. මෙම සොයාගැනීමෙන් ඇඟවෙන්නේ IL-96 සහ TNF-? MDD හි රාජ්ය සලකුණු ද වේ [6]. උග්ර සියදිවි නසාගැනීමේ හැසිරීම් හා සම්බන්ධ සෙරුමය IL-96 මට්ටම් අඩුවීම මොළයේ එහි ඉහළ නියාමනය කරන ලද ප්රතිග්රාහකයට වැඩි බැඳීමක් පිළිබිඹු කරයි; MDD [2] හි වැඩි ද්රාව්ය IL-2 ප්රතිග්රාහකයක් පෙන්නුම් කරන ඉහත සඳහන් කළ මෙටා විශ්ලේෂණයට සමාන්තරව. MDD හි සයිටොකයින්වල සායනික වැදගත්කම විමර්ශනය කරන ලද අධ්යයනවලින් පෙන්නුම් කළේ උග්ර මානසික අවපීඩන කථාංග [91] වලදී සෙරුමය සයිටොකයින් මට්ටම ඉහළ යන අතර විෂාදනාශක [171,172] සහ විද්යුත් කම්පන ප්රතිකාර [17] සමඟ ප්රතිකාර කිරීමෙන් සාර්ථක නමුත් අසාර්ථක වීමෙන් පසුව සාමාන්යකරණය වන බවයි; මෙම සොයාගැනීම් සයිටොකයින් සඳහා විය හැකි ව්යාධිජනක භූමිකාවක් යෝජනා කරයි.
BPD හි, සෙරුම් සයිටොකයින් වෙනස් කිරීම් මෑත සමාලෝචනයක දී සාරාංශ කර ඇත; උමතු සහ මානසික අවපීඩන අවධියේදී TNF-?, IL-6 සහ IL-8 ඉහළ නංවන අතර, IL-2, IL-4 සහ IL-6 උන්මාදය තුළදී ඉහළ යයි [92]. වෙනත් අධ්යයනවලින් පෙන්නුම් කළේ සේරා IL-1? සහ IL-1 ප්රතිග්රාහක මට්ටම් සංඛ්යානමය වශයෙන් සෞඛ්ය සම්පන්න පාලනයන්ට වඩා වෙනස් නොවේ [92], නමුත් පටක අධ්යයනයෙන් IL-1 මට්ටම් වැඩි වී ඇති බව ලේඛනගත කර තිබේද? සහ BPD ඉදිරිපස බාහිකයේ IL-1 receptor [69].
භින්නෝන්මාදයේදී, සයිටොකයින් අසාමාන්යතා විමර්ශනය කිරීමේ අධ්යයනයන්හි ප්රතිඵල පරස්පර වේ (වගුව 2). සමහර අධ්යයනයන් මගින් සෙරුමය ප්රෝඉන්ෆ්ලෙමේෂන් අඩුවීම (IL-2, IFN-?) සහ සෙරුමය සහ CSF ප්රති-ගිනි අවුලුවන සයිටොකයින් (IL-10) [52] වැඩි වීම යන දෙකම සොයා ගත් අතර, අනෙක් අය විසින් ප්රෝඉන්ෆලමේටික් ආකාරයේ ආධිපත්යයක් සහිත ඉහළ සෙරුමය ප්රෝ- සහ ප්රති-ගිනි අවුලුවන සයිටොකයින් සොයා ගන්නා ලදී. ]. එක් සයිටොකයින් මෙටා විශ්ලේෂණයක් (අධ්යයන 22,173,174 ක්, භින්නෝන්මාදය 62 ක්, සෞඛ්ය සම්පන්න පාලනයන් 2,298 ක්) IL-858R ප්රතිවිරෝධක, sIL-1R සහ IL-2 [6] මට්ටම් වැඩි වී ඇති බව පෙන්නුම් කළේය. කෙසේ වෙතත්, මෙම අධ්යයනයෙන් ප්රොඉන්ෆලමේටික් සයිටොකයින් නිෂ්පාදනය [174] වැඩි දියුණු කරයි යැයි සැලකෙන ප්රති-මනෝ නාශක භාවිතය සඳහා හේතු වී නැත. වඩාත් මෑතකාලීන සයිටොකයින් මෙටා-විශ්ලේෂණයක් (අධ්යයන 52 ක්, භින්නෝන්මාද 40 ක්,4,401 පාලන) ප්රති-මනෝ නාශක සඳහා ගිණුම්ගත කර ඇති අතර, TNF-?, IFN-?, IL-12 සහ sIL-2R නිදන්ගත භින්නෝන්මාදය තුළ රෝග ක්රියාකාරකම් වලින් ස්වාධීනව (ලක්ෂණ සලකුණු) නිරන්තරයෙන් ඉහළ යන බව සොයා ගන්නා ලදී, IL-1?, IL-6 සහ පරිවර්තන වර්ධන සාධකය බීටා රෝග ක්රියාකාරකම් සමඟ ධනාත්මකව සහසම්බන්ධ වේ (රාජ්ය සලකුණු)[173]. භින්නෝන්මාදයෙන් පෙළෙන රෝගීන්ගෙන් ලබාගත් පර්යන්ත රුධිර ඒක න්යෂ්ටික සෛලවල (PBMC) සෛල සංස්කෘතීන් IL-8 සහ IL-1 ඉහළ මට්ටම් නිෂ්පාදනය කළේද? ස්වයංසිද්ධව මෙන්ම LPS මගින් උත්තේජනය කිරීමෙන් පසුව, භින්නෝන්මාද ව්යාධි විද්යාවේ [175] සක්රිය මොනොසයිට්/මැක්රෝෆේජ් සඳහා භූමිකාවක් යෝජනා කරයි.
OCD හි, සෙරා සහ CSF සයිටොකයිනවල අහඹු සමීක්ෂණයක ප්රතිඵල සහ LPS-උත්තේජනය කරන ලද PBMC අධ්යයනයන්හි ප්රතිඵල නොගැලපේ [93-95,176-179]. TNF- හි ප්රවර්ධක කලාපයේ OCD සහ ක්රියාකාරී බහුරූපතාව අතර සහසම්බන්ධයක් තිබේද? ජාන [34], අඩු බලැති අධ්යයනයන් මෙම සම්බන්ධය තහවුරු නොකළද [180]. එබැවින්, ලේඛනගත කිරීමේ අධ්යයනවලින් මිශ්ර ප්රතිඵල TNF- වැඩි වී හෝ අඩු වී තිබේද? සයිටොකයින් මට්ටම් [93,176-178] මෙම විශේෂිත බහුරූපතාව සමඟ OCD විෂයයන් හි ඔවුන්ගේ විචල්ය ඇතුළත් කිරීම් ඔවුන්ගේ සමූහ තුළ පිළිබිඹු විය හැක.
ප්රධාන මානසික අවපීඩනය සහ භින්නෝන්මාදය තුළ සයිටොකයින් ප්රතිචාර ධ්රැවීකරණය
සයිටොකයින් ප්රතිචාර සංසිද්ධි නියාමනය කරන ප්රතිශක්තිකරණ ක්රියාවන්ට අනුව ප්රෝඉන්ෆ්ලේමන්ට් Th1 (IL-2, IFN-?) හෝ ප්රති-ගිනි අවුලුවන Th2 (IL-4, IL-5, IL-10) ලෙස වර්ග කෙරේ. Th1 සයිටොකයින් අභ්යන්තර සෛලීය ප්රතිදේහජනක වලට එරෙහිව යොමු කරන ලද සෛල-මැදිහත් වූ ප්රතිශක්තිය නියාමනය කරන අතර, Th2 සයිටොකයින් බාහිර සෛලීය ප්රතිදේහජනක [29,52] වෙත යොමු කරන හාස්යජනක ප්රතිශක්තිය නියාමනය කරයි. Th1 සයිටොකයින් Th1 ලිම්ෆොසයිට් සහ M1 මොනොසයිට් මගින් නිපදවන අතර Th2 සයිටොකයින් Th2 ලිම්ෆොසයිට් සහ M2 මොනොසයිට් [29,52] මගින් නිපදවනු ලැබේ. මොළයේ, මයික්රොග්ලියා ප්රධාන වශයෙන් Th1 සයිටොකයින් ස්රාවය කරන අතර, ඇස්ට්රොග්ලියා ප්රධාන වශයෙන් Th2 සයිටොකයින් [29,52] ස්රාවය කරයි. මෙතැන් සිට Th1:Th2 සයිටොකයින්වල අන්යෝන්ය අනුපාතය, ‛Th1-Th2 seesaw,’ සක්රිය මයික්රොග්ලියා (අතිරික්ත Th1) සිට astroglia (අතිරික්ත Th2) දක්වා අනුපාතය සහ සක්රිය T සෛල සහ අධික CNS ග්ලූටමේට් මට්ටම් අතර අන්තර් ක්රියාකාරිත්වය මගින් අපි උපකල්පනය කළෙමු. Th1 ප්රතිචාරයට පක්ෂව (රූපය 2) [29,163,166].
Th1-Th2 සීසෝ අසමතුලිතතාවය එහි එන්සයිම [21,52] වෙනස් කිරීමෙන් ට්රිප්ටෝෆාන් පරිවෘත්තීය ක්රියාවලියට බලපෑම් කළ හැකි අතර එමඟින් ට්රිප්ටෝෆාන් උත්ප්රේරණය කිනුරනීන් (KYN) සහ KYN කැටබොලිස්ම එහි පහළ පරිවෘත්තීය දෙකෙන් එකක් දෙසට මාරු කරයි; මයික්රොග්ලියා ක්විනොලිනික් අම්ලය එනම් Th1 ප්රතිචාර-මධ්යස්ථ හෝ ජ්යෝතිඃ ශාස්ත්රීය කිනුරේනික් අම්ලය (KYNA) (රූපය 1) එනම් Th2 ප්රතිචාර-මැදිහත් [21,29,170].
Th1-Th2 seesaw මගින් බලපෑමට ලක් වූ ට්රිප්ටෝෆාන් පරිවෘත්තීය එන්සයිමවලට ඇතුළත් වේ (රූපය 1): indoleamine 2,3-dioxygenase (IDO), microglia සහ astroglia මගින් ප්රකාශිත, ට්රිප්ටෝෆාන් KYN සහ serotonin 5- දක්වා පරිවර්තනය කිරීමට මැදිහත් වන අනුපාත සීමා කරන එන්සයිම වේ. හයිඩ්රොක්සින්ඩෝලෙඇසිටික් අම්ලය[21,29]. Kynurenine 3-monooxygenase (KMO), මයික්රොග්ලියා මගින් පමණක් ප්රකාශිත වේ, KYN 3-hydroxykynurenine (3-OH-KYN) බවට පරිවර්තනය කරන අනුපාත සීමා කරන එන්සයිමය වන අතර එය තවදුරටත් ක්විනොලිනික් අම්ලයට පරිවෘත්තීය වේ [21,29]. ට්රිප්ටෝෆාන්-2,3-ඩයොක්සිජනේස් (TDO), තනිකරම ඇස්ට්රොග්ලියා මගින් ප්රකාශිත වේ, එය පරිවර්තනය කරන අනුපාත සීමා කරන එන්සයිමය වේ.ට්රිප්ටෝෆාන් KYN වෙත [21,29]. Kynurenine aminotransferase (KAT), මූලික වශයෙන් ජ්යෝතිඃ ශාස්ත්රීය ක්රියාවලීන්හිදී ප්රකාශිත වේ, KYN KYNA [21,29] බවට පරිවර්තනය කිරීම සඳහා මැදිහත් වන අනුපාත සීමා කරන එන්සයිමය වේ.
Th1 සයිටොකයින් ක්ෂුද්ර ග්ලියල් IDO සහ KMO සක්රීය කරයි, ක්විනොලිනික් වෙත මයික්රොග්ලියල් KYN කැටබොලිස් මාරු කරයිඅම්ල (NMDAR agonist) සංශ්ලේෂණය, Th2 සයිටොකයින් ක්ෂුද්ර ග්ලියල් IDO සහ KMO සක්රීය කරයි, තාරකා KYN උත්ප්රේරණය TDO- සහ KAT-මැදිහත් වූ KYNA (NMDAR ප්රතිවිරෝධක) සංශ්ලේෂණය වෙත මාරු කරයි (රූපය 1) [21,29].
MDD සහ භින්නෝන්මාදය සඳහා Th1 සහ Th2 ප්රමුඛ ප්රතිශක්තිකරණ ප්රතිශක්තිකරණ පිළිවෙළින්, CNS, සයිටොකයින් රටා [52,173] වලට වඩා පර්යන්ත මත පදනම්ව යෝජනා කර ඇත. පර්යන්ත සයිටොකයින් රටා CNS හි ඇති විශ්වාස කළ නොහැකි ආදේශක සලකුණු බව අපි විශ්වාස කරමු. ඇත්ත වශයෙන්ම, පර්යන්ත සයිටොකයින් මට්ටම්වලට බොහෝ අමතර-CNS විචල්යයන් බලපෑම් කළ හැකි අතර, ඒවා ඇතුළුව පර්යන්ත සයිටොකයින් අධ්යයනයන් කිහිපයක නිරතුරුවම පාලනය නොකෙරේ: 1) වයස, ශරීර ස්කන්ධ දර්ශකය, මනෝචිකිත්සක ඖෂධ, දුම්පානය, ආතතිය සහ චක්රීය උච්චාවචනයන්; 2) බලපෑමතෝරාගත් සයිටොකයින් සංස්ලේෂණය [95,173] නිෂ්පාදනය පිළිබඳ රෝග ක්රියාකාරකම් / තත්ත්වය; සහ 3) සයිටොකයින් නිෂ්පාදනයට මනෝවිද්යාත්මක නියෝජිතයන්ගේ බලපෑම් [52]. කෙටි අර්ධ ආයු කාලය සහ සීරම් සයිටොකයින් වල වේගවත් පිරිවැටුම [181] (උදාහරණයක් ලෙස, TNF- සඳහා විනාඩි 18? [182] IL-60 සඳහා මිනිත්තු 10 [183]), ඒවායේ අර්ථකථනය කිරීමේ විශ්වසනීයත්වය තවදුරටත් සීමා කළ හැකිය. අහඹු සේරා නියැදීමෙන් මනිනු ලබන මට්ටම්.
MDD හි, ප්රෝගිනි අවුලුවන Th1 ප්රතිශක්තිකරණ ප්රතිචාරයක් ප්රමුඛ වන බවට සම්මුතියක් ඇත (වගුව 2) [17,29]. පශ්චාත් මරණ MDD මොළයේ ක්විනොලිනික් අම්ලයේ ඉහළ මට්ටම් [53], ඉහළ නියාමනය කළ Th1 ප්රතිචාරයක් ඇති බව යෝජනා කරයි (රූපය 1) [21,29]. CNS ක්විනොලිනික් අම්ලය වැඩි කිරීම මගින් මානව ඇස්ට්රොග්ලියා [184] හි කැල්සියම් ප්රවාහය මධ්යගත ඇපොප්ටෝසිස් ප්රවර්ධනය කළ හැකි අතර, එය උපකල්පිතව මොට කළ හැක.astroglia-ව්යුත්පන්න Th2 ප්රතිචාරය [29], ක්ෂුද්ර ග්ලියල් Th1 ප්රතිචාරයට පක්ෂව Th2 එදිරිව Th1 තුණ්ඩ සමතුලිතතාවය බලන්න. CNS hyposerotonergia [29] අතිරික්ත Th1 ප්රතිචාරයකට තවදුරටත් සහය එක් කරයි, එය CNS serotonin සංස්ලේෂණය අඩු කිරීමට [185] සහ එහි ක්ෂය වීම වැඩි කිරීමට (Figure 1) [21,29] පෙන්වයි.
CNS hyperglutamatergia ද මොළයේ අතිරික්ත Th1 ප්රතිචාරයකට දායක විය හැක (රූපය 2). in vitro අධ්යයනයකින් ඇඟවෙන්නේ පර්යන්ත විවේක ටී ලිම්ෆොසයිට මගින් පරිවෘත්තීය ග්ලූටමේට් ප්රතිග්රාහක 5 (mGluR5) [164] ප්රකාශ කරන බවයි, ග්ලූටමේට් සමඟ බන්ධනය වීම ලිම්ෆොසයිටික් IL-6 මුදා හැරීම වළක්වන අතර එමඟින් ස්වයංක්රීය ප්රතික්රියාශීලී T-ඵලය අඩු කරයි [164]. සක්රිය ටී ලිම්ෆොසයිට්, නමුත් විවේක ටී ලිම්ෆොසයිට් වලට BBB තරණය කළ හැක [37].
පර්යේෂණාත්මක දත්ත යෝජනා කරන්නේ සක්රිය ටී ලිම්ෆොසයිටවල ටී සෛල ප්රතිග්රාහක සහ ඒවායේ සංජානනීය ප්රතිදේහජනක ඉදිරිපත් කරන සෛල අතර අන්තර්ක්රියා mGluR5 අඩු කර mGluR1 ප්රකාශන ඇති කළ හැකි බවයි [164]. සත්ව ආකෘතිවලදී, ලිම්ෆොසයිටික් mGluR1 ප්රතිග්රාහකවලට අතිරික්ත ග්ලූටමේට් බන්ධනය කිරීම IFN- ඇතුළුව Th1 සයිටොකයින් නිෂ්පාදනය ප්රවර්ධනය කරයි. [164].
සමහර MDD රෝගීන් තුළ, පර්යේෂණාත්මක දත්තවලට සමාන්තරව [164], ප්රේරිත ලිම්ෆොසයිටික් mGluR1 ප්රතිග්රාහකවලට අතිරික්ත CNS ග්ලූටමේට් බන්ධනය IFN- ඇතුළුව අතිරික්ත Th1 ප්රතිචාරයකට දායක විය හැකි බව අපි උපකල්පනය කරමු. (රූපය 2). අපි අනුමාන කරන්නේ IFN-? කුඩා ප්රමාණයකින්, මයික්රොග්ලියා [166] මත එහි අභ්යන්තර ආචරණයට සමානව, MHC-II සහ EAAT2 [163,166] හි ක්ෂුද්ර ග්ලියල් ප්රකාශනය ඇති කළ හැකි අතර, මයික්රොග්ලියාවට සංජානනීය ප්රතිදේහජනක ඉදිරිපත් කරන සෛල ලෙස සේවය කිරීමට සහ ග්ලූටමේට් නැවත ලබා ගැනීමේ කාර්යය සැපයීමට ඉඩ සලසයි [163,164,166], එමගින් අතිරික්ත සෛලීය ග්ලූටමේට් [163,166] ඉවත් කිරීමට සහභාගී වන හානිකර මයික්රොග්ලියා ස්නායු ආරක්ෂක ෆීනෝටයිප් [163,164,166] බවට පරිවර්තනය කරයි. එබැවින්, MDD රෝගීන්ගේ උප කාණ්ඩවල අතිරික්ත Th1 ප්රතිචාරය ද්විත්ව දාර සහිත කඩුවක් වන අතර, හානිකර දැවිල්ල ප්රවර්ධනය කරන අතර අතිරික්ත ග්ලූටමේට් ආශ්රිත neuroexcitotoxicity සීමා කළ හැකි ප්රයෝජනවත් ප්රති-නියාමන යාන්ත්රණයක් ලෙස සේවය කරයි (රූපය 2).
භින්නෝන්මාදයේදී, සමහර පර්යන්ත සයිටොකයින් අධ්යයනයන් මගින් ප්රති-ගිනි අවුලුවන Th2 ප්රතිශක්තිකරණ/ප්රතිචාරයේ ප්රමුඛත්වය [52] යෝජනා කරන අතර, තවත් සමහරු මෙය ප්රතික්ෂේප කරති [173,174]. කෙසේ වෙතත්, භින්නෝන්මාදයෙහි ප්රමුඛ සංසිද්ධිය Th2 ප්රතිචාරය යැයි උපකල්පනය කළ කතුවරුන් සමඟ අපි එකඟ වෙමු [52]. KYNA හි ඉහළ මොළය, CSF, සහ සෙරුමය මට්ටම් [21,52] යෝජනා කරන්නේ ක්ෂුද්ර ග්ලියල් IDO සහ KMO අඩු කිරීම, එය KYNA සංශ්ලේෂණය වෙත තාරකා KYN උත්ප්රේරකය මාරු කරන Th2 ප්රතිචාරයේ ශ්රිතයකි (රූපය 1) [21,52]. පශ්චාත් මරණ භින්නෝන්මාද මොළයේ [73] KMO ක්රියාකාරකම් අඩුවීම සහ KMO mRNA ප්රකාශනය අතිරික්ත Th2 ප්රතිචාරයට අනුකූල වේ (රූපය 1). භින්නෝන්මාද රෝගීන්ගේ උප කාණ්ඩවල Th2-මැදිහත් වූ හාස්යජනක ප්රතිශක්තිකරණ අසාමාන්යතා වල ව්යාප්තිය වැඩි වීම B සෛල ගණන [21,76], වැඩි වීම මගින් පෙන්නුම් කෙරේප්රතිවෛරස් ප්රතිදේහ ඇතුළු ස්වයං ප්රතිදේහ නිෂ්පාදනය [76] සහ වැඩි වූ immunoglobulin E [52]-Th2 ප්රතිචාර ආධිපත්ය කල්පිතයට තවදුරටත් සහාය එක් කරයි.
Neuroinflammation සහ CNS Glutamate Dysregulation
ග්ලූටමේට් සංජානනය සහ හැසිරීම මැදිහත් කරයි [186]. සමමුහුර්ත ග්ලූටමේට් මට්ටම් නියාමනය කරනු ලබන්නේ අධි සම්බන්ධිත සෝඩියම් මත යැපෙන ග්ලියල් සහ නියුරෝන ඊඒඒටී විසිනි, එනම් ග්ලූටමේට් නැවත ලබා ගැනීම / ඇස්පාර්ටේට් මුදා හැරීම සඳහා වගකිව යුතු XAG- පද්ධතිය [137,164] සහ සෝඩියම්-ස්වාධීන තාරකා ග්ලූටමේට්/සිස්ටීන් ප්රතිපෝටර් පද්ධතිය (Xc-ප්රතිපෝටර්) ග්ලූටමේට් මුදා හැරීම/සිස්ටීන් නැවත ලබා ගැනීම සඳහා වගකිව යුතුය [164]. Astroglial EAAT1 සහ EAAT2 ග්ලූටමේට් නැවත ලබා ගැනීමෙන් 90%කට වඩා සපයයි [79].
ස්නායු ප්රදාහයට ග්ලූටමේට් පරිවෘත්තීය සහ එහි ප්රවාහකයන්ගේ ක්රියාකාරිත්වය වෙනස් කළ හැකිය [15,29,187,188], සංජානන, චර්යාත්මක සහ මනෝචිකිත්සක දුර්වලතා [15,21,29,79,186,188,189] ඇති කරයි. MDD, BPD, භින්නෝන්මාදය සහ OCD හි EAAT ක්රියාකාරිත්වය/ප්රකාශනය සහ ග්ලූටමේට් පරිවෘත්තීය අසාමාන්යතා වගුව 2 හි සාරාංශ කර ඇත.
MDD හි, cortical hyperglutamatergia සඳහා සාක්ෂි ඇත (වගුව 2). Cortical glutamate මට්ටම් මානසික අවපීඩන රෝග ලක්ෂණ වල බරපතලකම සමඟ ධනාත්මකව සම්බන්ධ වී ඇති අතර, සති පහක විෂාදනාශක පාඨමාලාවක් මගින් සෙරුමය ග්ලූටමේට් සාන්ද්රණය අඩු විය [85,86]. ප්රබල NMDAR ප්රතිවිරෝධකයක් වන කෙටමින් එක් මාත්රාවකට සතියක් [17,21,29,85] වර්තන MDD ආපසු හැරවිය හැක. අධික CNS ග්ලූටමේට් මට්ටම් මගින් ප්රෝඉෆ්ලමේෂන් Th163,164,188 ප්රතිචාරයක් ඇතුළුව ස්නායු විෂ සහිත-මැදිහත් වූ දැවිල්ල [1] ඇති කළ හැක (රූපය 2) [164].
විභව යාන්ත්රණ කිහිපයක් හරහා පෝෂණ-ඉදිරි චක්රයකදී ප්රදාහය/ප්රෝගිනි අවුලුවන සයිටොකයින් වලට CNS ග්ලූටමේට් මට්ටම් [188] වැඩි කළ හැකි බව සීමිත in vitro සාක්ෂි මගින් යෝජනා කරයි: 1) proinflammatory සයිටොකයින් වලට [15,17,168] නිෂේධනය කළ හැකි අතර [45,137] astroglial EAAT-මැදිහත් වූ glutamate නැවත ලබා ගැනීමේ කාර්යය; 2) ප්රෝඉන්ෆ්ලෙමිණි සයිටොකයින් වලට මයික්රොග්ලියල් ක්විනොලිනික් අම්ල සංස්ලේෂණය [53] වැඩිදියුණු කළ හැක, එය පර්යේෂණාත්මකව උපාගම ග්ලූටමේට් මුදා හැරීම ප්රවර්ධනය කරන බව පෙන්වා දී ඇත [15,17,29,190]; 3) වැඩි COX-2/PGE-2 සහ TNF-? මට්ටම් කැල්සියම් ගලා ඒම ඇති කළ හැක [137], එය in vitro දත්ත මත පදනම්ව, astroglial glutamate සහ D-serine නිකුතුව වැඩි කළ හැක [191]; සහ 4) සක්රිය මයික්රොග්ලියා ග්ලූටමේට් මුදා හැරීමට මැදිහත් වන අතිරික්ත Xc-ප්රතිපෝටර් පද්ධති ප්රකාශ කළ හැක [164,192].
භින්නෝන්මාදයේදී, පූර්ව පාදයේ බාහික හයිපොග්ලූටමැටෙර්ජියා [87,90,193,194] (වගුව 2) සහ අඩු වූ NMDAR ක්රියාකාරීත්වය දක්නට ලැබේ [5]. මෑත කාලීන H1 චුම්භක අනුනාද වර්ණාවලීක්ෂය (MRS) මෙටා විශ්ලේෂණය (අධ්යයන 28, භින්නෝන්මාදය, 647 පාලනය) මගින් මධ්යයේ ඉදිරිපස බාහිකයේ ග්ලූටමේට් අඩුවීම සහ ග්ලූටමින් මට්ටම් වැඩි වීම තහවුරු විය [608]. Hypoglutamatergia සඳහා දැවිල්ලෙහි දායක භූමිකාව ඔප්පු කර නොමැත. භින්නෝන්මාද මොළයේ [90] උස් වූ KYNA සංශ්ලේෂණය, සාමාන්යයෙන් Th21,52 ප්රතිචාරයේ ශ්රිතයක් (රූපය 2), NMDAR හි NR1 අනු ඒකකය සහ ඇල්ෆා 1 nicotinicacetylcholine receptor (?7nAchR) [195], NMDAR ක්රියාකාරිත්වය අඩුවීමට සහ ?7nAchR-මැදිහත් වූ ග්ලූටමේට් මුදා හැරීමට හේතු වේ [195].
BPD සහ OCD හි, දත්ත ආබාධ දෙකෙහිම CNS cortical hyper-glutamatergia යෝජනා කරයි (වගුව 2) [78,84,88,131]. CNS ග්ලූටමේට් මට්ටම් වැඩි කිරීම සඳහා දැවිල්ල (BPD සහ OCD) සහ ස්වයංක්රීය ප්රතිදේහ (OCD) [7,77,84,88,130] වල දායකත්වය තවදුරටත් විමර්ශනය කිරීම අවශ්ය වේ.
S100B හි භූමිකාව
S100B යනු astroglia, oligodendroglia සහ choroid plexus ependymal සෛල [10] මගින් නිපදවන 196 kDa කැල්සියම් බන්ධන ප්රෝටීනයකි. එය උසස් ග්ලයිකේෂන් අවසාන නිෂ්පාදනය සඳහා ප්රතිග්රාහකය හරහා අවට නියුරෝන සහ ග්ලියා මත එහි බලපෑම් මැදිහත් කරයි [196]. Nanomolar extracellular S100B මට්ටම් හිතකර නියුරෝට්රොෆික් බලපෑම් සපයයි, ආතතිය ආශ්රිත නියුරෝන තුවාල සීමා කරයි, ක්ෂුද්ර ග්ලියල් TNF- නිෂේධනය කරයිද? මුදා හැරීම, සහ තාරකා ග්ලූටමේට් නැවත ලබා ගැනීම වැඩි කිරීම [196]. Micromolar S100B සාන්ද්රණය, ප්රධාන වශයෙන් සක්රිය astroglia සහ lymphocytes [196,197] මගින් නිපදවන අතර, නියුරෝන apoptosis, COX-2/PGE-2, IL-1 නිෂ්පාදනය ඇතුළු උසස් ග්ලයිකේෂන් අවසාන නිෂ්පාදනය සඳහා ප්රතිග්රාහක මගින් සම්ප්රේෂණය කරන හානිකර බලපෑම් තිබේද? සහ ප්රේරක නයිට්රික් ඔක්සයිඩ් විශේෂ, සහ මොනොසයිටික්/මයික්රොග්ලියල් TNF- නියාමනය කිරීම? ස්රාවය [21,196,198].
සෙරුමය සහ, විශේෂයෙන්, CSF සහ මොළයේ පටක S100B මට්ටම් glial (ප්රධාන වශයෙන් තාරකා විද්යාත්මක) සක්රීය කිරීමේ දර්ශක වේ [199]. MDD සහ Psychosis වලදී, serum S100B මට්ටම් මනෝචිකිත්සක රෝග විනිශ්චය වලින් ස්වාධීනව සියදිවි නසාගැනීමේ බරපතලකම සමඟ ධනාත්මකව සහසම්බන්ධ වේ [200]. S100B හි පශ්චාත් මරණ පරීක්ෂණයෙන් පෙන්නුම් කළේ MDD සහ BPD හි පෘෂ්ඨවංශික පූර්ව ඉදිරිපස බාහිකයේ මට්ටම් අඩු වී ඇති අතර BPD හි ප්රාචීර බාහිකයේ මට්ටම් වැඩි වීම [196].
Meta-analysis (193 මානසික ආබාධ, 132 සෞඛ්ය සම්පන්න පාලනයන්) මගින් මනෝභාවයේ ආබාධවලදී, විශේෂයෙන් උග්ර මානසික අවපීඩන කථාංග සහ උමතුව [100] වලදී ඉහළ මස්තු සහ CSF S201B මට්ටම් තහවුරු කරන ලදී.
භින්නෝන්මාදයේදී, මොළය, CSF සහ serum S100B මට්ටම් ඉහළ යයි [199,202]. මෙටා-විශ්ලේෂණ (අධ්යයන 12, භින්නෝන්මාද 380, සෞඛ්ය සම්පන්න පාලනයන් 358) භින්නෝන්මාදයෙහි සෙරුමය S100B මට්ටම් ඉහළ ගොස් ඇති බව තහවුරු කරන ලදී [203]. භින්නෝන්මාදයට ගොදුරු වූවන්ගේ පශ්චාත් මරණ පරීක්ෂණ මොළයේ, S100B-ප්රතිශක්තිකරණ astroglia භින්නෝන්මාදයට සම්බන්ධ ප්රදේශ වල දක්නට ලැබේ, පෙරටුගාමී සින්ගුලේට් බාහිකය, පෘෂ්ඨවංශික පූර්ව ඉදිරිපස බාහිකය, orbitofrontal බාහිකය සහ hippocampi [154]. උසස් S100B මට්ටම් ව්යාකූල [154] සහ නිෂේධාත්මක මනෝ ව්යාධිය [204], දුර්වල සංජානනය, දුර්වල චිකිත්සක ප්රතිචාරය සහ අසනීප කාලසීමාව [202] සමඟ සහසම්බන්ධ වේ. S100B [32] හි ජානමය බහුරූපතා සහ භින්නෝන්මාද සමූහවල (වගුව 2) [32,33,205] උසස් ග්ලයිකේෂන් අවසාන නිෂ්පාදන ජාන සඳහා ප්රතිග්රාහක මෙම අසාමාන්යතා ද්විතියික/ජෛව සලකුණු වලට වඩා ප්රාථමික/ව්යාධිජනක විය හැකිය. ඇත්ත වශයෙන්ම, විෂාදනාශක [100] සහ ප්රති-මනෝ නාශක [201] සමඟ ප්රතිකාර කිරීමෙන් පසු සෙරුමය S196B මට්ටම් අඩුවීම යෝජනා කරයිමානසික ආබාධවල ව්යාධි භෞතවේදයට S100B හි යම් සායනික අදාළත්වයක්.
ස්නායු ආසාධනය සහ ඔක්සිකාරක ආතතිය වැඩි වීම
ඔක්සිකාරක ආතතිය යනු ඔක්සිකාරක අතිරික්තයක් ලිපිඩ, ප්රෝටීන සහ DNA [206-209] වැනි ජීව විද්යාත්මක සාර්ව අණු වලට හානි කරන හෝ වෙනස් කරන තත්වයකි. මෙම අතිරික්තය ඔක්සිකාරක නිෂ්පාදනය වැඩි වීම, ඔක්සිකාරක තුරන් කිරීම අඩුවීම, දෝෂ සහිත ප්රතිඔක්සිකාරක ආරක්ෂණය හෝ එහි යම් සංයෝගයක් [206-209] නිසා ඇතිවේ. මොළය ඔක්සිකාරක ආතතියට විශේෂයෙන් ගොදුරු වේ: 1) පෙරොක්සිකරණය කළ හැකි බහු අසංතෘප්ත මේද අම්ල ප්රමාණය වැඩි වීම; 2) ලිපිඩ පෙරොක්සයිඩ් සහ ඔක්සිජන් රැඩිකල් (උදාහරණයක් ලෙස, යකඩ, තඹ) ඇති කරන ඛනිජ ලවණවල සාපේක්ෂ ඉහළ අන්තර්ගතය; 3) ඉහළ ඔක්සිජන් භාවිතය; සහ 3) සීමිත ප්රති-ඔක්සිකරණ යාන්ත්රණ [206,207].
MDD [206], BPD [206,207], භින්නෝන්මාදය [207,209], සහ OCD [206,208] වලදී අධික ඔක්සිකාරක ආතතිය ඇති විය හැක. ඔක්සිකාරක කැළඹීම් වල පර්යන්ත සලකුණු වලට ලිපිඩ පෙරොක්සයිඩ් නිෂ්පාදන වැඩි වීම (උදාහරණයක් ලෙස, මැලොන්ඩියල්ඩිහයිඩ් සහ 4-හයිඩ්රොක්සි-2-නොනෙනල්), නයිට්රික් ඔක්සයිඩ් (NO) පරිවෘත්තීය වැඩි වීම, ප්රතිඔක්සිකාරක අඩු වීම (උදාහරණයක් ලෙස, ග්ලූටතයෝන්) සහ වෙනස් වූ ප්රතිඔක්සිකාරක එන්සයිම මට්ටම් [206,207] ඇතුළත් වේ.
MDD හි, වැඩිවන සුපර් ඔක්සයිඩ් රැඩිකල් ඇනායන නිෂ්පාදනය වැඩි ඔක්සිකරණ-මැදිහත් වූ නියුට්රොෆිල් ඇපොප්ටෝසිස් සමඟ සහසම්බන්ධ වේ [206]. ප්රතිඔක්සිකාරක එන්සයිමවල සෙරුමය මට්ටම් (උදාහරණයක් ලෙස, සුපර් ඔක්සයිඩ් ඩිස්මියුටේස්-1) උග්ර මානසික අවපීඩන අවස්ථාවන්හිදී ඉහළ යන අතර තෝරාගත් සෙරොටොනින් නැවත ලබා ගැනීමේ නිෂේධක (එස්එස්ආර්අයි) ප්රතිකාරයෙන් පසු සාමාන්යකරණය වේ [206]. මෙයින් ඇඟවෙන්නේ MDD හි, සෙරුමය ප්රතිඔක්සිකාරක එන්සයිම මට්ටම් තත්ත්ව සලකුණක් වන අතර, එය ඔක්සිකාරක ආතතියේ උග්ර වැඩිවීම්වලට ප්රතිරෝධය දක්වන වන්දි යාන්ත්රණයක් පිළිබිඹු කළ හැකි බවයි. [206]. භින්නෝන්මාදයෙහි ප්රතිවිරුද්ධව, නිදන්ගත භින්නෝන්මාද රෝගීන්ට සහ සෞඛ්ය සම්පන්න පාලනයන්ට සාපේක්ෂව මුල්-ආරම්භක භින්නෝන්මාද රෝගීන් තුළ CSF ද්රාව්ය සුපර් ඔක්සයිඩ් ඩිස්මුටේස්-1 මට්ටම් සැලකිය යුතු ලෙස අඩු වේ. මෙයින් ඇඟවෙන්නේ මොළයේ ප්රතිඔක්සිකාරක එන්සයිම මට්ටම් අඩුවීම උග්ර භින්නෝන්මාදය [210] තුළ ඔක්සිකාරක හානිවලට දායක විය හැකි නමුත්, මෙම සොයා ගැනීම තහවුරු කිරීමට විශාල අධ්යයනයන් අවශ්ය වුවද.
අතිරේක පර්යේෂණාත්මක සහ මානව අධ්යයනයන් කිහිපයක් මනෝචිකිත්සක ආබාධවල [206-262] වැඩිවන ඔක්සිකාරක ආතතියේ ව්යාධි භෞතවේදයට යටින් පවතින යාන්ත්රණ වඩාත් විස්තරාත්මකව විමර්ශනය කරන ලදී. මානසික අවපීඩනයේ සත්ව ආකෘති වලදී, ග්ලූටතයෝන් මොළයේ මට්ටම් අඩු වන අතර ලිපිඩ පෙරොක්සයිඩ් සහ NO මට්ටම් වැඩි වේ [206,262].
පශ්චාත් මරණ පරීක්ෂණ අධ්යයනයෙන් පෙන්නුම් කරන්නේ MDD, BPD [206] සහ භින්නෝන්මාද විෂයයන් [206,207] හි සම්පූර්ණ ග්ලූටතයෝන් මොළයේ මට්ටම අඩු වී ඇති බවයි. MDD රෝගීන්ගෙන් වගා කරන ලද ෆයිබ්රොබ්ලාස්ට් ග්ලූටතයෝන් මට්ටම් වලින් ස්වාධීනව වැඩි ඔක්සිකාරක ආතතියක් පෙන්නුම් කරයි [262], මානසික අවපීඩනයේ ඔක්සිකාරක ආතතියේ ප්රධාන යාන්ත්රණය ලෙස ග්ලූටතයෝන් ක්ෂය වීමේ මූලික භූමිකාවට එරෙහිව තර්ක කරයි.
මයික්රොග්ලියල් සක්රීය කිරීම එහි ප්රෝඉන්ෆ්ලෙමිණි සයිටොකයින් සහ NO [206-209] නිපදවීම හරහා ඔක්සිකාරක ආතතිය වැඩි කළ හැක. ප්රෝගිනි අවුලුවන සයිටොකයින් සහ ඉහළ NO මට්ටම් ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ (ROS) සෑදීම ප්රවර්ධනය කළ හැකි අතර, එමඟින් ලිපිඩ පෙරොක්සයිඩකරණය වේගවත් කරයි, පටල ෆොස්ෆොලිපිඩ් වලට හානි කරයි, පටලයට සම්බන්ධ මොනොඇමයින් ස්නායු සම්ප්රේෂක ප්රතිග්රාහක සහ අන්තරාසර්ග ප්රතිඔක්සිකාරක ක්ෂය කරයි. ROS නිෂ්පාදන වැඩි කිරීම මගින් ක්ෂුද්ර ග්ලියල් සක්රීය කිරීම සහ NF-?B [208] උත්තේජනය කිරීම හරහා ප්රදාහ නිෂ්පාදනය වැඩි කළ හැක, එය ඔක්සිකාරක තුවාල [208] ස්ථීර කරයි, සමහර මනෝචිකිත්සක ආබාධ [206-209] තුළ ව්යාධිජනක ධනාත්මක ප්රතිපෝෂණ පුඩුවක් සඳහා විභවය නිර්මාණය කරයි. ස්නායු ප්රදාහයට මොළයේ ග්ලූටමේට් මට්ටම [85,86] වැඩි කළ හැකි වුවද, ඔක්සිකාරක ආතතියට හේතුවක් ලෙස ග්ලූටමැටර්ජික් අධි ක්රියාකාරීත්වයේ භූමිකාව සනාථ වී නොමැත [207].
මයිටොකොන්ඩ්රියල් අක්රිය වීම MDD, BPD සහ භින්නෝන්මාදය [206] තුළ ඔක්සිකාරක ආතතිය වැඩි කිරීමට දායක විය හැක. මෙම ආබාධ පිළිබඳ පශ්චාත් මරණ පරීක්ෂණ අධ්යයනයන් මගින් ප්රාථමික මයිටකොන්ඩ්රියල් ආබාධ [206] තුළ මනෝචිකිත්සක කැළඹීම්වල ඉහළ ව්යාප්තියට අනුරූප වන මයිටොකොන්ඩ්රිය DNA හි අසාමාන්යතා අනාවරණය වේ. In vitro සත්ව අධ්යයනයන් මගින් පෙන්නුම් කරන්නේ TNF-? වැනි ප්රෝඉන්ෆ්ලෙමිණි සයිටොකයින් මගින් මයිටොකොන්ඩ්රියල් ඝනත්වය අඩු කර මයිටොකොන්ඩ්රිය ඔක්සිකාරක පරිවෘත්තීය [211,212] අඩාල කරන අතර ROS නිෂ්පාදනය [206,213] වැඩි කිරීමට හේතු වන බවයි. මෙම පර්යේෂණාත්මක සොයාගැනීම් මගින් ස්නායු ප්රදාහය, මයිටොකොන්ඩ්රිය ක්රියා විරහිත වීම සහ ඔක්සිකාරක ආතතිය [206,213] අතර යාන්ත්රික සම්බන්ධතා අදහස් විය හැක, මානව මනෝචිකිත්සක ආබාධවල මෙම ඡේදනය වන ව්යාධිජනක මාර්ග පිළිබඳ වැඩිදුර විමර්ශනය කිරීම වටී.
ස්නායු පටක වල ඔක්සිකාරක හානිවලට ඇති අවදානම විශේෂිත ආබාධයට සම්බන්ධ ස්නායු ව්යුහ විද්යාත්මක, ස්නායු රසායනික සහ අණුක මාර්ග මත පදනම්ව විවිධ මනෝචිකිත්සක ආබාධ අතර වෙනස් වේ [207]. ප්රති-සයිකොටික්ස්, එස්එස්ආර්අයි සහ මනෝ ස්ථායීකාරකවල ප්රතිඔක්සිකාරක ගුණ [206,207,262] ඇති බව මූලික සාක්ෂි අනුව ප්රතිකාර බලපෑම් ද තීරණාත්මක විය හැකිය. මනෝචිකිත්සක ආබාධ සඳහා සහායක ප්රතිඔක්සිකාරකවල (උදාහරණයක් ලෙස, විටමින් C සහ E) චිකිත්සක භූමිකාව අධි බලැති සසම්භාවී සායනික පරීක්ෂණ මගින් සනාථ කිරීමට පවතී. N-acetylcysteine MDD, BPD සහ භින්නෝන්මාදය [207] තුළ එහි කාර්යක්ෂමතාවය පෙන්නුම් කරන සසම්භාවී ප්ලේසෙබෝ-පාලිත අත්හදා බැලීම් කිහිපයක් සමඟින්, මේ දක්වා වඩාත්ම යහපත් ප්රතිඵල පෙන්වයි.
රුධිර මොළයේ බාධක අක්රිය වීම
ස්නායු සම්ප්රේෂණය අඩාල කළ හැකි සයිටොකයින් සහ ප්රතිදේහ ඇතුළු පර්යන්ත ගිනි අවුලුවන මැදිහත්කරුවන් ඇතුළුවීම සීමා කිරීමෙන් BBB මොළයේ ප්රතිශක්තිකරණ වරප්රසාද ලත් තත්ත්වය සුරක්ෂිත කරයි [214,215]. BBB බිඳවැටීමේ උපකල්පනය සහ සමහර මනෝචිකිත්සක රෝගීන්ගේ [60,214,216,217] එහි භූමිකාව SLE [97], ආඝාතය [11] ඇතුළු එහි අක්රියතාවයට සම්බන්ධ රෝගවල මනෝචිකිත්සක සහයෝගීතාවයේ වැඩි ව්යාප්තියට අනුකූල වේ.අපස්මාරය [218] සහ ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ (වගුව 1). MDD සහ භින්නෝන්මාදයෙන් පෙළෙන රෝගීන්ගේ ඉහළ CSF:serum albumin අනුපාතය BBB පාරගම්යතාව [214] වැඩි වීමක් යෝජනා කරයි.
එක් අධ්යයනයක (මනෝ වෛද්ය විෂයයන් 63, පාලන 4,100), IgG, IgM, සහ/හෝ IgA හි අභ්යන්තර සංශ්ලේෂණය ඇතුළුව මනෝචිකිත්සක විෂයයන්ගෙන් 41% (14 MDD සහ BPD, 14 භින්නෝන්මාදය) තුළ BBB-හානි පෙන්නුම් කරන CSF අසාමාන්යතා අනාවරණය විය. මෘදු CSF pleocytosis (mm5 සඳහා සෛල 8 සිට 3 දක්වා) සහ IgG oligoclonal bands හතරක් දක්වා [216] පැවතීම. භින්නෝන්මාදයෙහි එක් පශ්චාත්-මරණ අති ව්යුහාත්මක අධ්යයනයකින් හෙළි වූයේ පූර්ව ඉදිරිපස සහ දෘශ්ය බාහිකවල BBB අල්ට්රා ව්යුහාත්මක අසාමාන්යතා, එන්ඩොතලියල් සෛලවල රික්තක පරිහානිය, තාරකා-අවසාන-පාද ක්රියාවලීන් සහ බාසල් ලැමිනා [60] ඝණ වීම සහ අක්රමවත් බව ඇතුළත් වේ. කෙසේ වෙතත්, මෙම අධ්යයනයේ දී, කතුවරුන් ඔවුන්ගේ සොයාගැනීම් සඳහා පශ්චාත් මරණ පරීක්ෂණ වෙනස්කම්වල විභව දායකත්වය පිළිබඳව අදහස් දක්වා නැත. භින්නෝන්මාද මොළයේ BBB එන්ඩොතලියල් සෛල පිටපත් කිරීම විමර්ශනය කරන තවත් අධ්යයනයකින් පාලනයන්හි අනාවරණය නොවූ ප්රතිශක්තිකරණ ක්රියාකාරිත්වයට බලපාන ජාන අතර සැලකිය යුතු වෙනස්කම් හඳුනා ගන්නා ලදී [217].
ඔක්සිකරණ-මැදිහත් වූ අන්තරාසර්ග අක්රියතාව මනෝචිකිත්සක ආබාධවල BBB අක්රියතාවයේ ව්යාධි භෞතවේදයට දායක විය හැක. මානසික අවපීඩනය [219] සහ, භින්නෝන්මාදයෙහි [220] අඩු ප්රමාණයකට සායනික හා පර්යේෂණාත්මක අධ්යයනයන්හි වක්ර සාක්ෂි මගින් පෙන්නුම් කරන්නේ ඔක්සිකරණය වැඩි වීම අන්තරාසර්ග අක්රියතාවට දායක විය හැකි බවයි. අන්තරාසර්ග අක්රියතාව මානසික අවපීඩනය සහ හෘද වාහිනී රෝග [219,221] අතර දන්නා සම්බන්ධය සඳහා හවුල් යාන්ත්රණයක් නියෝජනය කරයි, එය vasodilator NO [221-223] මට්ටම් අඩුවීම හා සම්බන්ධ විය හැකිය. පර්යේෂණාත්මක අධ්යයනවලින් පෙනී යන්නේ අඩු වූ එන්ඩොතලියල් NO මට්ටම් එහි අත්යවශ්ය සම-සාධක ටෙට්රාහයිඩ්රොබියොප්ටෙරින් (BH4) වෙතින් එන්ඩොතලියල් නයිට්රික් ඔක්සයිඩ් සින්තේස් (eNOS) විසන්ධි කිරීම හා එහි උපස්ථරය L- arginine සිට ඔක්සිජන් වෙත මාරු කිරීම සමඟ යාන්ත්රිකව සම්බන්ධ වී ඇති බවයි [224-226]. Uncoupled eNOS ROS (උදාහරණයක් ලෙස, සුපර් ඔක්සයිඩ්) සහ ප්රතික්රියාශීලී නයිට්රජන් විශේෂ (RNS) සංශ්ලේෂණය ප්රවර්ධනය කරයි (උදාහරණයක් ලෙස, පෙරොක්සිනයිට්රයිට්; NO සමඟ සුපර් ඔක්සයිඩ් අන්තර්ක්රියා කිරීමේ නිෂ්පාදනයක්) [227] NO ට වඩා, ඔක්සිකරණ-මැදිහත් වූ අන්තරාසර්ග අක්රියතාව [ 224-226].
සත්ව දත්ත පෙන්නුම් කළේ SSRI වලට ඌන වූ අන්තරාසර්ග NO මට්ටම් [219] ප්රතිසාධනය කළ හැකි බවයි, ප්රතිඔක්සිකාරක යාන්ත්රණයන් ඔවුන්ගේ විෂාදනාශක බලපෑම්වලට දායක විය හැකි බව යෝජනා කරයි. මිනිසුන් තුළ, L-methylfolate SSRIs [228] හි ප්රති-විෂාදනාශක බලපෑම් ප්රබල කළ හැක, එය eNOS ප්රති-සම්බන්ධතා-මැදිහත් වූ ප්රති-ඔක්සිකරණ [4] සඳහා අත්යවශ්ය සහකාරකයක් වන BH229 මට්ටම ඉහළ නැංවීමෙන් මෙන්ම අනුපාතය සඳහාද වේ. මොනොඇමයින් (එනම්, සෙරොටොනින්, නෝර්පිනෙප්රීන්, ඩොපමයින්) සංශ්ලේෂණය සීමා කිරීමේ එන්සයිම [228].
එකට ගත්විට, සනාල රෝග [230,231] සහ The...ආඝාතය සහ හෘද රෝග [219,221] වැනි සනාල ව්යාධි සඳහා ස්වාධීන අවදානම් සාධකයක් ලෙස මානසික අවපීඩනය තහවුරු කරන වසංගත රෝග අධ්යයනයන්, මානසික අවපීඩනයේ නොගැලපෙන eNOS-මැදිහත් වූ එන්ඩොතලියල් ඔක්සිකාරක හානිවල සායනික අදාළත්වයට තවත් සහායක් එක් කරයි. මානව මනෝචිකිත්සක රෝගවල සයිටොකයින් අසාමාන්යතා සඳහා ඕනෑ තරම් සාක්ෂි තිබියදීත්, ප්රෝඉන්ෆලමේටික් සයිටොකයින්වලට eNOS ප්රකාශනය අඩු කිරීමට සහ BBB පාරගම්යතාව [212] වැඩි කිරීමට හැකි බව පෙන්වන පර්යේෂණාත්මක දත්ත තිබියදීත්, අතිරික්ත ප්රදාහ සයිටොකයින් eNOS අක්රියතාවයට සහ/හෝ BBB දුර්වලතාවයට සෘජුවම සම්බන්ධ කරන මානව සාක්ෂි අඩුයි.
මනෝචිකිත්සක රෝගාබාධවල ප්රදාහය නිරූපණය කිරීම සහ ප්රතිකාර කිරීම
සිටුහි ස්නායු ප්රදාහය නිරූපණය කිරීම
සායනිකව, ප්රතිශක්තිකරණ ප්රතිකාර සඳහා බොහෝ දුරට හිතකර ලෙස ප්රතිචාර දැක්වීමට ඉඩ ඇති ස්නායු ප්රදාහය ඇති මනෝචිකිත්සක රෝගීන්ගේ උප කාණ්ඩය හඳුනා ගැනීම සඳහා ස්නායු ප්රදාහ රූපකරණය තීරණාත්මක විය හැකිය. මීට අමතරව, එවැනි රූප මගින් ස්නායු ප්රදාහය ආශ්රිත රෝග ක්රියාකාරකම් සහ මනෝචිකිත්සක රෝගීන්ගේ ප්රතිශක්තිකරණ ප්රතිකාරයට එහි ප්රතිචාරය නිරීක්ෂණය කිරීමට වෛද්යවරුන්ට ඉඩ ලබා දේ. මිනිස් මොළයේ දැවිල්ල නිරූපණය කිරීම සම්ප්රදායිකව රඳා පවතින්නේ BBB හි දේශීයකරණය වූ බිඳවැටීම පෙන්නුම් කරන අතිවිශාල අභ්යන්තර ප්රතිවිරුද්ධ කාරකවල MRI හෝ CT දෘශ්යකරණය මත ය. ගැඩොලිනියම්-වැඩිදියුණු කරන ලද MRI, paraneoplastic හෝ වෙනත් එන්සෙෆලටයිඩ [107,109,113] ආරෝපණය කළ හැකි මනෝචිකිත්සක ආබාධ සහිත රෝගීන්ගේ චිත්තවේගීය සැකසුම් හා සම්බන්ධ ලිම්බික් කලාපවල එවැනි බිඳවැටීමක් ඉඳහිට පෙන්නුම් කරයි. කෙසේ වෙතත්, අපගේ දැනුමට අනුව, ක්රියාකාරී [21,214,232] සහ අති ව්යුහාත්මක BBB අසාමාන්යතා [214,216] තිබියදීත්, කිසිදු සම්භාව්ය මනෝචිකිත්සක ආබාධයක් [60] තුළ අසාමාන්ය වැඩිදියුණු කිරීම් කිසිවිටෙකත් පෙන්නුම් කර නොමැත.
සම්භාව්ය මනෝචිකිත්සක ආබාධවලදී සියුම් ස්නායු ප්රදාහය vivo තුළ දෘශ්යමාන කළ හැකිද නැද්ද යන්න තවමත් නොදනී. සක්රීය මයික්රොග්ලියා [11] මගින් ප්රකාශිත පර්යන්ත බෙන්සෝඩියසපයින් ප්රතිග්රාහකය ලෙසින් කලින් හැඳින්වූ ට්රාන්ස්ලොකේටර් ප්රෝටීනයට බන්ධනය වන C11195-PK233,234 වැනි රේඩියෝ ට්රේසර් භාවිතා කරන පොසිට්රෝන විමෝචන ටොමොග්රැෆි (PET) යනු එක් සාර්ථක ක්රමයක් වේ.
මෙම ක්රමය භාවිතා කරමින්, භින්නෝන්මාදයෙන් පෙළෙන රෝගීන්ට බාහිකය පුරා [235] සහ හිපොකැම්පස්හි උග්ර මනෝවිද්යාව [236] තුළ වැඩි ක්ෂුද්ර ග්ලියල් ක්රියාකාරීත්වයක් ඇති බව පෙන්නුම් කරන ලදී. එක් අධ්යයනයකින් (14 භින්නෝන්මාදය, පාලනයන් 14) භින්නෝන්මාදයෙහි [11C] DAA1106 බන්ධනය එදිරිව පාලනයන් අතර සැලකිය යුතු වෙනසක් සොයා නොගත් නමුත් [11C] DAA1106 බන්ධනය සහ භින්නෝන්මාදයෙහි ධනාත්මක රෝග ලක්ෂණ සහ රෝගී කාලසීමාව අතර සෘජු සහසම්බන්ධයක් [236] සොයාගෙන ඇත.
අපගේ ආයතනයේ විමර්ශකයින් C11-PK11195 PET භාවිතා කළේ GAD විරෝධී ප්රතිදේහ සමඟ සම්බන්ධ වූ මනෝවිද්යාත්මක MDD, අපස්මාරය සහ anterograde amnesia ඇතුළු ස්නායු මනෝචිකිත්සක අක්රියතාවයෙන් පෙළෙන රෝගියෙකුගේ ද්වි-හිපොකැම්පල් දැවිල්ල පෙන්නුම් කිරීමට ය. කෙසේ වෙතත්, PK237 PET සතුව ඇතඅඩු සංඥා-ශබ්ද ගුණාංග සහ ස්ථානීය සයික්ලොට්රෝනයක් අවශ්ය වේ.
ඒ අනුව, PET සහ SPECT සඳහා වැඩිදියුණු කරන ලද ට්රාන්ස්ලෝකේටර් ප්රෝටීන් ලිගන්ඩ් සංවර්ධනය කිරීම සඳහා පර්යේෂණ කැප කෙරේ. අනාගත අධි බලැති පශ්චාත් මරණ පරීක්ෂණ මොළයේ පටක අධ්යයනයන් ස්වයං ප්රතිශක්තිකරණ ව්යාධි භෞතවේදය පිළිබඳ අපගේ අවබෝධය දියුණු කිරීම සඳහා මනෝචිකිත්සක ආබාධවලදී පරිවෘත්තීය හා ගිනි අවුලුවන මාර්ග, CNS සයිටොකයින් සහ ඒවායේ බන්ධන ප්රතිග්රාහක පැහැදිලි කිරීම අරමුණු කරගත් ප්රෝටීන් ප්රමාණකරණය භාවිතා කරයි.
මනෝචිකිත්සක ආබාධ සඳහා ප්රති-ගිනි අවුලුවන ඖෂධවල කාර්යභාරය
මානව සහ සත්ව අධ්යයනයන් කිහිපයක් යෝජනා කරන්නේ ඇතැම් ප්රති-ගිනි අවුලුවන ඖෂධ මානසික ආබාධවලට ප්රතිකාර කිරීමේදී වැදගත් අතිරේක කාර්යභාරයක් ඉටු කළ හැකි බවයි (වගුව 3). සාමාන්ය ඖෂධ වන්නේ සයික්ලොඔක්සිජන් නිෂේධක (වගුව 3) [238-245], මිනොසයික්ලයින් (වගුව 3) [240-245], ඔමේගා-3 මේද අම්ල [246,247], සහ නියුරෝස්ටෙරොයිඩ් [248].
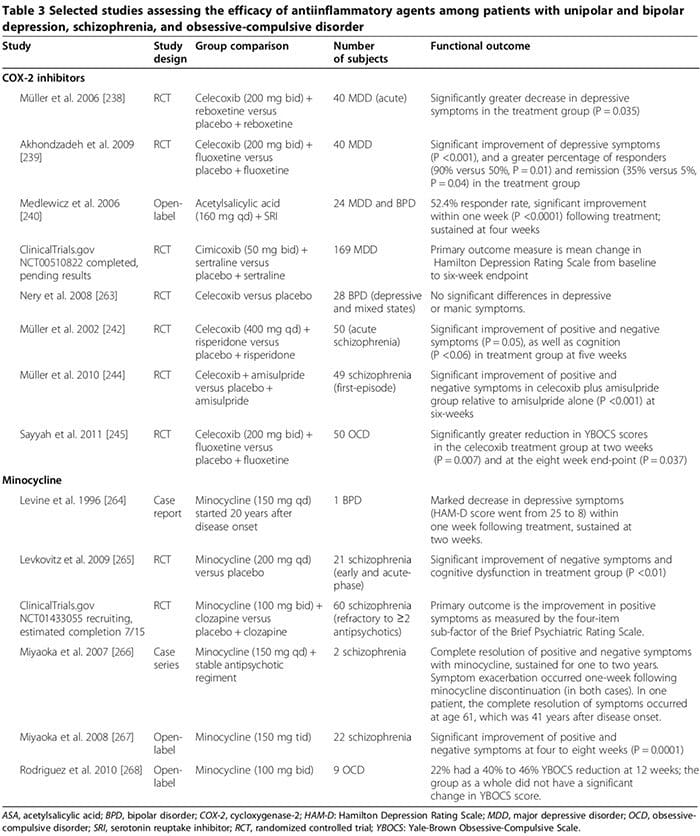 COX-2 නිෂේධක මගින් MDD, BPD, භින්නෝන්මාදය සහ OCD (වගුව 3) [248] හි මනෝචිකිත්සක රෝග ලක්ෂණ සමනය කළ හැකි බව මානව අධ්යයනයන් කිහිපයක් පෙන්වා දුන්නේය. ඊට වෙනස්ව, තෝරා නොගත් COX-inhibitors (එනම්, ස්ටෙරොයිඩ් නොවන ප්රති-ගිනි අවුලුවන ඖෂධ (NSAIDs)) සමඟ අතිරේක ප්රතිකාර SSRI වල [249,250] කාර්යක්ෂමතාව අඩු කළ හැකිය; NSAIDs (නමුත් තෝරාගත් COX-2 inhibitors හෝ salicylates) වලට නිරාවරණය වීම අධ්යයනයට සහභාගී වූවන්ගේ [249,250] උප කුලකයක් අතර මානසික අවපීඩනය සැලකිය යුතු ලෙස නරක අතට හැරීම සමඟ සම්බන්ධ වී ඇති බව විශාල පරීක්ෂණ දෙකක් වාර්තා කළේය.
COX-2 නිෂේධක මගින් MDD, BPD, භින්නෝන්මාදය සහ OCD (වගුව 3) [248] හි මනෝචිකිත්සක රෝග ලක්ෂණ සමනය කළ හැකි බව මානව අධ්යයනයන් කිහිපයක් පෙන්වා දුන්නේය. ඊට වෙනස්ව, තෝරා නොගත් COX-inhibitors (එනම්, ස්ටෙරොයිඩ් නොවන ප්රති-ගිනි අවුලුවන ඖෂධ (NSAIDs)) සමඟ අතිරේක ප්රතිකාර SSRI වල [249,250] කාර්යක්ෂමතාව අඩු කළ හැකිය; NSAIDs (නමුත් තෝරාගත් COX-2 inhibitors හෝ salicylates) වලට නිරාවරණය වීම අධ්යයනයට සහභාගී වූවන්ගේ [249,250] උප කුලකයක් අතර මානසික අවපීඩනය සැලකිය යුතු ලෙස නරක අතට හැරීම සමඟ සම්බන්ධ වී ඇති බව විශාල පරීක්ෂණ දෙකක් වාර්තා කළේය.
සති 1,258 ක් සඳහා citalopram සමඟ ප්රතිකාර කරන ලද මානසික අවපීඩනයෙන් පෙළෙන රෝගීන් 12 ක් සම්බන්ධ වූ පළමු අත්හදා බැලීමේදී, NSAIDs නොගත් අයට සාපේක්ෂව අවම වශයෙන් එක් වරක්වත් NSAIDs ලබා ගත් අය අතර සමනය වීමේ අනුපාතය සැලකිය යුතු ලෙස අඩු විය (45% සහ 55%, OR 0.64, P = 0.0002) [249]. MDD විෂයයන් 1,545 ක් සම්බන්ධ අනෙකුත් අත්හදා බැලීම්, NSAIDs (හෝ 1.55, 95% CI 1.21 සිට 2.00 දක්වා) ගන්නා අය අතර ප්රතිකාර-ප්රතිරෝධී මානසික අවපීඩනය සැලකිය යුතු ලෙස වැඩි බව පෙන්නුම් කළේය. NSAID කණ්ඩායම්වල මානසික අවපීඩනය නරක අතට හැරීම NSAID චිකිත්සාව සමඟ යාන්ත්රිකව සම්බන්ධ නොවිය හැකි නමුත් ඒ වෙනුවට දිගුකාලීන NSAIDs අවශ්ය වන සහ ස්වාධීනව සම්බන්ධ වී ඇති බව දන්නා නිදන්ගත වෛද්ය තත්වයන් [231-10,12] සමඟ සම්බන්ධ වේ. ප්රතිකාර-ප්රතිරෝධී මානසික අවපීඩනයේ අවදානම වැඩි වීම [18]. මානසික අවපීඩනයට NSAIDs වල බලපෑම සහ මිනිසුන් තුළ විෂාදනාශක වලට ප්රතිචාර දැක්වීම පිළිබඳව අනාගත අධ්යයනයන් අවශ්ය වේ.
මීයන් තුළ මානසික අවපීඩනය වැනි තත්වයක් ඇති කිරීම සඳහා උග්ර ආතති ආදර්ශයන් භාවිතා කරන වෙනත් පර්යේෂණාත්මක අධ්යයනයන්හිදී, citalopram ඉදිරිපස බාහිකයේ TNF-?, IFN-?, සහ p11 (සතුන්ගේ මානසික අවපීඩන හැසිරීමට සම්බන්ධ අණුක සාධකය) වැඩි කරන අතර NSAID ibuprofen. මෙම අණු අඩු විය; NSAIDs ද SSRI වල විෂාදනාශක බලපෑම් අඩු කළ නමුත් වෙනත් විෂාදනාශක නොවේ [249]. මෙම සොයාගැනීම්වලින් පෙනී යන්නේ ප්රෝගිනි අවුලුවන සයිටොකයින් මගින් අතිවිශාල සාක්ෂි තිබියදීත් විෂාදනාශක බලපෑම් පරස්පර විරෝධී ලෙස සිදු කළ හැකි බවයි.NSAIDs [249] මගින් දුර්වල කළ හැකි මානව අධ්යයනයන් ප්රතිවිරුද්ධව (ඉහත සමාලෝචනය කර ඇති පරිදි). මෙම පැහැදිලි විරුද්ධාභාසය සඳහා අවම වශයෙන් සලකා බැලීම් දෙකක් හේතු විය හැක: 1) සමහර පර්යේෂණාත්මක තත්වයන් යටතේ, ප්රෝගිනි අවුලුවන සයිටොකයින් ස්නායු ආරක්ෂණ භූමිකාවක් සමඟ සම්බන්ධ වී ඇත, [251; (සඳහාඋදාහරණයක් ලෙස, IFN-? අඩු මට්ටම්වලදී ස්නායු ආරක්ෂක මයික්රොග්ලියාව ඇති කළ හැක (රූපය 2) [163,166,251]); සහ 2) සත්ව ආකෘතියක උග්ර ආතති සුසමාදර්ශයේ සන්දර්භය තුළ නිරීක්ෂණය කරන ලද මෙම ප්රතිචාර මිනිසුන් තුළ ආවේණික MDD සඳහා අදාළ වන්නේද යන්න අපැහැදිලිව පවතී [251].
මනෝචිකිත්සක ආබාධ වලදී COX-2 නිෂේධකවල චිකිත්සක බලපෑම් වලට ප්රෝඉන්ෆ්ලෙමේෂන් PGE2 සහ ප්රති-ගිනි අවුලුවන 2-deoxy-?15-PGJ12,14 (2d- PGJ15) [2] ඇතුළුව COX-252,253-ව්යුත්පන්න ප්රොස්ටැග්ලැන්ඩින් වල ජෛව සංස්ලේෂණය මොඩියුලේෂන් ඇතුළත් විය හැකිය. COX-2 inhibitors මගින් PGE2-මැදිහත් වූ දැවිල්ල අඩු කළ හැකි අතර, එය මානසික ආබාධවල ව්යාධි භෞතවේදයට දායක විය හැක [252,253]. ඔවුන් 15d-PGJ2 මට්ටම් ද, එහි න්යෂ්ටික ප්රතිග්රාහක පෙරොක්සිසෝම් ප්රෝලිෆරේටර්-සක්රීය න්යෂ්ටික ප්රතිග්රාහක ගැමා (PPAR-?) [252,253] ක්රියාකාරිත්වය ද වෙනස් කළ හැකිය.
අධ්යයන කිහිපයක් යෝජනා කරන්නේ 15d-PGJ2 සහ එහි න්යෂ්ටික ප්රතිග්රාහක PPAR-? භින්නෝන්මාදය සඳහා ජීව විද්යාත්මක සලකුණු ලෙස සේවය කළ හැක [253]. භින්නෝන්මාද රෝගීන් තුළ, සෙරුමය PGE2 මට්ටම් වැඩි වන අතර, එහි න්යෂ්ටික ප්රතිග්රාහක PPAR- හි ප්රකාශනය මෙන් 15d- PGJ2 සෙරුමය මට්ටම් අඩු වේ. PBMC [252] හි. COX-2 inhibitors මගින් COX-2 මත යැපෙන −15d-PGJ2/PPAR- හි ප්රයෝජනවත් විය හැකි ප්රති-ගිනි අවුලුවන බලපෑම් සීමා කළ හැකිද? මාර්ගය, භින්නෝන්මාද රෝගීන්ගේ හෘදයාබාධ හා ඇතැම් ආසාදන (උදාහරණයක් ලෙස, සයිටොමෙගෙලෝ වයිරස් සහ ටොක්සොප්ලාස්මා ගොන්ඩි) සඳහා වැඩි අවදානමක් ඇතුළුව, එහි හානිකර බලපෑම් වාසිදායක ලෙස අඩු කළ හැකිය [1] සහ 254) එහි ඇපොප්ටෝටික-ගැති බලපෑම් නිරීක්ෂණය විය. මානව සහ සත්ව පිළිකා පටක [2]. COX-255 inhibitors චිකිත්සක බලපෑම් වල අනෙකුත් විභව යාන්ත්රණවලට ප්රෝගිනි අවුලුවන සයිටොකයින් මට්ටම් [2] අඩු කිරීමේ හැකියාව, ක්විනොලිනික් අම්ලය එක්සිටොටොක්සිසිටි (MDD හි මෙන්) සීමා කිරීම සහ KYNA මට්ටම් අඩු කිරීම (භින්නෝන්මාදයෙහි මෙන්) [163] ඇතුළත් විය හැකිය.
Minocycline මානසික ආබාධ සඳහා ඵලදායී විය හැක (වගුව 3) [248]. මයිනොසයික්ලයින් MAP, සයිටොකයින් ස්රාවය, COX-2/PGE-2 ප්රකාශනය, සහ ප්රේරණය කළ හැකි නයිට්රික් ඔක්සයිඩ් සින්තේස් [256] වළක්වන බව in vitro දත්ත යෝජනා කරයි. මිනොසයික්ලයින් අක්රමික ග්ලූටමැටර්ජික් සහ ඩොපමිනර්ජික් ස්නායු සම්ප්රේෂණයට ප්රතිරෝධය දැක්විය හැක [256].
මනෝචිකිත්සක ආබාධවල ඔමේගා-3 මේද අම්ල කාර්යක්ෂමතාව අපැහැදිලියි [248]. 2011 සසම්භාවී-පාලිත පරීක්ෂණ 15 ක මෙටා විශ්ලේෂණයක (916 MDD), eicosapentaenoic අම්ලය ?3% අඩංගු ඔමේගා-60 අතිරේක (ඩොකෝසහෙක්සෙනොයික් අම්ල මාත්රාවට වඩා මාත්රාව පරාසය 200 සිට 2,200 mg/d දක්වා වැඩි වූ විට සැලකිය යුතු ලෙස අඩු වූ අවපීඩන රෝග ලක්ෂණ) SRIs සඳහා අතිරේක චිකිත්සාව (P <0.001) [246]. කෙසේ වෙතත්, පසුව කරන ලද මෙටා-විශ්ලේෂණයකින්, මානසික අවපීඩනය තුළ ඔමේගා-3 මේද අම්ලවල සැලකිය යුතු ප්රතිලාභයක් නොමැති බවත්, ප්රකාශිත කාර්යක්ෂමතාවය හුදෙක් ප්රකාශන පක්ෂග්රාහී ප්රතිඵලයක් බවත් නිගමනය කරන ලදී [247]. BPD සහභාගිවන්නන් 2012 ක් ඇතුළුව සසම්භාවී-පාලිත පරීක්ෂණ 5 ක 291 මෙටා විශ්ලේෂණයකින් සොයා ගන්නා ලද්දේ ප්ලේසෙබෝ (Hedges g 3, P = 0.34) වලට සාපේක්ෂව ඔමේගා-0.025 මේද අම්ල වලට අහඹු ලෙස වෙනස් වූ අය අතර මානසික අවපීඩන නමුත් උමතු නොවන රෝග ලක්ෂණ සැලකිය යුතු ලෙස වැඩිදියුණු වී ඇති බවයි. [257]. මාස 12 ක් දක්වා භින්නෝන්මාද විෂයයන් පිළිබඳ සසම්භාවී පාලිත පරීක්ෂණයකදී, දිගු දාම ඔමේගා-66 (සති 3 ක් සඳහා 1.2 g/දිනකට; P = 12 සහ 0.02) වෙත සසම්භාවී 0.01 සහභාගිවන්නන් අතර ධනාත්මක සහ සෘණ රෝග ලක්ෂණ ලකුණු සැලකිය යුතු ලෙස අඩු විය. පිළිවෙලින්) [258]; මෙමකතුවරුන් නිගමනය කළේ භින්නෝන්මාදයේ මුල් අවධියේදී ඔමේගා-3 වැඩි කිරීම මගින් නැවත ඇතිවීම සහ රෝග වර්ධනය වීම වැළැක්විය හැකි බවයි [258].
භින්නෝන්මාදයෙන් පෙළෙන රෝගීන් 2012 දෙනෙකුගේ ඔමේගා-3 වර්ධනය තක්සේරු කරමින් සසම්භාවී-පාලිත පරීක්ෂණ හතක 168 මෙටා විශ්ලේෂණයක් ප්රතිකාරයේ ප්රතිලාභයක් සොයා ගත්තේ නැත [259]. මෙම මෙටා විශ්ලේෂණයේ කතුවරුන් විශේෂයෙන් ප්රකාශ කළේ නැවත ඇතිවීම වැළැක්වීම හෝ රෝගයේ ප්රගතිය අවසාන ලක්ෂ්ය සම්බන්ධයෙන් කිසිදු නිගමනයකට එළඹිය නොහැකි බවයි. පර්යේෂණාත්මක දත්ත යෝජනා කරන්නේ eicosapentaenoic අම්ලය සහ docosahexaenoic අම්ලය resolvins සහ protectionins සංශ්ලේෂණය ප්රවර්ධනය කිරීම මගින් ඔවුන්ගේ ප්රති-ගිනි අවුලුවන බලපෑම් වලට මැදිහත් වන බවයි.
ප්රෙග්නෙනොලෝන් සහ එහි පහළ පරිවෘත්තීය ඇලෝප්රෙග්නනොලෝන් ඇතුළු නියුරෝස්ටෙරොයිඩ් සමහර මනෝචිකිත්සක ආබාධ සඳහා ප්රයෝජනවත් කාර්යභාරයක් ඉටු කරයි [248,260]. MDD හි, අධ්යයනයන් කිහිපයකින් ප්ලාස්මා / CSF ඇලෝප්රෙග්නනොලෝන් මට්ටම් අඩුවී ඇති බව සොයා ගන්නා ලදී රෝග ලක්ෂණ බරපතලකම සමඟ සහසම්බන්ධ වන අතර, එය ඇතැම් විෂාදනාශක (උදාහරණයක් ලෙස, SSRIs) සහ විද්යුත් කම්පන ප්රතිකාර සමඟ සාර්ථක ප්රතිකාර කිරීමෙන් පසු සාමාන්යකරණය විය [261]. භින්නෝන්මාදයේදී, මොළයේ ප්රෙග්නෙනොලෝන් මට්ටම් වෙනස් කළ හැක [248] සහ සමහර ප්රති-සයිකෝටික ඖෂධ (උදාහරණයක් ලෙස, ක්ලෝසපයින් සහ ඔලන්සැපයින්) [260] පසු සෙරුම් ඇලෝප්රෙග්නනොලෝන් මට්ටම් වැඩි විය හැක. සසම්භාවී පාලිත අත්හදා බැලීම් තුනකදී (භින්නෝන්මාදය 100 (සංචිතගත); ප්රතිකාර කාලය, ආසන්න වශයෙන් සති නවයක්) ධනාත්මක, සෘණ සහ සංජානන රෝග ලක්ෂණ මෙන්ම ප්රතිප්රමිතිකරණ අතුරු ආබාධ අහඹු ලෙස සිදු කරන ලද අත්හදා බැලීම් එකක් හෝ කිහිපයක් තුළ සැලකිය යුතු ලෙස වැඩිදියුණු විය. ප්ලේසෙබෝ ලබා ගන්නා අයට සාපේක්ෂව pregnenolone [248]. එක් අත්හදා බැලීමක දී, දිගු කාලීන ප්රෙග්නෙනොලෝන් ප්රතිකාරය [248] සමඟ වැඩිදියුණු විය. Pregnenolone හට NMDA සහ GABAA ප්රතිග්රාහක [248] වල ක්රියාකාරිත්වය ප්රබල කිරීම මගින් සංජානනය සහ හැසිරීම නියාමනය කළ හැක. තවද, ඇලෝප්රෙග්නනොලෝන් ස්නායු ආරක්ෂණ සහ ප්රති-ගිනි අවුලුවන බලපෑම් ඇති කළ හැකිය [248]. මිනිසුන් තුළ මුල්-ආරම්භක මනෝචිකිත්සක ආබාධ සඳහා ස්නායු ක්රියාකාරී ස්ටෙරොයිඩ් වල ප්රයෝජනවත් භූමිකාව තහවුරු කිරීම සඳහා තවත් RCT අධ්යයනයන් අවශ්ය වේ.
NF-?B (NCT01182727) නිෂේධකයක් වන salicylate ඇතුළු අනෙකුත් ප්රති-ගිනි අවුලුවන කාරකවල චිකිත්සක බලපෑම් විමර්ශනය කරමින් පවතින සායනික පරීක්ෂණ කිහිපයක ප්රතිඵල අපි බලා සිටිමු; ඇසිටිල්සාලිසිලික් අම්ලය (NCT01320982); pravastatin (NCT1082588); සහ dextromethorphan, තරඟකාරී නොවන NMDAR ප්රතිවිරෝධකයක් වන අතර එය දැවිල්ල ඇති කරන ඩොපමිනර්ජික් නියුරෝන තුවාල (NCT01189006) සීමා කළ හැකිය.
අනාගත ප්රතිකාර උපාය මාර්ග
වර්තමාන ප්රතිශක්තිකරණ ප්රතිකාර (උදාහරණයක් ලෙස, IVIG, plasmapheresis, corticosteroids සහ immunosuppressive කාරක) බොහෝ විට ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලයිටයිඩවලට ප්රතිකාර කිරීම සඳහා ඵලදායී වන නමුත්, දැවිල්ල උග්ර, තීව්ර සහ ප්රධාන වශයෙන් අනුවර්තන සම්භවයක් ඇති අතර, නිදන්ගත මනෝචිකිත්සක ආබාධවලදී ඒවායේ කාර්යක්ෂමතාවය,බොහෝ මෘදු, සහ ප්රධාන වශයෙන් සහජ සම්භවයක් ඇති, සීමිතයි [2]. නව ප්රතිකාර ක්රම දියුණු කිරීම, වත්මන් ප්රතිශක්ති නාශක කාරකයන් සමඟ ඇතිවන දැවිල්ල විචක්ෂණ ලෙස යටපත් කරනවාට වඩා අන්තරාසර්ග ස්නායු ප්රොටෙක්ටිව් ටී රෙග්ස් සහ ප්රයෝජනවත් MAP ප්රශස්ත කරන අතරම, ග්ලියල් පාඩුව [46,138] ආපසු හැරවීම, හානිකර MAP නියාමනය කිරීම අරමුණු කළ යුතුය. මීට අමතරව, මනෝචිකිත්සක ආබාධවලදී ඔක්සිකාරක තුවාල ආපසු හැරවිය හැකි ප්රබල සම-සහායක ප්රතිඔක්සිකාරක සංවර්ධනය කිරීම අවශ්ය වේ.
නිගමන
ස්වයං ප්රතිශක්තිකරණය මගින් ස්නායු මනෝචිකිත්සක ආබාධ රාශියක් ඇති කළ හැකි අතර එය මුලින් හුදකලා මනෝචිකිත්සක රෝග ලක්ෂණ සමඟ ඇති විය හැක. සහජ දැවිල්ල/ස්වයං ප්රතිශක්තිය සම්භාව්ය මනෝචිකිත්සක ආබාධ සහිත රෝගීන්ගේ උප කුලකයක මනෝචිකිත්සක රෝග ලක්ෂණ වල ව්යාධිජනකයට අදාළ විය හැකිය. සහජ දැවිල්ල සාම්ප්රදායික මොනොඇමිනර්ජික් සහ ග්ලූටමැටර්ජික් අසාමාන්යතා සහ මනෝචිකිත්සක රෝග වලදී වාර්තා වන වැඩි ඔක්සිකාරක තුවාල වලට යාන්ත්රිකව සම්බන්ධ විය හැක.
Souhel Najjar1,5*, Daniel M Pearlman2,5, Kenneth Alper4, Amanda Najjar3 සහ Orrin Devinsky1,4,5
කෙටි යෙදුම්
3-OH-KYN: 3-hydroxy-kynurenine; ?7nAchR: Alpha 7 nicotinic acetylcholine receptors; AMPAR: Amino-3-hydroxy-5-methyl-l-4-isoxazolepropionic අම්ල ප්රතිග්රාහක; APC: ප්රතිදේහජනක ඉදිරිපත් කරන සෛලය; BBB: රුධිර මොළයේ බාධකය;
BH4: Tetrahydrobiopterin; BPD: බයිපෝල ආබාධ; CI: විශ්වාස අන්තරය;
CNS: මධ්යම ස්නායු පද්ධතිය; COX-2: Cyclooxegenase-2; CSF: මස්තිෂ්ක තරලය; DSM-IV: මානසික ආබාධ පිළිබඳ රෝග විනිශ්චය සහ සංඛ්යානමය අත්පොත 4 වන සංස්කරණය; EAATs: උද්දීපනය කරන ඇමයිනෝ අම්ල ප්රවාහක; eNOS: එන්ඩොතලියල් නයිට්රික් ඔක්සයිඩ් සින්තේස්; GABAB: ගැමා ඇමයිනොබියුට්රික් අම්ලය-බීටා; GAD: ග්ලූටමික් අම්ලය decarboxylase; GFAP: Glial fibrillary acidic protein; GLX: 1H MRS හඳුනාගත හැකි ග්ලූටමේට්, ග්ලූටමින්, ගැමා ඇමයිනොබියුට්රික් අම්ලය සංයුක්ත;
IDO: Indoleamine 2,3-ඩයොක්සිජන්ස්; Ig: Immunoglobulin; IL: ඉන්ටර්ලියුකින්; IL-1RA: ඉන්ටර්ලියුකින් 1 ප්රතිග්රාහක ප්රතිවිරෝධකය; IFN-?: ඉන්ටර්ෆෙරෝන් ගැමා;
KAT: Kynurenine aminotransferase; KMO: Kynurenine 3-monooxygenase; KYN: Kynurenine; KYNA: Kynurenic අම්ලය; LE: ලිම්බික් එන්සෙෆලයිටිස්;
LPS: Lipopolysaccharide; සිතියම: ක්ෂුද්ර සක්රීය කිරීම සහ ප්රගුණනය;
MDD: ප්රධාන මානසික අවපීඩනය; mGluR: Metabotropic glutamate receptor; MHC: II ප්රධාන histocompatibility complex class දෙක; MRI: චුම්බක අනුනාද රූප; MRS: චුම්බක අනුනාද වර්ණාවලීක්ෂය; NF-?B: න්යෂ්ටික සාධකය kappa B; NMDAR: N-methyl-D-aspartate receptor; NR1: ග්ලයිසීන් අඩවිය;
OCD: උමතු-සම්පීඩන ආබාධ; OR: ඔත්තේ අනුපාතය; PANDAS: streptococcal ආසාදන හා සම්බන්ධ ළමා ස්නායු මනෝචිකිත්සක ස්වයං ප්රතිශක්තිකරණ ආබාධ; PBMC: පර්යන්ත රුධිර ඒක න්යෂ්ටික සෛල; PET: Positron විමෝචන ටොමොග්රැෆි; PFC: Prefrontal cortex; PGE-2: Prostaglandin E2; PPAR-
?: Peroxisome proliferator-සක්රීය න්යෂ්ටික ප්රතිග්රාහක ගැමා; QA: ක්විනොලිනික් අම්ලය; RNS: ප්රතික්රියාශීලී නයිට්රජන් විශේෂ; ROS: ප්රතික්රියාශීලී ඔක්සිජන් විශේෂ;
sIL: ද්රාව්ය ඉන්ටර්ලියුකින්; SLE: පද්ධතිමය lupus erythematosus; SRI: Serotonin reuptake inhibitor; TNF-?: Tumor necrosis factor alpha; T-regs: CD4+CD25 +FOXP3+ T නියාමන සෛල; TDO: ට්රිප්ටෝෆාන්-2,3-ඩයොක්සිජන්ස්; Th: T-helper; VGKC: වෝල්ටීයතාව සහිත පොටෑසියම් නාලිකාව; XAG-: Glutamate aspartate ප්රවාහකය; Xc-: සෝඩියම්-ස්වාධීන තාරකා ග්ලූටමේට්/සිස්ටීන්
ප්රතිපෝටර් පද්ධතිය
තරඟකාරී උනන්දුව
කතුවරු පවසන්නේ ඔවුන් තරඟකාරී අවශ්යතාවන් නොමැති බවයි.
කතුවරුන්ගේ දායකත්වය
SN සහ DMP විසින් පුළුල් සාහිත්ය සමාලෝචනයක්, දත්ත අර්ථකථනය කර, අත්පිටපත, සංඛ්යා සහ වගු සකස් කරන ලදී. KA ඔක්සිකාරක යාන්ත්රණවලට අදාළ කොටස සකස් කර අත්පිටපත් සංශෝධන සඳහා දායක විය. AN සහ OD විවේචනාත්මකව-සංශෝධනය කර අත්පිටපතේ සැලසුම සහ ගුණාත්මකභාවය වැඩිදියුණු කරන ලදී. සියලුම කතුවරුන් අවසාන අත්පිටපත කියවා අනුමත කර ඇත.
අනුමත කර
අපි කෘතඥපූර්වකව පිළිගන්නවා Dr. Josep Dalmau, MD, PhD, Tracy Butler, MD, සහ David Zazag, MD, PhD, පිළිවෙලින් ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලටයිඩ, ස්නායු ප්රදාහ රූපකරණය සහ ස්නායු ව්යාධි විද්යාව පිළිබඳ ඔවුන්ගේ විශේෂ ise දැනුම ලබා දීම සඳහා.
කර්තෘ - විස්තර
1 ස්නායු රෝග දෙපාර්තමේන්තුව, New York University School of Medicine, 550 First Avenue, New York, NY 10016, USA. 2Geisel School of Medicine at Dartmouth, The Dartmouth Institute for Health Policy and Clinical practice, 30 Lafayette Street, HB 7252, Lebanon, NH 03766, USA. 3 ව්යාධි විද්යා දෙපාර්තමේන්තුව, ස්නායු ව්යාධි අංශය, නිව් යෝර්ක් විශ්ව විද්යාලයේ වෛද්ය විද්යාලය, 550 පළමු මාවත, නිව් යෝර්ක්, NY 10016, USA. 4මනෝ වෛද්ය දෙපාර්තමේන්තුව, නිව් යෝර්ක් විශ්ව විද්යාලයේ වෛද්ය විද්යාලය, නිව් යෝර්ක්, NY, USA. 5New York University Comprehensive Epilepsy Center, 550 First Avenue, New York, NY 10016, USA.
හිස්
යොමුව:
1. Kayser MS, Dalmau J: ස්වයංක්රීය ප්රතිශක්තිකරණ ආබාධ අතර මතුවෙමින් පවතින සම්බන්ධකය
සහ ස්නායු මනෝචිකිත්සක රෝග. J Neuropsychiatry Clin Neurosci 2011, 23:90-97.
2. Najjar S, Pearlman D, Zagzag D, Golfinos J, Devinsky O: ග්ලූටමික් අම්ලය
decarboxylase autoantibody syndrome භින්නෝන්මාදය ලෙස ඉදිරිපත් කරයි.
ස්නායු විශේෂඥ 2012, 18:88-91.
3. Graus F, Saiz A, Dalmau J: ප්රතිදේහ සහ නියුරෝන ස්වයං ප්රතිශක්තිකරණ
CNS හි ආබාධ. ජේ නියුරෝල් 2010, 257:509-517.
4. ලෙනොක්ස් බීආර්, කෝල්ස් ඒජේ, වින්සන්ට් ඒ: ප්රතිදේහ-මැදිහත් එන්සෙෆලයිටිස්: a
භින්නෝන්මාදයට ප්රතිකාර කළ හැකි හේතුව. Br J මනෝචිකිත්සාව 2012, 200:92-94.
5. Zandi MS, Irani SR, Lang B, Waters P, Jones PB, McKenna P, Coles AJ, Vincent
A, Lennox BR: පළමු කථාංගයේ රෝගයට අදාළ ස්වයං ප්රතිදේහ
භින්නෝන්මාදය. ජේ නියුරෝල් 2011, 258:686-688.
6. Bataller L, Kleopa KA, Wu GF, Rossi JE, Rosenfeld MR, Dalmau J:
රෝගීන් 39 දෙනෙකු තුළ ස්වයං ප්රතිශක්තිකරණ ලිම්බික් එන්සෙෆලයිටිස්: ප්රතිශක්තිකරණ සහ
ප්රතිඵල. J Neurol Neurosurg Psychiatry 2007, 78:381-385.
7. Dale RC, Heyman I, Giovannoni G, Church AW: මොළයට එරෙහි සිදුවීම්
උමතු-සම්පීඩන ආබාධ සහිත දරුවන්ගේ ප්රතිදේහ. Br J මනෝචිකිත්සාව
2005, 187:314-319.
8. Kendler KS: මනෝචිකිත්සක රෝග සඳහා හේතු වල ඩැපල් ස්වභාවය: ප්රතිස්ථාපනය
කාබනික-ක්රියාකාරී/දෘඪාංග-මෘදුකාංග ද්විභාෂාව ආනුභවිකව
පදනම් බහුත්වවාදය. Mol මනෝචිකිත්සාව 2012, 17:377-388.
9. Keskin G, Sunter G, Midi I, Tuncer N: Neurosyphilis සංජානනයට හේතුවක් ලෙස
අඩු වීම සහ කුඩා අවධියේදී මානසික රෝග ලක්ෂණ. J ස්නායු මනෝචිකිත්සා සායන
Neurosci 2011, 23:E41-E42.
10. Leboyer M, Soreca I, Scott J, Frye M, Henry C, Tamouza R, Kupfer DJ: Can
බයිපෝල අක්රමිකතාව බහු පද්ධති ගිනි අවුලුවන රෝගයක් ලෙස සැලකිය හැකිද?
J Affect Disord 2012, 141:1-10.
11. Hackett ML, Yapa C, Parag V, Anderson CS: පසු මානසික අවපීඩනයේ වාර ගණන
ආඝාතය: නිරීක්ෂණ අධ්යයන ක්රමානුකූල සමාලෝචනයක්. ආඝාතය 2005, 36:1330-1340.
12. Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW: වෙතින්
දැවිල්ල අසනීප සහ මානසික අවපීඩනය: ප්රතිශක්තිකරණ පද්ධතිය විට
මොළය යටපත් කරයි. Nat Rev Neurosci 2008, 9:46-56.
13. Laske C, Zank M, Klein R, Stransky E, Batra A, Buchkremer G, Schott K:
විශාල මානසික අවපීඩනයෙන් පෙළෙන රෝගීන්ගේ සෙරුමය තුළ ස්වයංක්රීය ප්රතිදේහ ප්රතික්රියාව,
භින්නෝන්මාදය සහ සෞඛ්ය සම්පන්න පාලනයන්. මනෝචිකිත්සා Res 2008, 158:83-86.
14. Eisenberger NI, Berkman ET, Inagaki TK, Rameson LT, Mashal NM, Irwin MR:
ප්රදාහය-ප්රේරිත ඇනෙඩෝනියාව: එන්ඩොටොක්සින් උදරීය ස්ට්රයිටම් අඩු කරයි
විපාක සඳහා ප්රතිචාර. Biol Psychiatry 2010, 68:748-754.
15. හරූන් ඊ, රයිසන් සීඑල්, මිලර් ඒඑච්: මනෝ ප්රතිශක්ති විද්යාව හමුවෙයි
ස්නායු මනෝ ඖෂධවේදය: බලපෑමේ පරිවර්තන ඇඟවුම්
හැසිරීම මත දැවිල්ල. Neuropsychopharmacology 2012, 37:137-162.
16. Benros ME, Nielsen PR, Nordentoft M, Eaton WW, Dalton SO, Mortensen PB:
අවදානම් සාධක ලෙස ස්වයං ප්රතිශක්තිකරණ රෝග සහ දරුණු ආසාදන
භින්නෝන්මාදය: වසර 30ක ජනගහන පාදක ලේඛන අධ්යයනයක්. Am J මනෝචිකිත්සාව
2011, 168:1303-1310.
17. McNally L, Bhagwagar Z, Hannestad J: දැවිල්ල, ග්ලූටමේට් සහ ග්ලියා
මානසික අවපීඩනය තුළ: සාහිත්ය සමාලෝචනයක්. CNS Spectr 2008, 13:501-510.
18. හැරිසන් NA, Brydon L, Walker C, Grey MA, Steptoe A, Critchley HD:
ප්රදාහය උප ලිංගයේ වෙනස්වීම් හරහා මනෝභාවය වෙනස් කරයි
සින්ගුලේට් ක්රියාකාරකම් සහ මෙසොලිම්බික් සම්බන්ධතාවය. ජීව මනෝචිකිත්සාව 2009,
66:407-414.19. Raison CL, Miller AH: මානසික අවපීඩනය ගිනි අවුලුවන ආබාධයක්ද?
Curr Psychiatry Rep 2011, 13:467-475.
20. Raison CL, Miller AH: මානසික අවපීඩනයේ පරිණාමීය වැදගත්කම
ව්යාධිජනක ධාරක ආරක්ෂක (PATHOS-D). Mol මනෝචිකිත්සාව 2013, 18:15-37.
21. Steiner J, Bogerts B, Sarnyai Z, Walter M, Gos T, Bernstein HG, Myint AM:
හි ප්රතිශක්තිකරණ සහ ග්ලූටමේට් උපකල්පන අතර පරතරය සමනය කිරීම
භින්නෝන්මාදය සහ ප්රධාන අවපාතය: glial NMDA හි විභව භූමිකාව
ප්රතිග්රාහක මොඩියුලේටර් සහ ආබාධිත රුධිර මොළයේ බාධක අඛණ්ඩතාව. ලෝක ජේ
Biol මනෝචිකිත්සාව 2012, 13:482-492.
22. Steiner J, Mawrin C, Ziegeler A, Bielau H, Ullrich O, Bernstein HG, Bogerts B:
භින්නෝන්මාදයෙහි HLA-DR-ධනාත්මක මයික්රොග්ලියා ව්යාප්තිය පිළිබිඹු කරයි
ආබාධිත මස්තිෂ්ක පාර්ශ්විකකරණය. Acta Neuropathol 2006, 112:305-316.
23. Papakostas GI, Shelton RC, Kinrys G, Henry ME, Bakow BR, Lipkin SH, Pi B,
තර්මන්ඩ් එල්, බිලෙලෝ ජේඒ: බහු විශ්ලේෂණයක්, සෙරුමය මත පදනම් වූ තක්සේරුව
ප්රධාන මානසික අවපීඩනය සඳහා ජීව විද්යාත්මක රෝග විනිශ්චය පරීක්ෂණය: නියමුවෙකු සහ
අනුපිටපත් අධ්යයනය. Mol මනෝචිකිත්සාව 2013, 18:332-339.
24. ක්රිෂ්ණන් ආර්: වැඩිහිටියන්ගේ ඒක ධ්රැව අවපාතය: වසංගතවේදය, ව්යාධිජනකය සහ
ස්නායු ජීව විද්යාව. UpToDate තුළ. සංස්කරණය කළේ Basow DS විසිනි. Waltham, MA: UpToDate; 2013.
25. Stovall J: වැඩිහිටියන්ගේ බයිපෝල ආබාධ: වසංගත රෝග සහ රෝග විනිශ්චය. තුළ
යාවත්කාලීනව. සංස්කරණය කළේ Basow DS විසිනි. UpToDate: Waltham; 2013.
26. ෆිෂර් බීඒ, බුකානන් ආර්ඩබ්ලිව්: භින්නෝන්මාදය: වසංගතවේදය සහ ව්යාධිජනකය.
UpToDate තුළ. සංස්කරණය කළේ Basow DS විසිනි. Waltham, MA: UpToDate; 2013.
27. Nestadt G, Samuels J, Riddle M, Bienvenu OJ 3rd, Liang KY, LaBuda M,
Walkup J, Grados M, Hoehn-Saric R: උමතුව පිළිබඳ පවුල් අධ්යයනයක්
ආබාධය. Arch Gen Psychiatry 2000, 57:358-363.
28. Stefansson H, Ophoff RA, Steinberg S, Andreassen OA, Cichon S, Rujescu D,
Werge T, Pietilainen OP, Mors O, Mortensen PB, Sigurdsson E, Gustafsson O,
Nyegaard M, Tuulio-Henriksson A, Ingason A, Hansen T, Suvisaari J,
Lonnqvist J, Paunio T, B'rglum AD, Hartmann A, Fink-Jensen A, Nordentoft
M, Hougaard D, Norgaard-Pedersen B, Bttcher Y, Olesen J, Breuer R, M'ller
HJ, Giegling I, et al: භින්නෝන්මාදයේ අවදානම ලබා දෙන පොදු ප්රභේද.
නේචර් 2009, 460:744-747.
29. M'ller N, Schwarz MJ: සෙරොටොනින් වල ප්රතිශක්තිකරණ-මැදිහත් වෙනස් කිරීම සහ
glutamate: මානසික අවපීඩනය පිළිබඳ ඒකාබද්ධ දැක්මක් දෙසට. මෝල් මනෝචිකිත්සාව
2007, 12:988-1000.
30. Galecki P, Florkowski A, Bienkiewics M, Szemraj J: ක්රියාකාරී බහුරූපතාව
මානසික අවපීඩනයෙන් පෙළෙන රෝගීන්ගේ සයික්ලොක්සිජන්ස්-2 ජානයේ (G-765C).
Neuropsychobiology 2010, 62:116-120.
31. Levinson DF: මානසික අවපීඩනයේ ජාන: සමාලෝචනයක්. Biol මනෝචිකිත්සාව 2006,
60:84-92.
32. Zhai J, Cheng L, Dong J, Shen Q, Zhang Q, Chen M, Gao L, Chen X, Wang K,
Deng X, Xu Z, Ji F, Liu C, Li J, Dong Q, Chen C: S100B ජානය
බහුරූපතා භින්නෝන්මාදය දෙකෙහිම පූර්ව අවකාශීය ක්රියාකාරිත්වය පුරෝකථනය කරයි
රෝගීන් සහ නිරෝගී පුද්ගලයන්. Schizophr Res 2012, 134:89-94.
33. Zhai J, Zhang Q, Cheng L, Chen M, Wang K, Liu Y, Deng X, Chen X, Shen Q,
Xu Z, Ji F, Liu C, Dong Q, Chen C, Li J: S100B ජානයේ අවදානම් ප්රභේද,
උස් වූ S100B මට්ටම් හා සම්බන්ධ, ද සම්බන්ධ වේ
භින්නෝන්මාදයේ දෘශ්ය ආබාධය. Behav Brain Res 2011, 217:363-368.
34. Cappi C, Muniz RK, Sampaio AS, Cordeiro Q, Brentani H, Palacios SA,
Marques AH, Vallada H, Miguel EC, Guilherme L, Hounie AG: සංගමය
TNF-alpha ජානයේ ක්රියාකාරී බහුරූපතා අතර අධ්යයනය සහ
උමතු-සම්පීඩන ආබාධය. Arq Neuropsiquiatr 2012, 70:87-90.
35. Miguel-Hidalgo JJ, Baucom C, Dilley G, Overholser JC, Meltzer HY,
Stockmeier CA, Rajkowska G: Glial fibrillary acidic protein
පූර්ව ඉදිරිපස බාහිකයේ ප්රතිශක්තිකරණ ක්රියාකාරීත්වය බාලයා වෙන්කර හඳුනා ගනී
විශාල මානසික අවපීඩන ආබාධයකින් පෙළෙන වැඩිහිටි වැඩිහිටියන්. Biol Psychiatry 2000, 48:861-873.
36. Altshuler LL, Abulseoud OA, Foland Ross L, Bartzokis G, Chang S, Mintz J,
Hellemann G, Vinters HV: Amygdala astrocyte reduction in subjects
ප්රධාන මානසික අවපීඩනය, නමුත් බයිපෝල අක්රමිකතාව නොවේ. Bipolar Disord 2010,
12:541-549.
37. Webster MJ, Knable MB, Johnston-Wilson N, Nagata K, Inagaki M, Yolken RH:
පොස්පරීකරණය කරන ලද ග්ලියල් ෆයිබ්රිලරි ආම්ලික ප්රතිශක්තිකරණ ප්රාදේශීයකරණය
රෝගීන්ගෙන් ප්රෙෆ්රන්ටල් බාහිකයේ සහ හිපොකැම්පස් වල ප්රෝටීන්
භින්නෝන්මාදය, බයිපෝල ආබාධ සහ මානසික අවපීඩනය. Brain Behav Immun 2001,
15:388-400.
38. ඩොයිල් සී, ඩීකින් ජේඑෆ්ඩබ්ලිව්: භින්නෝන්මාදයේ ඉදිරිපස බාහිකයේ තාරකා සෛල අඩුය,
මානසික අවපීඩනය සහ බයිපෝල ආබාධය. Schizophrenia Res 2002, 53:106.
39. Johnston-Wilson NL, Sims CD, Hofmann JP, Anderson L, Shore AD, Torrey
EF, Yolken RH: ඉදිරිපස බාහිකයේ මොළයේ ප්රෝටීන වල රෝග-විශේෂිත වෙනස්කම්
භින්නෝන්මාදය, බයිපෝල අක්රමිකතාව සහ ප්රධාන මානසික අවපීඩන ආබාධය, ද
Stanley Neuropathology Consortium. Mol මනෝචිකිත්සාව 2000, 5:142-149.
40. Gosselin RD, Gibney S, O'Malley D, Dinan TG, Cryan JF: කලාපය විශේෂිත
මොළයේ ග්ලියල් ෆයිබ්රිලරි ආම්ලික ප්රෝටීන් ප්රතිශක්තිකරණ ක්රියාකාරිත්වය අඩුවීම
මානසික අවපීඩනයේ මීයන්ගේ ආකෘතියක්. ස්නායු විද්යාව 2009, 159:915-925.
41. Banasr M, Duman RS: පූර්ව ඉදිරිපස බාහිකයේ ග්ලියල් පාඩුව ප්රමාණවත් වේ
මානසික අවපීඩනය වැනි හැසිරීම් ඇති කරයි. Biol Psychiatry 2008, 64:863-870.
42. Cotter D, Hudson L, Landau S: කක්ෂයේ ඉදිරිපස ව්යාධිවේදය සඳහා සාක්ෂි
බයිපෝල අක්රමිකතා සහ ප්රධාන මානසික අවපීඩනය, නමුත් භින්නෝන්මාදය තුළ නොවේ.
Bipolar Disord 2005, 7:358-369.
43. Brauch RA, Adnan El-Masri M, Parker Jr, El-Mallakh RS: Glial සෛල අංකය
සහ බයිපෝල පුද්ගලයන්ගේ පශ්චාත් මරණ පරීක්ෂණ මොළයේ නියුරෝන/ග්ලියල් සෛල අනුපාතය.
J Affect Disord 2006, 91:87-90.
44. Cotter DR, Pariante CM, Everall IP: ප්රධාන වශයෙන් ග්ලියල් සෛල අසාමාන්යතා
මානසික ආබාධ: සාක්ෂි සහ ඇඟවුම්. Brain Res Bull 2001,
55:585-595.
45. Cotter D, Mackay D, Landau S, Kerwin R, Everall I: අඩු කරන ලද glial සෛල ඝනත්වය
සහ ප්රධාන අවපීඩනය තුළ ඉදිරිපස සින්ගුලේට් බාහිකයේ නියුරෝන ප්රමාණය
ආබාධය. Arch Gen Psychiatry 2001, 58:545-553.
46. Bowley MP, Drevets WC, Ongór D, Price JL: අඩු ග්ලියල් සංඛ්යා
amygdala ප්රධාන මානසික අවපීඩන ආබාධයකි. Biol මනෝචිකිත්සාව 2002, 52:404-412.
47. Toro CT, Hallak JE, Dunham JS, Deakin JF: Glial fibrillary acidic protein සහ
භින්නෝන්මාදයේ ප්රෙෆ්රන්ටල් බාහිකයේ උප කලාපවල ග්ලූටමින් සින්තටේස්
සහ මානසික ආබාධ. Neurosci Lett 2006, 404:276-281.
48. Rajkowska G, Miguel-Hidalgo JJ, Makkos Z, Meltzer H, Overholser J,
Stockmeier C: GFAP-ප්රතික්රියාශීලී ඇස්ට්රොග්ලියා හි ස්තර-විශේෂිත අඩු කිරීම්
භින්නෝන්මාදයෙහි පෘෂ්ඨවංශික පූර්ව ඉදිරිපස බාහිකය. Schizophr Res 2002, 57:127-138.
49. ස්ටෙෆෙක් ඒඊ, මැකලම්ස්මිත් ආර්ඊ, හරුටූනියන් වී, මීඩෝර්-වුඩ්රෆ් ජේඑච්: කෝටික
glial fibrillary ආම්ලික ප්රෝටීන් සහ glutamine synthetase වල ප්රකාශනය වේ
භින්නෝන්මාදය තුළ අඩු විය. Schizophr Res 2008, 103:71-82.
50. Damadzic R, Bigelow LB, Krimer LS, Goldenson DA, Saunders RC, Kleinman
JE, Herman MM: තාරකා සෛල පිළිබඳ ප්රමාණාත්මක ප්රතිශක්ති රසායන අධ්යයනයක්
භින්නෝන්මාදය, බයිපෝල අක්රමිකතා සහ ප්රධාන වශයෙන් ඇති එන්ටෝර්හිනල් බාහිකය
මානසික අවපීඩනය: සැලකිය යුතු astrocytosis නොමැති වීම. Brain Res Bull 2001, 55:611-618.
51. Benes FM, McSparren J, Bird ED, SanGiovanni JP, Vincent SL: හිගයන්
භින්නෝන්මාදයේ පූර්ව හා සින්ගුලේට් බාහිකවල කුඩා අන්තර් නියුරෝන
සහ භින්නෝන්මාදය සහිත රෝගීන්. Arch Gen Psychiatry 1991, 48:996-1001.
52. M'ller N, Schwarz MJ: ප්රතිශක්තිකරණ පද්ධතිය සහ භින්නෝන්මාදය. Curr Immunol
එළිදරව් 2010, 6:213-220.
53. Steiner J, Walter M, Gos T, Guillemin GJ, Bernstein HG, Sarnyai Z, Mawrin C,
Brisch R, Bielau H, Meyer Zu Schwabedissen L, Bogerts B, Myint AM: දරුණු
මානසික අවපීඩනය මයික්රොග්ලියල් ක්විනොලිනික් අම්ලය වැඩි වීම සමඟ සම්බන්ධ වේ
ඉදිරිපස සින්ගුලේට් ගයිරස් හි උප කලාප: ප්රතිශක්තිකරණයක් සඳහා සාක්ෂි
glutamatergic neurotransmission? J Neuroinflammation 2011, 8:94.
54. Vostrikov VM, Uranova NA, Orlovskaya DD: perineuronal හි හිඟය
භින්නෝන්මාදයේ සහ මනෝභාවයේ පූර්ව ඉදිරිපස බාහිකයේ ඔලිගොඩෙන්ඩ්රොසයිට්
ආබාධ. Schizophr Res 2007, 94:273-280.
55. Rajkowska G, Miguel-Hidalgo JJ: Gliogenesis සහ glial ව්යාධිවේදය තුළ
මානසික අවපීඩනය. CNS Neurol Disord Drug Targets 2007, 6:219-233.
56. Uranova NA, Vostrikov VM, Orlovskaya DD, Rachmanova VI:
භින්නෝන්මාදය සහ
මානසික ආබාධ: Stanley Neuropathology Consortium හි අධ්යයනයක්.
Schizophr Res 2004, 67:269-275.
57. යුරනෝවා එන්: ඔලිගොඩන්ඩ්රොසයිට් වලට හානි වීම සහ නැතිවීම තීරණාත්මක වේ.
භින්නෝන්මාදය සහ මානසික ආබාධවල ව්යාධිජනකය (සොයාගැනීම් ආකෘතිය
පශ්චාත් මරණ පරීක්ෂණ). Neuropsychopharmacology 2004, 29:S33.
58. Uranova NA, Orlovskaya DD, Vostrikov VM, Rachmanova VI: අඩු විය
III ස්ථරයේ පිරමිඩීය නියුරෝන වල ඔලිගොඩෙන්ද්රොග්ලියල් චන්ද්රිකාවල ඝනත්වය
භින්නෝන්මාදය සහ මානසික ආබාධවල පූර්ව ඉදිරිපස බාහිකය. Schizophr Res
2002, 53:107.
59. Vostrikov VM, Uranova NA, Rakhmanova VI, Orlovskaia DD: පහත්
භින්නෝන්මාදයෙහි පූර්ව ඉදිරිපස බාහිකයේ oligodendroglial සෛල ඝනත්වය.
Zh Nevrol Psikhiatr Im SS Korsakova 2004, 104:47-51.
60. Uranova NA, Zimina IS, Vikhreva OV, Krukov NO, Rachmanova VI, Orlovskaya
DD: නියෝකෝටෙක්ස් හි කේශනාලිකා වල අල්ට්රාව්යුහාත්මක හානි
භින්නෝන්මාදය. World J Biol මනෝචිකිත්සාව 2010, 11:567-578.
61. Hof PR, Haroutunian V, Friedrich VL Jr, Byne W, Buitron C, Perl DP, Davis KL:
සුපිරි වල ඔලිගොඩන්ඩ්රොසයිට් වල අලාභය සහ වෙනස් කරන ලද අවකාශීය ව්යාප්තිය
භින්නෝන්මාදයෙහි ඉදිරිපස ගයිරස්. Biol මනෝචිකිත්සාව 2003, 53:1075-1085.
62. Davis KL, Stewart DG, Friedman JI, Buchsbaum M, Harvey PD, Hof PR,
Buxbaum J, Haroutunian V: භින්නෝන්මාදයෙහි සුදු පදාර්ථ වෙනස්කම්:
මයිලින් ආශ්රිත අක්රියතාව සඳහා සාක්ෂි. Arch Gen Psychiatry 2003,
60:443-456.63. Flynn SW, Lang DJ, Mackay AL, Goghari V, Vavasour IM, Whittall KP, Smith
GN, Arango V, Mann JJ, Dwork AJ, Falkai P, Honer WG: අසාමාන්යතා
භින්නෝන්මාදයෙහි myelination MRI සමඟ vivo තුළ අනාවරණය වී ඇති අතර පශ්චාත් මරණ පරීක්ෂණය
oligodendrocyte ප්රෝටීන විශ්ලේෂණය සමඟ. Mol මනෝචිකිත්සාව 2003,
8:811-820.
64. Uranova NA, Vostrikov VM, Vikhreva OV, Zimina IS, Kolomeets NS, Orlovskaya
DD: භින්නෝන්මාදය තුළ ඔලිගොඩෙන්ඩ්රොසයිට් ව්යාධි විද්යාවේ කාර්යභාරය. ඉන්ට් ජේ
Neuropsychopharmacol 2007, 10:537-545.
65. Byne W, Kidkardnee S, Tatusov A, Yiannoulos G, Buchsbaum MS,
Haroutunian V: භින්නෝන්මාදය ආශ්රිත නියුරෝන අඩු කිරීම සහ
ඉදිරිපස ප්රධාන තාලමික් න්යෂ්ටියේ ඔලිගොඩන්ඩ්රොසයිට් සංඛ්යා.
Schizophr Res 2006, 85:245-253.
66. Hamidi M, Drevets WC, Price JL: amygdala හි Glial අඩු කිරීම
මානසික අවපීඩනය ඔලිගොඩන්ඩ්රොසයිට් නිසා ඇතිවේ. Biol මනෝචිකිත්සාව 2004,
55:563-569.
67. Bayer TA, Buslei R, Havas L, Falkai P: මයික්රොග්ලියාව සක්රිය කිරීම සඳහා සාක්ෂි
මානසික රෝග ඇති රෝගීන්. Neurosci Lett 1999, 271:126-128.
68. Steiner J, Bielau H, Brisch R, Danos P, Ullrich O, Mawrin C, Bernstein HG,
Bogerts B: සියදිවි නසාගැනීමේ ස්නායු ජීව විද්යාවේ ප්රතිශක්තිකරණ අංශ:
භින්නෝන්මාදය සහ මානසික අවපීඩනය තුළ ක්ෂුද්ර ග්ලියල් ඝනත්වය ඉහළ යයි
සියදිවි නසාගැනීම් හා සම්බන්ධ. J Psychiatr Res 2008, 42:151-157.
69. රාඕ ජේඑස්, හැරී ජීජේ, රැපෝපෝට් එස්අයි, කිම් එච්ඩබ්ලිව්: උද්දීපනය වැඩි වීම සහ
බයිපෝලයෙන් පශ්චාත් මරණ පරීක්ෂණයේ ඉදිරිපස බාහිකයේ ස්නායු ගිනි අවුලුවන සලකුණු
ආබාධ රෝගීන්. Mol මනෝචිකිත්සාව 2010, 15:384-392.
70. Bernstein HG, Steiner J, Bogerts B: භින්නෝන්මාදයෙහි ග්ලියල් සෛල:
ව්යාධිජනක වැදගත්කම සහ චිකිත්සාව සඳහා ඇති විය හැකි ප්රතිවිපාක.
විශේෂඥ Rev Neurother 2009, 9:1059-1071.
71. Chen SK, Tvrdik P, Peden E, Cho S, Wu S, Spangrude G, Capecchi MR:
Hoxb8 විකෘති මීයන් තුළ ව්යාධිජනක හැඩගැන්වීමේ Hematopoietic සම්භවය.
සෛල 2010, 141:775-785.
72. Antony JM: ක්ෂුද්ර ග්ලියා සමඟ වැඩීම සහ වැඩීම. Sci Signal 2010, 3:jc8.
73. Wonodi I, Stine OC, Sathyasaikumar KV, Roberts RC, Mitchell BD, Hong LE,
Kajii Y, Thaker GK, Schwarcz R: Downregulated kynurenine 3-
භින්නෝන්මාදයේ මොනොඔක්සිජන්ස් ජාන ප්රකාශනය සහ එන්සයිම ක්රියාකාරිත්වය
සහ භින්නෝන්මාද එන්ඩොෆෙනොටයිප් සමඟ ජානමය සම්බන්ධය. ආරුක්කු ජෙනරාල්
මනෝචිකිත්සාව 2011, 68:665-674.
74. Raison CL, Lowry CA, Rook GA: දැවිල්ල, සනීපාරක්ෂාව සහ
කම්පන: සම පරිණාමිත, ඉවසිලිවන්ත සමග සම්බන්ධතා නැති වීම
ක්ෂුද්ර ජීවීන් සහ ප්රධාන ව්යාධිවේදය සහ ප්රතිකාර
මානසික අවපීඩනය. Arch Gen Psychiatry 2010, 67:1211-1224.
75. Drexhage RC, Hoogenboezem TH, Versnel MA, Bergout A, Nolen WA,
Drexhage HA: රෝගීන් තුළ මොනොසයිට් සහ ටී සෛල ජාල සක්රීය කිරීම
බයිපෝල අක්රමිකතා සමඟ. Brain Behav Immun 2011, 25:1206-1213.
76. ස්ටයිනර් ජේ, ජේකොබ්ස් ආර්, පැන්ටෙලි බී, බ්රවුන්ර් එම්, ෂිල්ට්ස් කේ, බාන් එස්, හර්බර්ත් එම්,
Westphal S, Gos T, Walter M, Bernstein HG, Myint AM, Bogerts B: උග්ර
භින්නෝන්මාදය සමඟ T සෛලය අඩු වීම සහ B සෛලය වැඩි වීම සිදු වේ
ප්රතිශක්තිය. Eur Arch Psychiatry Clin Neurosci 2010, 260:509–518.
77. Rotge JY, Aouizerate B, Tignol J, Bioulac B, Burbaud P, Guehl D: The
ග්ලූටමේට් මත පදනම් වූ ජාන ප්රතිශක්තිකරණ උපකල්පනය උමතු-සම්පීඩනය තුළ
ආබාධ, ජාන සිට රෝග ලක්ෂණ දක්වා ඒකාබද්ධ ප්රවේශයක්.
ස්නායු විද්යාව 2010, 165:408-417.
78. Y'ksel C, Ongr D: චුම්භක අනුනාද වර්ණාවලීක්ෂ අධ්යයනය
මානසික ආබාධවල ග්ලූටමේට් ආශ්රිත අසාමාන්යතා. Biol මනෝචිකිත්සාව 2010,
68:785-794.
79. රාඕ ජේඑස්, කෙලොම් එම්, රීස් ඊඒ, රැපෝපෝට් එස්අයි, කිම් එච්ඩබ්ලිව්: අස්ථායී ග්ලූටමේට්
සහ බයිපෝලර් සිට පශ්චාත් මරණ පරීක්ෂණයේ ඉදිරිපස බාහිකයේ ඩොපමයින් ප්රවාහකයන්
සහ භින්නෝන්මාද රෝගීන්. J Affect Disord 2012, 136:63-71.
80. බවර් ඩී, ගුප්තා ඩී, හරෝටූනියන් වී, මීඩෝර්-වුඩ්රෆ් ජේඑච්, මැකලම්ස්මිත් ආර්ඊ:
ග්ලූටමේට් ප්රවාහකයේ සහ ප්රවාහකයේ අසාමාන්ය ප්රකාශනය
වැඩිහිටි රෝගීන්ගේ පූර්ව ඉදිරිපස බාහිකයේ අන්තර් ක්රියාකාරී අණු
භින්නෝන්මාදය. Schizophr Res 2008, 104:108-120.
81. Matute C, Melone M, Vallejo-Illarramendi A, Conti F: ප්රකාශනය වැඩි වීම
පූර්ව ඉදිරිපස බාහිකයේ ඇති තාරකා සෛල ග්ලූටමේට් ප්රවාහක GLT-1 හි
භින්නෝන්මාදය. 2005, 49:451-455.
82. Smith RE, Haroutunian V, Davis KL, Meador-Woodruff JH: ප්රකාශනය
විෂයයන්හි තලමස් හි උද්දීපනය කරන ඇමයිනෝ අම්ල ප්රවාහක පිටපත්
භින්නෝන්මාදය සමඟ. Am J මනෝචිකිත්සාව 2001, 158:1393-1399.
83. McCullumsmith RE, Meador-Woodruff JH: Striatal excitatory ඇමයිනෝ අම්ලය
භින්නෝන්මාදයේ ප්රවාහක පිටපත් ප්රකාශනය, බයිපෝල අක්රමිකතාව,
සහ ප්රධාන මානසික අවපීඩනය. ස්නායු මනෝ ඖෂධවේදය 2002,
26:368-375.
84. Pittenger C, Bloch MH, Williams K: ග්ලූටමේට් අසාමාන්යතා
බලගතු ආබාධ: ස්නායු ජීව විද්යාව, ව්යාධි භෞතවේදය සහ ප්රතිකාර.
Pharmacol Ther 2011, 132:314-332.
85. හෂිමොටෝ කේ: ව්යාධි භෞතවේදය තුළ ග්ලූටමේට් හි නැගී එන භූමිකාව
ප්රධාන මානසික අවපීඩන ආබාධය. Brain Res Rev 2009, 61:105-123.
86. Hashimoto K, Sawa A, Iyo M: මොළයේ ග්ලූටමේට් මට්ටම් වැඩි වීම
මානසික ආබාධ සහිත රෝගීන්. Biol මනෝචිකිත්සාව 2007, 62:1310-1316.
87. Burbaeva G, Boksha IS, Turishcheva MS, Vorobyeva EA, Savushkina OK,
Tereshkina EB: Glutamine synthetase සහ glutamate dehydrogenase in
භින්නෝන්මාදයෙන් පෙළෙන රෝගීන්ගේ පූර්ව ඉදිරිපස බාහිකය. Prog
Neuropsychopharmacol Biol Psychiatry 2003, 27:675–680.
88. භට්ටාචාර්ය එස්, ඛන්නා එස්, චක්රබර්ති කේ, මහාදේවන් ඒ, ක්රිස්ටෝපර් ආර්,
ශංකර් SK: ප්රති-මොළයේ ස්වයං ප්රතිදේහ සහ වෙනස් කළ උද්දීපනය
උමතු-සම්පීඩන ආබාධයේ ස්නායු සම්ප්රේෂක.
Neuropsychopharmacology 2009, 34:2489–2496.
89. Sanacora G, Gueorguieva R, Epperson CN, Wu YT, Appel M, Rothman DL,
ක්රිස්ටල් ජේඑච්, මේසන් ජීඑෆ්: ගැමාඇමිනොබියුටිරික් හි උප විශේෂ-විශේෂිත වෙනස් කිරීම්
විශාල මානසික අවපීඩනයෙන් පෙළෙන රෝගීන්ගේ අම්ලය සහ ග්ලූටමේට්.
Arch Gen Psychiatry 2004, 61:705-713.
90. Marsman A, van den Heuvel MP, Klomp DW, Kahn RS, Luijten PR, Hulshoff
Pol HE: භින්නෝන්මාදයේ ග්ලූටමේට්: අවධානය යොමු කළ සමාලෝචනයක් සහ මෙටා විශ්ලේෂණයක්
1H-MRS අධ්යයන. Schizophr Bull 2013, 39:120-129.
91. Liu Y, Ho RC, Mak A: Interleukin (IL)-6, tumor necrosis factor alpha
(TNF-alpha) සහ ද්රාව්ය ඉන්ටර්ලියුකින්-2 ප්රතිග්රාහක (sIL-2R) ඉහළ නංවා ඇත.
ප්රධාන මානසික අවපීඩන ආබාධ සහිත රෝගීන්: මෙටා-විශ්ලේෂණයක් සහ මෙට්රෙග්රෙෂන්.
J Affect Disord 2012, 139:230-239.
92. Brietzke E, Stabellini R, Grassis-Oliveira R, Lafer B: බයිපෝලයේ සයිටොකයින්
ආබාධ: මෑත සොයාගැනීම්, හානිකර බලපෑම් නමුත් අනාගතය සඳහා පොරොන්දු වේ
චිකිත්සක. CNS Spectr 2011. www.cnsspectrums.com/aspx/
articledetail.aspx?articleid=3596.
93. Denys D, Fluitman S, Kavelars A, Heijnen C, Westenberg H: අඩු
උමතු-සම්පීඩන ආබාධයේ TNF-alpha සහ NK ක්රියාකාරකම්.
Psychoneuroendocrinology 2004, 29:945-952.
94. බ්රැම්බිලා එෆ්, පර්නා ජී, බෙලෝඩි එල්, ඇරන්සියෝ සී, බර්ටානි ඒ, පෙරිනි ජී, කැරරෝ සී, ගවා
F: ප්ලාස්මා ඉන්ටර්ලියුකින්-1 බීටා සහ tumor necrosis සාධක සාන්ද්රණය තුළ
උමතු-සම්පීඩන ආබාධ. Biol මනෝචිකිත්සාව 1997, 42:976-981.
95. Fluitman S, Denys D, Vulink N, Schutters S, Heijnen C, Westenberg H:
Lipopolysaccharide-induced cytokine නිෂ්පාදනය උමතුවෙන්
ආබාධ සහ සාමාන්ය සමාජ කාංසාව ආබාධය. මනෝචිකිත්සාව
Res 2010, 178:313-316.
96. Janelidze S, Mattei D, Westrin A, Traskman-Bendz L, Brundin L: Cytokine
රුධිරයේ මට්ටම් සියදිවි නසා ගැනීමට උත්සාහ කරන්නන් මානසික අවපීඩනයෙන් වෙන්කර හඳුනාගත හැකිය
රෝගීන්. Brain Behav Immun 2011, 25:335-339.
97. තැපැල් M, Costallat LT, Appenzeller S: ස්නායු මනෝචිකිත්සක ප්රකාශන
පද්ධතිමය lupus erythematosus: වසංගතවේදය, ව්යාධිවේදය සහ
කළමනාකරණ. CNS ඖෂධ 2011, 25:721-736.
98. Kozora E, Hanly JG, Lapteva L, Filley CM: සංජානන අක්රියතාව
පද්ධතිමය lupus erythematosus: අතීතය, වර්තමානය සහ අනාගතය.
ආතරයිටිස් Rheum 2008, 58:3286-3298.
99. Lancaster E, Martinez-Hernandez E, Dalmau J: එන්සෙෆලයිටිස් සහ ප්රතිදේහ
උපාගමික සහ නියුරෝන සෛල මතුපිට ප්රෝටීන. ස්නායු විද්යාව 2011, 77:179-189.
100. Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon
R: AntiNMDAR රෝගීන්ගේ සායනික අත්දැකීම් සහ රසායනාගාර පරීක්ෂණ
එන්සෙෆලයිටිස්. Lancet Neurol 2011, 10:63-74.
101. Lai M, Huijbers MG, Lancaster E, Graus F, Bataller L, Balice-Gordon R, Cowell
JK, Dalmau J: ලිම්බික් එන්සෙෆලයිටිස් හි ප්රතිදේහජනක ලෙස LGI1 විමර්ශනය කිරීම
කලින් පොටෑසියම් නාලිකා වලට ආරෝපණය කර ඇත: සිද්ධි මාලාවක්. ලැන්සෙට් නියුරෝල්
2010, 9:776-785.
102. Lancaster E, Huijbers MG, Bar V, Boronat A, Wong A, Martinez-Hernandez E,
Wilson C, Jacobs D, Lai M, Walker RW, Graus F, Bataller L, Illa I, Markx S, Straus
KA, Peles E, Scherer SS, Dalmau J: caspr2 පිළිබඳ විමර්ශන, ස්වයං ප්රතිදේහජනක
එන්සෙෆලයිටිස් සහ නියුරොමියෝටෝනියාව. ඈන් නියුරෝල් 2011, 69:303-311.
103. Lancaster E, Lai M, Peng X, Hughes E, Constantinescu R, Raizer J, Friedman
D, Skeen MB, Grisold W, Kimura A, Ohta K, Iizuka T, Guzman M, Graus F,
Moss SJ, Balice-Gordon R, Dalmau J: GABA(B) ප්රතිග්රාහක සඳහා ප්රතිදේහ
අල්ලා ගැනීම් සමඟ ලිම්බික් එන්සෙෆලයිටිස්: සිද්ධි මාලාව සහ ගුනාංගීකරනය
ප්රතිදේහජනක. Lancet Neurol 2010, 9:67-76.
104. Lancaster E, Martinez-Hernandez E, Titulaer MJ, Boulos M, Weaver S, Antoine
JC, Libers E, Kornblum C, Bien CG, Honnorat J, Wong S, Xu J, කොන්ත්රාත්කරු A,
Balice-Gordon R, Dalmau J: පරිවෘත්තීය ග්ලූටමේට් වලට ප්රතිදේහ
ඔෆීලියා සින්ඩ්රෝමයේ ප්රතිග්රාහක 5. ස්නායු විද්යාව 2011, 77:1698-1701.105. Ances BM, Vitaliani R, Taylor RA, Liebeskind DS, Voloschin A, Houghton DJ,
Galetta SL, Dichter M, Alavi A, Rosenfeld MR, Dalmau J: ප්රතිකාර ප්රතිචාර
නියුරොපිල් ප්රතිදේහ මගින් හදුනාගත් ලිම්බික් එන්සෙෆලයිටිස්: MRI සහ
PET සහසම්බන්ධයි. මොළය 2005, 128:1764-1777.
106. Tofaris GK, Irani SR, Cheeran BJ, Baker IW, Cader ZM, Vincent A:
LGI1 හි ඉදිරිපත් කිරීමේ ලක්ෂණය ලෙස ප්රතිශක්තිකරණ-ප්රතිචාරාත්මක chorea
ප්රතිදේහ එන්සෙෆලයිටිස්. ස්නායු විද්යාව 2012, 79:195-196.
107. Najjar S, Pearlman D, Najjar A, Ghiasian V, Zagzag D, Devinsky O:
ග්ලූටමික් අම්ලය හා සම්බන්ධ Extralimbic autoimmune encephalitis
decarboxylase ප්රතිදේහ: අඩුවෙන් හඳුනා නොගත් ආයතනයක්ද? අපස්මාර හැසිරීම
2011, 21:306-313.
108. Titulaer MJ, McCracken L, Gabilondo I, Armangue T, Glaser C, Iizuka T, Honig
LS, Benseler SM, Kawachi I, Martinez-Hernandez E, Aguilar E, Gresa-Aribas N,
Ryan-Florance N, Torrents A, Saiz A, Rosenfeld MR, Balice-Gordon R, Graus F,
Dalmau J: දිගුකාලීන ප්රතිඵල සඳහා ප්රතිකාර සහ අනාවැකි සාධක
ප්රති-එන්එම්ඩීඒ ප්රතිග්රාහක එන්සෙෆලයිටිස් ඇති රෝගීන්: නිරීක්ෂණ කණ්ඩායමක්
අධ්යයනය. Lancet Neurol 2013, 12:157-165.
109. Dalmau J, Gleichman AJ, Hughes EG, Rossi JE, Peng X, Lai M, Dessain SK,
Rosenfeld MR, Balice-Gordon R, Lynch DR: Anti-NMDA-receptor
එන්සෙෆලයිටිස්: සිද්ධි මාලාව සහ ප්රතිදේහවල බලපෑම් විශ්ලේෂණය.
Lancet Neurol 2008, 7:1091-1098.
110. Graus F, Boronat A, Xifro X, Boix M, Svigelj V, Garcia A, Palomino A, Sabater
L, Alberch J, Saiz A: AMPA විරෝධී ප්රතිග්රාහකයේ පුළුල් වන සායනික පැතිකඩ
එන්සෙෆලයිටිස්. ස්නායු විද්යාව 2010, 74:857-859.
111. Lai M, Hughes EG, Peng X, Zhou L, Gleichman AJ, Shu H, Mata S, Kremens
D, Vitaliani R, Geschwind MD, Bataller L, Kalb RG, Davis R, Graus F, Lynch DR,
Balice-Gordon R, Dalmau J: AMPA receptor antibodies in limbic
එන්සෙෆලයිටිස් උපාගමික ප්රතිග්රාහක ස්ථානය වෙනස් කරයි. ඈන් නියුරෝල් 2009, 65:424-434.
112. Najjar S, Pearlman D, Devinsky O, Najjar A, Nadkarni S, Butler T, Zagzag D:
සෘණ VGKC සංකීර්ණයක් සහිත ස්නායු මනෝචිකිත්සක ස්වයං ප්රතිශක්තිකරණ එන්සෙෆලයිටිස්,
NMDAR, සහ GAD ස්වයං ප්රතිදේහ: සිද්ධි වාර්තාවක් සහ සාහිත්ය සමාලෝචනයක්,
ඉදිරියට. Cogn Behav Neurol. මුද්රණාලයේ.
113. Najjar S, Pearlman D, Zagzag D, Devinsky O: ස්වයංසිද්ධව විසඳා ගැනීම
seronegative autoimmune limbic encephalitis. Cogn Behav Neurol 2011,
24:99-105.
114. Gabilondo I, Saiz A, Galan L, Gonzalez V, Jadraque R, Sabater L, Sans A,
Sempere A, Vela A, Villalobos F, Vióals M, Villoslada P, Graus F: විශ්ලේෂණය
ප්රති-NMDAR එන්සෙෆලයිටිස් හි නැවත ඇතිවීම. ස්නායු විද්යාව 2011, 77:996-999.
115. Barry H, Hardiman O, Healy DG, Keogan M, Moroney J, Molnar PP, Cotter
DR, Murphy KC: Anti-NMDA receptor encephalitis: වැදගත්
මනෝවිද්යාවේ අවකල රෝග විනිශ්චය. Br J මනෝචිකිත්සාව 2011, 199:508-509.
116. Dickerson F, Stallings C, Vaughan C, Origoni A, Khushalani S, Yolken R:
උන්මාදයේ ග්ලූටමේට් ප්රතිග්රාහකයට ප්රතිදේහ. Bipolar Disord 2012,
14:547-553.
117. O'Loughlin K, Ruge P, McCauley M: Encephalitis සහ schizophrenia: a
වචන පිළිබඳ කාරණය. Br J මනෝචිකිත්සාව 2012, 201:74.
118. Parratt KL, Allan M, Lewis SJ, Dalmau J, Halmagyi GM, Spies JM: Acute
තරුණ කාන්තාවක් තුළ මානසික රෝග: එන්සෙෆලයිටිස් අසාමාන්ය ආකාරයකි.
Med J Aust 2009, 191:284-286.
119. Suzuki Y, Kurita T, Sakurai K, Takeda Y, Koyama T: NMDA විරෝධී සිද්ධි වාර්තාව
භින්නෝන්මාදය යැයි සැක කරන receptor encephalitis. Seishin Shinkeigaku
Zasshi 2009, 111:1479-1484.
120. Tsutsui K, Kanbayashi T, Tanaka K, Boku S, Ito W, Tokunaga J, Mori A,
Hishikawa Y, Shimizu T, Nishino S: Anti-NMDA-receptor antibody අනාවරණය විය
එන්සෙෆලයිටිස්, භින්නෝන්මාදය සහ මනෝවිද්යාත්මක ලක්ෂණ සහිත නර්කොලෙප්සි වලදී.
BMC මනෝචිකිත්සාව 2012, 12:37.
121. Van Putten WK, Hachimi-Idrissi S, Jansen A, Van Gorp V, Huyghens L:
9 හැවිරිදි ගැහැණු ළමයෙකු තුළ මනෝවිද්යාත්මක හැසිරීම් සඳහා අසාමාන්ය හේතුව: නඩුවක්
වාර්තාව. නඩු වාර්තාව Med 2012, 2012:358520.
122. Masdeu JC, Gonzalez-Pinto A, Matute C, Ruiz De Azua S, Palomino A, De
Leon J, Berman KF, Dalmau J: Serum IgG ප්රතිදේහ NR1 ට එරෙහිව
NMDA ප්රතිග්රාහකයේ උප ඒකකය භින්නෝන්මාදයේදී අනාවරණය වී නොමැත. ඇම් ජේ
මනෝචිකිත්සාව 2012, 169:1120-1121.
123. කිර්වාන් සීඒ, ස්වීඩෝ එස්ඊ, කුරහරා ඩී, කනින්හැම් මෙගාවොට්: ස්ට්රෙප්ටොකොකල් අනුකරණය
සහ ව්යාධිජනකයේ ප්රතිදේහ-මැදිහත් සෛල සංඥා
Sydenham's chorea. ස්වයං ප්රතිශක්තිය 2006, 39:21-29.
124. Swedo SE: Streptoccocal ආසාදනය, Tourette සින්ඩ්රෝමය සහ OCD: තිබේද?
සම්බන්ධයක්? පැන්ඩා: අශ්වයා හෝ සීබ්රා? ස්නායු විද්යාව 2010, 74:1397-1398.
125. Morer A, Lazaro L, Sabater L, Massana J, Castro J, Graus F: Antineuronal
උමතු-සම්පීඩන ආබාධ සහිත ළමුන් කණ්ඩායමක ප්රතිදේහ
සහ ටුරෙට් සින්ඩ්රෝමය. J Psychiatr Res 2008, 42:64-68.
126. Pavone P, Bianchini R, Parano E, Incorpora G, Rizzo R, Mazzone L, Trifiletti RR:
සංකීර්ණ නොවන streptococcal එදිරිව PANDAS හි මොළයට එරෙහි ප්රතිදේහ
ආසාදනය. Pediatr Neurol 2004, 30:107-110.
127. Maina G, Albert U, Bogetto F, Borghese C, Berro AC, Mutani R, Rossi F,
Vigliani MC: උමතුවෙන් පෙළෙන වැඩිහිටි රෝගීන්ගේ මොළයට එරෙහි ප්රතිදේහ
ආබාධය. J Affect Disord 2009, 116:192-200.
128. Brimberg L, Benhar I, Mascaro-Blanco A, Alvarez K, Lotan D, Winter C, Klein J,
Moses AE, Somnier FE, Leckman JF, Swedo SE, Cunningham MW, Joel D:
හැසිරීම්, ඖෂධීය සහ ප්රතිශක්තිකරණ අසාමාන්යතා පසු
streptococcal නිරාවරණය: Sydenham chorea හි නව මීයන්ගේ ආකෘතියක් සහ
ආශ්රිත ස්නායු මනෝචිකිත්සක ආබාධ. ස්නායු මනෝ ඖෂධවේදය 2012,
37:2076-2087.
129. Dale RC, Candler PM, Church AJ, Wait R, Pocock JM, Giovannoni G:
නියුරෝන මතුපිට ග්ලයිකොලිටික් එන්සයිම යනු ස්වයංක්රීය ප්රතිදේහජනක ඉලක්ක වේ
පශ්චාත්-ස්ට්රෙප්ටොකොකල් ස්වයං ප්රතිශක්තිකරණ CNS රෝගය. J Neuroimmunol 2006,
172:187-197.
130. Nicholson TR, Ferdinando S, Krishnaiah RB, Anhoury S, Lennox BR, MataixCols
D, Cleare A, Veale DM, Drummond LM, Fineberg NA, Church AJ,
Giovannoni G, Heyman I: ප්රති-බාසල් ගැන්ග්ලියා ප්රතිදේහ පැතිරීම
වැඩිහිටි උමතු-සම්පීඩන ආබාධ: හරස්කඩ අධ්යයනය. Br J මනෝචිකිත්සාව
2012, 200:381-386.
131. Wu K, Hanna GL, Rosenberg DR, Arnold PD: ග්ලූටමේට් භූමිකාව
උමතු-සම්පීඩන රෝග කාරකය සහ ප්රතිකාර කිරීමේදී සංඥා කිරීම
ආබාධය. Pharmacol Biochem Behav 2012, 100:726-735.
132. Perlmutter SJ, Leitman SF, Garvey MA, Hamburger S, Feldman E, Leonard
HL, Swedo SE: චිකිත්සක ප්ලාස්මා හුවමාරුව සහ අභ්යන්තරය
උමතු-සම්පීඩන ආබාධ සහ ටික් ආබාධ සඳහා immunoglobulin
ළමා කාලය. ලැන්සෙට් 1999, 354:1153-1158.
133. Pereira A Jr, Furlan FA: Astrocytes සහ මානව සංජානනය: ආකෘති නිර්මාණය
නියුරෝන ක්රියාකාරිත්වයේ තොරතුරු ඒකාබද්ධ කිරීම සහ මොඩියුලේෂන්.
Prog Neurobiol 2010, 92:405-420.
134. Barres BA: ග්ලියාගේ අභිරහස සහ මැජික්: ඔවුන්ගේ භූමිකාවන් පිළිබඳ ඉදිරිදර්ශනයක්
සෞඛ්ය හා රෝග. නියුරෝන 2008, 60:430-440.
135. Verkhratsky A, Parpura V, Rodriguez JJ: සිතුවිලි වාසය කරන තැන:
නියුරෝන-ග්ලියල් "විසරණ ස්නායු ජාලය" පිළිබඳ කායික විද්යාව. Brain Res Rev 2011,
66:133-151.
136. Sofroniew MV: ප්රතික්රියාශීලී ඇස්ට්රොග්ලියෝසිස් සහ ග්ලියල් කැළල අණුක විච්ඡේදනය
පිහිටුවීම. Trends Neurosci 2009, 32:638-647.
137. හැමිල්ටන් එන්බී, ඇට්වෙල් ඩී: තාරකා සෛල ඇත්ත වශයෙන්ම එක්සයිටෝස් ස්නායු සම්ප්රේෂක ද?
Nat Rev Neurosci 2010, 11:227-238.
138. Rajkowska G: මානසික ආබාධ පිළිබඳ පශ්චාත් මරණ පරීක්ෂණ මගින් පෙන්නුම් කරන්නේ වෙනස් වී ඇති බවයි
නියුරෝන සහ ග්ලියල් සෛල ගණන. Biol මනෝචිකිත්සාව 2000, 48:766-777.
139. Coupland NJ, Ogilvie CJ, Hegadoren KM, Seres P, Hanstock CC, Allen PS:
ප්රධාන මානසික අවපීඩන ආබාධයක් තුළ පූර්ව පෙරමුනු Myo-inositol අඩු වීම.
Biol මනෝචිකිත්සාව 2005, 57:1526-1534.
140. Miguel-Hidalgo JJ, Overholser JC, Jurjus GJ, Meltzer HY, Dieter L, Konick L,
Stockmeier CA, Rajkowska G: සනාල සහ බාහිර ප්රතිශක්තිකරණ ක්රියාකාරිත්වය
කක්ෂීය ඉදිරිපස බාහිකයේ අන්තර් සෛලීය ඇලවුම් අණු 1 සඳහා
ප්රධාන මානසික අවපීඩනය ඇති විෂයයන්: වයස මත රඳා පවතින වෙනස්කම්. J බලපෑම ආබාධ
2011, 132:422-431.
141. Miguel-Hidalgo JJ, Wei JR, Andrew M, Overholser JC, Jurjus G, Stockmeier
CA, Rajkowska G: ඇල්කොහොල් වල prefrontal cortex හි Glia ව්යාධිවේදය
මානසික අවපීඩන රෝග ලක්ෂණ සමඟ සහ නැතිව යැපීම. Biol මනෝචිකිත්සාව 2002,
52:1121-1133.
142. Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, Meltzer HY,
Uylings HB, Friedman L, Rajkowska G: පශ්චාත් මරණ පරීක්ෂණයේදී සෛලීය වෙනස්කම්
විශාල මානසික අවපීඩනයක හිපොකැම්පස්. Biol මනෝචිකිත්සාව 2004, 56:640-650.
143. ඔන්ගර් ඩී, ඩ්රෙවෙට්ස් ඩබ්ලිව්සී, ප්රයිස් ජේඑල්: උපප්රාණික ප්රෙෆ්රන්ටල් හි ග්ලියල් අඩු කිරීම
මානසික ආබාධවල බාහිකය. Proc Natl Acad Sci USA 1998, 95:13290-13295.
144. Gittins RA, Harrison PJ: ග්ලියා සහ නියුරෝන පිළිබඳ රූපමිතික අධ්යයනයක්
මානසික ආබාධයේ ඉදිරිපස සින්ගුලේට් බාහිකය. J Affect Disord 2011,
133:328-332.
145. Cotter D, Mackay D, Beasley C, Kerwin R, Everall I: අඩු කළ ග්ලියල් ඝනත්වය
සහ ප්රධාන මානසික අවපීඩන ආබාධ සහ භින්නෝන්මාදය තුළ නියුරෝන පරිමාව
ඉදිරිපස සින්ගුලේට් බාහිකය [වියුක්ත]. Schizophrenia Res 2000, 41:106.
146. Si X, Miguel-Hidalgo JJ, Rajkowska G: GFAP ප්රකාශනය අඩු වේ
මානසික අවපීඩනය තුළ පෘෂ්ඨවංශික පූර්ව ඉදිරිපස බාහිකය. ස්නායු විද්යාව සඳහා සමාජය තුළ; 2003.
ස්නායු විද්යා රැස්වීම් සැලැස්ම: නිව් ඔර්ලියන්ස්; 2003.
147. Legutko B, Mahajan G, Stockmeier CA, Rajkowska G: සුදු පදාර්ථ තාරකා සෛල
මානසික අවපීඩනය තුළ අඩු වේ. ස්නායු විද්යාව සඳහා සමාජය තුළ. ස්නායු විද්යා රැස්වීම
සැලසුම්කරු: වොෂින්ටන්, ඩීසී; 2011.148. එඩ්ගාර් එන්, සිබිල් ඊ: ඔලිගොඩන්ඩ්රොසයිට් සඳහා ප්රේරක ක්රියාකාරී භූමිකාවක්
මනෝභාවය නියාමනය. Transl Psychiatry 2012, 2:e109.
149. Rajkowska G, Halaris A, Selemon LD: නියුරෝන සහ ග්ලියල් හි අඩු කිරීම්
ඝනත්වය බයිපෝලයේ පෘෂ්ඨවංශික පූර්ව ඉදිරිපස බාහිකය සංලක්ෂිත කරයි
ආබාධය. Biol Psychiatry 2001, 49:741-752.
150. Cotter D, Mackay D, Chana G, Beasley C, Landau S, Everall IP: අඩු කර ඇත
නියුරෝන ප්රමාණය සහ පෘෂ්ඨවංශික 9 වන ප්රදේශයේ ග්ලියල් සෛල ඝනත්වය
ප්රධාන මානසික අවපීඩන ආබාධ සහිත විෂයයන් සඳහා පූර්ව ඉදිරිපස බාහිකය. සෙරෙබ් කෝටෙක්ස්
2002, 12:386-394.
151. Stark AK, Uylings HB, Sanz-Arigita E, Pakkenberg B: Glial සෛල අහිමි වීම
පූර්ව සින්ගුලේට් බාහිකය, පූර්ව ඉදිරිපස බාහිකයේ උප කලාපයක්,
භින්නෝන්මාදය සහිත විෂයයන්. Am J මනෝචිකිත්සාව 2004, 161:882-888.
152. Konopaske GT, Dorph-Petersen KA, Sweet RA, Pierri JN, Zhang W, Sampson
AR, ලුවිස් ඩීඒ: ජ්යෝතිඃ ශාස්ත්රය මත නිදන්ගත ප්රති-සයිකෝටික නිරාවරණයේ බලපෑම සහ
මැකේක් වඳුරන්ගේ ඔලිගොඩන්ඩ්රොසයිට් සංඛ්යා. ජීව මනෝචිකිත්සාව 2008,
63:759-765.
153. Selemon LD, Lidow MS, Goldman-Rakic PS: පරිමාව සහ ග්ලියල් වැඩි වීම
නිදන්ගත සමග සංෙයෝජිත primate prefrontal බාහිකයේ ඝනත්වය
මනෝවිරෝධී ඖෂධ නිරාවරණය. Biol මනෝචිකිත්සාව 1999, 46:161-172.
154. Steiner J, Bernstein HG, Bielau H, Farkas N, Winter J, Dobrowolny H, Brisch R,
Gos T, Mawrin C, Myint AM, Bogerts B: S100B-immunopositive glia වේ
අවශේෂ භින්නෝන්මාදය හා සසඳන විට ව්යාකූලත්වයේ උසස්: a
රූපමිතික අධ්යයනය. J Psychiatr Res 2008, 42:868-876.
155. කාටර් CJ: eIF2B සහ oligodendrocyte පැවැත්ම: එහිදී ස්වභාවය සහ පෝෂණය
බයිපෝල අක්රමිකතා සහ භින්නෝන්මාදයෙන් හමුවෙනවාද? Schizophr Bull 2007,
33:1343-1353.
156. Hayashi Y, Nihonmatsu-Kikuchi N, Hisanaga S, Yu XJ, Tatebayashi Y:
භින්නෝන්මාදය අතර ස්නායු රෝග විද්යාත්මක සමානකම් සහ වෙනස්කම්
සහ බයිපෝල අක්රමිකතාව: ප්රවාහ සෛලමිතික පශ්චාත් මරණ පරීක්ෂණ මොළයේ අධ්යයනයක්.
PLoS One 2012, 7:e33019.
157. Uranova NA, Vikhreva OV, Rachmanova VI, Orlovskaya DD: Ultrastructural
මයිලිනේටඩ් තන්තු සහ ඔලිගොඩන්ඩ්රොසයිට් වල ප්රෙෆ්රන්ටල් වල වෙනස්වීම්
භින්නෝන්මාදයෙහි බාහිකය: පශ්චාත් මරණ පරීක්ෂණ රූපමිතික අධ්යයනයක්.
Schizophr Res Treatment 2011, 2011:325789.
158. Torres-Platas SG, Hercher C, Davoli MA, Maussion G, Labonte B, Turecki
ජී, මෙචවාර් එන්: ඉදිරිපස සින්ගුලේට් සුදු පැහැයෙන් ඇස්ට්රොසයිටික් හයිපර්ට්රොෆි
මානසික අවපීඩනයෙන් පෙළෙන සියදිවි නසාගැනීම් පිළිබඳ කාරණය. ස්නායු මනෝ ඖෂධවේදය 2011,
36:2650-2658.
159. Pereira A Jr, Furlan FA: නියුරෝන තාරකා සෛල සඳහා සමමුහුර්ත කිරීමේ භූමිකාව පිළිබඳ
අන්තර්ක්රියා සහ සංජානනීය සවිඥානක සැකසුම්. J Biol Phys 2009,
35:465-480.
160. Kettenmann H, Hanisch UK, Noda M, Verkhratsky A: කායික විද්යාව
ක්ෂුද්ර ග්රහයා. Physiol Rev 2011, 91:461-553.
161. Tremblay ME, Stevens B, Sierra A, Wake H, Bessis A, Nimmerjahn A: භූමිකාව
නිරෝගී මොළයේ ඇති මයික්රොග්ලියා. J Neurosci 2011, 31:16064-16069.
162. Kaindl AM, Degos V, Peineau S, Gouadon E, Chhor V, Loron G, Le
Charpentier T, Josserand J, Ali C, Vivien D, Collingridge GL, Lombet A, Issa L,
Rene F, Loeffler JP, Kavelars A, Verney C, Mantz J, Gressens P: Activation of
microglial N-methyl-D-aspartate receptors මගින් දැවිල්ල ඇති කරයි
වර්ධනය වන සහ පරිණත මොළයේ නියුරෝන සෛල මරණය. ඈන් නියුරෝල්
2012, 72:536-549.
163. Schwartz M, Shaked I, Fisher J, Mizrahi T, Schori H: ආරක්ෂිත
ඇතුළත සතුරාට එරෙහිව ස්වයං ප්රතිශක්තිය: ග්ලූටමේට් විෂ වීමට එරෙහිව සටන් කිරීම.
Trends Neurosci 2003, 26:297-302.
164. Pacheco R, Gallart T, Lluis C, Franco R: T-සෛලයේ ග්ලූටමේට් භූමිකාව
මැදිහත් ප්රතිශක්තිය. J Neuroimmunol 2007, 185:9-19.
165. Najjar S, Pearlman D, Miller DC, Devinsky O: පරාවර්තක අපස්මාරය ආශ්රිත
ක්ෂුද්ර ජීවී ක්රියාකාරිත්වය සමඟ. ස්නායු විශේෂඥ 2011, 17:249-254.
166. Schwartz M, Butovsky O, Bruck W, Hanisch UK: Microglial phenotype: යනු
කැපවීම ආපසු හැරවිය හැකිද? Trends Neurosci 2006, 29:68-74.
167. Wang F, Wu H, Xu S, Guo X, Yang J, Shen X: Macrophage migration
නිෂේධනීය සාධකය සක්රීය කරයි cyclooxygenase 2-prostaglandin E2
කොඳු ඇට පෙළේ ක්ෂුද්ර ග්රහයා. Neurosci Res 2011, 71:210-218.
168. Zhang XY, Xiu MH, Song C, Chenda C, Wu GY, Haile CN, Kosten TA, Kosten
TR: කිසිවිටෙක ඖෂධ නොකළ සහ ඖෂධීය සෙරුමය S100B වැඩි වීම
භින්නෝන්මාද රෝගීන්. J Psychiatr Res 2010, 44:1236-1240.
169. Kawasaki Y, Zhang L, Cheng JK, Ji RR: මධ්යම සයිටොකයින් යාන්ත්රණ
සංවේදීකරණය: interleukin-1beta හි වෙනස් සහ අතිච්ඡාදනය වන භූමිකාව,
ඉන්ටර්ලියුකින්-6, සහ උපාගම නියාමනය කිරීමේදී tumor necrosis factor-alpha
පෘෂ්ඨීය කොඳු ඇට පෙළේ ස්නායු ක්රියාකාරිත්වය. J Neurosci 2008,
28:5189-5194.
170. M'ller N, Schwarz MJ: ග්ලූටමැටර්ජික් වල ප්රතිශක්තිකරණ පදනම
භින්නෝන්මාදයෙහි බාධාව: ඒකාබද්ධ දර්ශනයක් දෙසට. ජේ නියුරල්
Transm Suppl 2007, 72:269–280.
171. Hestad KA, Tonseth S, Stoen CD, Ueland T, Aukrust P: ඉහළ ගිය ප්ලාස්මා මට්ටම්
මානසික අවපීඩනයෙන් පෙළෙන රෝගීන්ගේ පිළිකා නෙරෝසිස් සාධකය ඇල්ෆා: සාමාන්යකරණය
විද්යුත් කම්පන චිකිත්සාව අතරතුර. J ECT 2003, 19:183-188.
172. Kubera M, Kenis G, Bosmans E, Zieba A, Dudek D, Nowak G, Maes M:
ඉන්ටර්ලියුකින්-6, ඉන්ටර්ලියුකින්-10 සහ ඉන්ටර්ලියුකින්-1 ප්රතිග්රාහක ප්ලාස්මා මට්ටම්
මානසික අවපීඩනයේ විරුද්ධවාදියා: උග්ර තත්ත්වය සහ පසු සංසන්දනය කිරීම
සමනය. Pol J Pharmacol 2000, 52:237-241.
173. Miller BJ, Buckley P, Seabolt W, Mellor A, Kirkpatrick B: Meta-analysis of
භින්නෝන්මාදයෙහි සයිටොකයින් වෙනස්වීම්: සායනික තත්ත්වය සහ මනෝවිරෝධක
බලපෑම්. Biol මනෝචිකිත්සාව 2011, 70:663-671.
174. Potvin S, Stip E, Sepehry AA, Gendron A, Bah R, Kouassi E: ගිනි අවුලුවන
භින්නෝන්මාදයෙහි සයිටොකයින් වෙනස්වීම්: ක්රමානුකූල ප්රමාණාත්මක සමාලෝචනයක්.
Biol මනෝචිකිත්සාව 2008, 63:801-808.
175. Reale M, Patruno A, De Lutiis MA, Pesce M, Felaco M, Di Giannantonio M, Di
නිකොලා එම්, ග්රිලි ඒ: රසායනික සයිටොකයින් නිෂ්පාදනය අක්රිය කිරීම
භින්නෝන්මාද රෝගීන් එදිරිව සෞඛ්ය සම්පන්න පාලනයන්. BMC Neurosci 2011, 12:13.
176. Fluitman SB, Denys DA, Heijnen CJ, Westenberg HG: පිළිකුල TNFalpha වලට බලපායි,
උමතු-සම්පීඩන රෝගීන්ගේ IL-6 සහ noradrenalin මට්ටම්
ආබාධය. Psychoneuroendocrinology 2010, 35:906-911.
177. Konuk N, Tekin IO, Ozturk U, Atik L, Atasoy N, Bektas S, Erdogan A: ප්ලාස්මා
tumor necrosis factor-alpha සහ interleukin-6 මට්ටම් උමතුවෙන්
බලගතු ආබාධය. මැදිහත්කරුවන් Inflamm 2007, 2007:65704.
178. Monteleone P, Catapano F, Fabrazzo M, Tortorella A, Maj M: අඩු විය
උමතුවෙන් පෙළෙන රෝගීන්ගේ tumor necrosis factor-alpha හි රුධිර මට්ටම්
ආබාධය. Neuropsychobiology 1998, 37:182-185.
179. Marazziti D, Presta S, Pfanner C, Gemignani A, Rossi A, Sbrana S, Rocchi V,
ඇම්බ්රෝගි එෆ්, කැසානෝ ජීබී: වැඩිහිටි උමතු කම්පනයෙහි ප්රතිශක්තිකරණ වෙනස්කම්
ආබාධය. Biol Psychiatry 1999, 46:810-814.
180. Zai G, Arnold PD, Burroughs E, Richter MA, Kennedy JL: Tumor necrosis
සාධකය-ඇල්ෆා ජානය උමතු-සම්පීඩන ආබාධ සමඟ සම්බන්ධ නොවේ.
Psychiatr Genet 2006, 16:43.
181. Rodr'guez AD, Gonz'lez PA, Garcàa MJ, de la Rosa A, Vargas M, Marrero F:
උග්ර ප්රෝගිනි අවුලුවන සයිටොකයින් සාන්ද්රණයේ සර්කැඩියානු වෙනස්කම්
හෘදයාබාධ. Rev Esp Cardiol 2003, 56:555-560.
182. Oliver JC, Bland LA, Oettinger CW, Arduino MJ, McAllister SK, Aguero SM,
Favero MS: Cytokine kinetics in vitro whole blood model පහත දැක්වේ
එන්ඩොටොක්සින් අභියෝගයක්. Lymphokine Cytokine Res 1993, 12:115-120.
183. Le T, Leung L, Carroll WL, Schibler KR: ඉන්ටර්ලියුකින්-10 ජාන නියාමනය
ප්රකාශනය: එහි ඉහළ නැංවීම සඳහා ගිණුම් ගත හැකි යාන්ත්රණයන් සහ
රුධිර ඒක න්යෂ්ටික සෛල මගින් එහි ප්රකාශනයේ පරිණත වෙනස්කම්.
ලේ 1997, 89:4112-4119.
184. Lee MC, Ting KK, Adams S, Brew BJ, Chung R, Guillemin GJ:
මිනිසුන් තුළ NMDA ප්රතිග්රාහකවල ප්රකාශනයේ ලක්ෂණ
තාරකා සෛල. PLoS One 2010, 5:e14123.
185. Myint AM, Kim YK, Verkerk R, Scharpe S, Steinbusch H, Leonard B:
ප්රධාන අවපාතයේ කිනුරේනින් මාර්ගය: ආබාධිත බවට සාක්ෂි
ස්නායු ආරක්ෂණය. J Affect Disord 2007, 98:143-151.
186. Sanacora G, Treccani G, Popoli M: ග්ලූටමේට් කල්පිතයක් කරා
මානසික අවපීඩනය: ස්නායු මනෝ ඖෂධවේදයේ නැගී එන මායිම
මානසික ආබාධ. ස්නායු ඖෂධවේදය 2012, 62:63-77.
187. Saleh A, Schroeter M, Jonkmanns C, Hartung HP, Modder U, Jander S: In
මානව ඉස්කිමික් ආඝාතයේ මොළයේ දැවිල්ල පිළිබඳ vivo MRI. මොළය 2004,
127:1670-1677.
188. Tilleux S, Hermans E: ස්නායු ප්රදාහය සහ ග්ලියල් ග්ලූටමේට් නියාමනය
ස්නායු ආබාධ ඇතිවීම. J Neurosci Res 2007, 85:2059-2070.
189. Helms HC, Madelung R, Waagepetersen HS, Nielsen CU, Brodin B: In vitro
මොළයේ ග්ලූටමේට් ගලා යන උපකල්පනය සඳහා සාක්ෂි: මොළයේ එන්ඩොතලියල්
ඇස්ට්රොසයිට් සමඟ සංස්කෘත වූ සෛල ධ්රැවීකරණය වූ මොළයෙන් රුධිරය පෙන්වයි
ග්ලූටමේට් ප්රවාහනය. 2012, 60:882-893.
190. ලෙනාඩ් බීඊ: මානසික අවපීඩනය යන සංකල්පය ප්රතිශක්තිකරණයේ අක්රියතාවයක් ලෙස
පද්ධති. Curr Immunol Rev 2010, 6:205-212.
191. Labrie V, Wong AH, Roder JC: D-serine මාවතේ දායකත්වය
භින්නෝන්මාදය. ස්නායු ඖෂධවේදය 2012, 62:1484-1503.
192. Gras G, Samah B, Hubert A, Leone C, Porcheray F, Rimaniol AC: EAAT
macrophages සහ microglia මගින් ප්රකාශනය: තවමත් වඩා ප්රශ්න වඩා
පිළිතුරු. ඇමයිනෝ අම්ල 2012, 42:221-229.
193. Livingstone PD, Dickinson JA, Srinivasan J, Kew JN, Wonnacott S:
මී ප්රෙෆ්රන්ටල් බාහිකයේ ඇති Glutamate-dopamine crosstalk Alpha7 nicotinic receptors මගින් මොඩියුලේට් කර PNU-120596 මගින් බලගතු වේ. ජේ මෝල්
Neurosci 2010, 40:172-176.194. Kondziella D, Brenner E, Eyjolfsson EM, Sonnewald U: glialneuronal කරන්නේ කෙසේද?
අන්තර්ක්රියා වත්මන් ස්නායු සම්ප්රේෂක උපකල්පනවලට ගැලපේ
භින්නෝන්මාදය? Neurochem Int 2007, 50:291-301.
195. Wu HQ, Pereira EF, Bruno JP, Pellicciari R, Albuquerque EX, Schwarcz R: The
තාරකා සෛල ව්යුත්පන්න ඇල්ෆා 7 නිකොටිනික් ප්රතිග්රාහක ප්රතිවිරෝධක කිනුරනික් අම්ලය
පූර්ව ඉදිරිපස බාහිකයේ බාහිර සෛල ග්ලූටමේට් මට්ටම පාලනය කරයි. ජේ මෝල්
Neurosci 2010, 40:204-210.
196. Steiner J, Bogerts B, Schroeter ML, Bernstein HG: S100B ප්රෝටීන්
ස්නායු විකෘතිතා ආබාධ. Clin Chem Lab Med 2011, 49:409-424.
197. Steiner J, Marquardt N, Pauls I, Schiltz K, Rahmoune H, Bahn S, Bogerts B,
Schmidt RE, Jacobs R: Human CD8(+) T සෛල සහ NK සෛල ප්රකාශනය සහ
උත්තේජනය මත S100B ස්රාවය කරයි. Brain Behav Immun 2011, 25:1233-1241.
198. ෂන්මුගම් එන්, කිම් වයිඑස්, ලැන්ටින් එල්, නටරාජන් ආර්: නියාමනය
cyclooxygenase-2 ප්රතිග්රාහකයේ බන්ධනය මගින් මොනොසයිට් වල ප්රකාශනය
උසස් ග්ලයිකේෂන් අවසන් නිෂ්පාදන සඳහා. J Biol Chem 2003, 278:34834–34844.
199. Rothermundt M, Ohrmann P, Abel S, Siegmund A, Pedersen A, Ponath G,
Suslow T, Peters M, Kaestner F, Heindel W, Arolt V, Pfleiderer B: Glial cell
මගින් පෙන්නුම් කරන භින්නෝන්මාදයෙන් පෙළෙන රෝගීන්ගේ උප කාණ්ඩයක සක්රීය කිරීම
S100B සෙරුමය සාන්ද්රණය වැඩි කිරීම සහ මයෝ-ඉනොසිටෝල් ඉහළ නැංවීම.
Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:361-364.
200. Falcon T, Fazio V, Lee C, Simon B, Franco K, Marchi N, Janigro D: Serum
S100B: නව යොවුන් වියේ සියදිවි නසාගැනීම් සඳහා විභව ජෛව සලකුණක්? PLoS One
2010, 5:e11089.
201. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Serum
ප්රධාන අවපාතයේ දී රෝග-විශේෂිත ග්ලියල් ව්යාධි විද්යාව සඳහා සලකුණු සහාය දක්වයි.
J Affect Disord 2008, 111:271-280.
202. Rothermundt M, Ahn JN, Jorgens S: S100B in schizophrenia: යාවත්කාලීන කිරීමකි.
Gen Physiol Biophys 2009, 28 Spec No Focus:F76-F81.
203. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Neuronspecific
enolase වෙනස් නොවන අතර S100B සෙරුමය තුළ වැඩි වේ
භින්නෝන්මාදය මුල් පර්යේෂණ සහ මෙටා විශ්ලේෂණය සහිත රෝගීන්.
මනෝචිකිත්සා Res 2009, 167:66-72.
204. Rothermundt M, Missler U, Arolt V, Peters M, Leadbeater J, Wiesmann M,
Rudolf S, Wandinger KP, Kirchner H: S100B රුධිර මට්ටම් වැඩි වීම
බෙහෙත් නොගත් සහ ප්රතිකාර කරන භින්නෝන්මාද රෝගීන් සහසම්බන්ධ වේ
සෘණ රෝග ලක්ෂණ. Mol මනෝචිකිත්සාව 2001, 6:445-449.
205. Suchankova P, Klang J, Cavanna C, Holm G, Nilsson S, Jonsson EG, Ekman A:
RAGE ජානයේ ඇති Gly82Ser බහුරූපතාව අදාළද?
භින්නෝන්මාදය සහ පුද්ගල ලක්ෂණ මනෝවිද්යාව? J මනෝචිකිත්සා ස්නායු විද්යාව
2012, 37:122-128.
206. Scapagnini G, Davinelli S, Drago F, De Lorenzo A, Oriani G: ප්රතිඔක්සිකාරක
විෂාදනාශක: සත්ය හෝ ප්රබන්ධ? CNS ඖෂධ 2012, 26:477-490.
207. Ng F, Berk M, Dean O, Bush AI: මානසික ආබාධවල ඔක්සිකාරක ආතතිය:
සාක්ෂි පදනම සහ චිකිත්සක ඇඟවුම්. Int J Neuropsychopharmacol
2008, 11:851-876.
208. Salim S, Chugh G, Asghar M: කාංසාව තුළ දැවිල්ල. Adv ප්රෝටීන රසායනය
Struct Biol 2012, 88:1-25.
209. Anderson G, Berk M, Dodd S, Bechter K, Altamura AC, Dell'osso B, Kanba S,
Monji A, Fatemi SH, Buckley P, Debnath M, Das UN, Meyer U, M'ller N,
කාංචනාටවන් බී, මේස් එම්: ප්රතිශක්තිකරණ-ගිනි අවුලුවන, ඔක්සිකාරක සහ නයිට්රොසිටිව්
ආතතිය, සහ හේතු විද්යාව, පාඨමාලාව සහ ප්රතිකාරය තුළ ස්නායු ප්රගතිශීලී මාර්ග
භින්නෝන්මාදය. Prog Neuropsychopharmacol Biol Psychiatry 2013, 42:1-42.
210. Coughlin JM, Ishizuka K, Kano SI, Edwards JA, Seifuddin FT, Shimano MA,
Daley EL, et al: ද්රාව්ය සුපර් ඔක්සයිඩ් ඩිස්මියුටේස්-1 හි සලකුණු අඩු කිරීම
(SOD1) මෑත ආරම්භය ඇති රෝගීන්ගේ මස්තිෂ්ක තරලයේ
භින්නෝන්මාදය. Mol මනෝචිකිත්සාව 2012, 18:10-11.
211. Bombaci M, Grifantini R, Mora M, Reguzzi V, Petracca R, Meoni E, Balloni S,
Zingaretti C, Falugi F, Manetti AG, Margarit I, Musser JM, Cardona F, Orefici
G, Grandi G, Bensi G: ටික් රෝගී සේරා වල ප්රෝටීන් අරා පැතිකඩ හෙළි කරයි
A කාණ්ඩයට එරෙහිව පුළුල් පරාසයක සහ වැඩි දියුණු කළ ප්රතිශක්තිකරණ ප්රතිචාරය
Streptococcus ප්රතිදේහජනක. PLoS One 2009, 4:e6332.
212. Valerio A, Cardile A, Cozzi V, Bracale R, Tedesco L, Pisconti A, Palomba L,
Cantoni O, Clementi E, Moncada S, Carruba MO, Nisoli E: TNF-alpha
eNOS ප්රකාශනය සහ මේදයේ මයිටොකොන්ඩ්රිය ජීව උත්පාදනය අඩු කරයි
සහ තරබාරු මීයන්ගේ මාංශ පේශී. J Clin Invest 2006, 116:2791-2798.
213. Ott M, Gogvadze V, Orrenius S, Zhivotovsky B: මයිටොකොන්ඩ්රියා, ඔක්සිකාරක
ආතතිය සහ සෛල මිය යාම. ඇපොප්ටෝසිස් 2007, 12:913-922.
214. ෂලෙව් එච්, සර්ලින් වයි, ෆ්රීඩ්මන් ඒ: රුධිර මොළයේ බාධකය දොරටුවක් ලෙස බිඳ දැමීම
මානසික ආබාධයකට. Cardiovasc Psychiatry Neurol 2009, 2009:278531.
215. Abbott NJ, Ronnback L, Hansson E: Astrocyte-endothelial අන්තර්ක්රියා
රුධිර මොළයේ බාධකය. Nat Rev Neurosci 2006, 7:41-53.
216. Bechter K, Reiber H, Herzog S, Fuchs D, Tumani H, Maxeiner HG:
බලපෑමට ලක්වන සහ භින්නෝන්මාද වර්ණාවලියේ මස්තිෂ්ක තරල විශ්ලේෂණය
ආබාධ: ප්රතිශක්තිකරණ ප්රතිචාර සහිත උප කණ්ඩායම් හඳුනා ගැනීම සහ
රුධිර-CSF බාධක අක්රිය වීම. J Psychiatr Res 2010, 44:321-330.
217. Harris LW, Wayland M, Lan M, Ryan M, Giger T, Lockstone H, Wuethrich I,
Mimmack M, Wang L, Kotter M, Craddock R, Bahn S: මස්තිෂ්කය
භින්නෝන්මාදයේ ක්ෂුද්ර රුධිර වාහිනී: ලේසර් ග්රහණ ක්ෂුද්ර විච්ඡේදක අධ්යයනයක්.
PLoS One 2008, 3:e3964.
218. Lin JJ, Mula M, Hermann BP: ස්නායු හැසිරීම් අනාවරණය කිරීම
ජීවිත කාලය පුරාවටම අපස්මාරයේ රෝගාබාධ. Lancet 2012, 380:1180-1192.
219. Isingrini E, Belzung C, Freslon JL, Machet MC, Camus V: Fluoxetine බලපෑම
අනපේක්ෂිත ලෙස aortic නයිට්රික් ඔක්සයිඩ් මත යැපෙන vasorelaxation
මීයන් තුළ මානසික අවපීඩනයේ නිදන්ගත මෘදු ආතති ආකෘතිය. Psychosom Med 2012,
74:63-72.
220. Zhang XY, Zhou DF, Cao LY, Zhang PY, Wu GY, Shen YC: බලපෑම
භින්නෝන්මාදයෙහි සුපර් ඔක්සයිඩ් ඩිස්මියුටේස් මත රිස්පෙරිඩෝන් ප්රතිකාරය. ජේ ක්ලින්
Psychopharmacol 2003, 23:128-131.
221. Lavoie KL, Pelletier R, Arsenault A, Dupuis J, Bacon SL: සංගමය අතර
සායනික අවපීඩනය සහ අන්තරාසර්ග ක්රියාකාරිත්වය මනිනු ලබන්නේ නළලෙනි
hyperemic ප්රතික්රියාශීලීත්වය. Psychosom Med 2010, 72:20-26.
222. Chrapko W, Jurasz P, Radomski MW, Archer SL, Newman SC, Baker G, Lara N,
Le Melledo JM: අඩු වූ ප්ලාස්මා NO පරිවෘත්තීය වෙනස් කිරීම සහ
මානසික අවපීඩනයෙන් පෙළෙන රෝගීන් තුළ පැරොක්සෙටීන් මගින් පට්ටිකා NO සින්තේස් ක්රියාකාරිත්වය.
Neuropsychopharmacology 2006, 31:1286–1293.
223. Chrapko WE, Jurasz P, Radomski MW, Lara N, Archer SL, Le Melledo JM:
පට්ටිකා නයිට්රික් ඔක්සයිඩ් සින්තේස් ක්රියාකාරිත්වය සහ ප්ලාස්මා නයිට්රික් ඔක්සයිඩ් අඩු වීම
ප්රධාන මානසික අවපීඩනය තුළ පරිවෘත්තීය. Biol Psychiatry 2004, 56:129-134.
224. Stuehr DJ, Santolini J, Wang ZQ, Wei CC, Adak S: යාන්ත්රණය පිළිබඳ යාවත්කාලීන කිරීම
සහ NO සින්තේස් වල උත්ප්රේරක නියාමනය. J Biol Chem 2004,
279:36167-36170.
225. Chen W, Druhan LJ, Chen CA, Hemann C, Chen YR, Berka V, Tsai AL, Zweier
JL: පෙරොක්සිනයිට්රයිට් ටෙට්රාහයිඩ්රොබියොප්ටෙරින් විනාශ කිරීමට හේතු වේ
එන්ඩොතලියල් නයිට්රික් ඔක්සයිඩ් සින්තේස් හි හීම්: ප්රතිවර්ත කළ හැකි සිට සංක්රමණය
ආපසු හැරවිය නොහැකි එන්සයිම නිෂේධනය. ජෛව රසායනය 2010, 49:3129-3137.
226. චෙන් සීඒ, වැන්ග් ටීවයි, වර්ධරාජ් එස්, රෙයස් එල්ඒ, හේමන් සී, තලුක්ඩර් එම්ඒ, චෙන්
YR, Druhan LJ, Zweier JL: S-glutathionylation uncouples eNOS සහ
එහි සෛලීය හා සනාල ක්රියාකාරිත්වය නියාමනය කරයි. නේචර් 2010, 468:1115-1118.
227. Szabo C, Ischiropoulos H, Radi R: Peroxynitrite: ජෛව රසායනය,
ව්යාධි විද්යාව සහ චිකිත්සක සංවර්ධනය. Nat Rev Drug Discov
2007, 6:662-680.
228. Papakostas GI, Shelton RC, Zajecka JM, Etemad B, Rickels K, Clain A, Baer L,
Dalton ED, Sacco GR, Schoenfeld D, Pencina M, Meisner A, Bottiglieri T,
Nelson E, Mischoulon D, Alpert JE, Barbee JG, Zisook S, Fava M: Lmethylfolate
SSRI-ප්රතිරෝධී ප්රධාන මානසික අවපීඩනය සඳහා අතිරේක ප්රතිකාරයක් ලෙස:
සසම්භාවී, ද්විත්ව අන්ධ, සමාන්තර අනුක්රමික අත්හදා බැලීම් දෙකක ප්රතිඵල. ඇම් ජේ
මනෝචිකිත්සාව 2012, 169:1267-1274.
229. Antoniades C, Shirodaria C, Warrick N, Cai S, de Bono J, Lee J, Leeson P,
නියුබවර් එස්, රත්නතුංග සී, පිල්ලේ ආර්, රෙෆ්සම් එච්, චැනන් කේඑම්: 5-
මෙතිල්ටෙට්රාහයිඩ්රොෆොලේට් එන්ඩොතලියම් ක්රියාකාරිත්වය ඉක්මනින් වැඩි දියුණු කරයි
මිනිස් යාත්රා වල සුපර් ඔක්සයිඩ් නිෂ්පාදනය අඩු කරයි: සනාල මත බලපෑම්
ටෙට්රාහයිඩ්රොබයොප්ටෙරින් ලබා ගැනීමේ හැකියාව සහ එන්ඩොතලියල් නයිට්රික් ඔක්සයිඩ් සංස්ලේෂණය
සම්බන්ධ කිරීම. සංසරණය 2006, 114:1193-1201.
230. මසනෝ ටී, කවාෂිමා එස්, ටෝ ආර්, සතොමි-කොබයාෂි එස්, ෂිනොහාරා එම්, ටකායා ටී,
Sasaki N, Takeda M, Tawa H, Yamashita T, Yokoyama M, Hirata K: ප්රයෝජනවත්
වම් කශේරුකා ප්රතිනිර්මාණයට බාහිර ටෙට්රාහයිඩ්රොබියොප්ටෙරින් වල බලපෑම
මීයන් තුළ හෘදයාබාධයකින් පසු: ඔක්සිකාරක ආතතියේ විය හැකි භූමිකාව
සම්බන්ධ නොවූ එන්ඩොතලියල් නයිට්රික් ඔක්සයිඩ් සින්තේස් නිසා ඇතිවේ. Circ J 2008,
72:1512-1519.
231. Alp NJ, Channon KM: එන්ඩොතලියල් නයිට්රික් ඔක්සයිඩ් සංස්ලේෂණය නියාමනය කිරීම
සනාල රෝග tetrahydrobiopterin. Arterioscler Thromb Vasc Biol 2004,
24:413-420.
232. Szymanski S, Ashtari M, Zito J, Degreef G, Bogerts B, Lieberman J:
Gadolinium-DTPA වැඩිදියුණු කරන ලද අනුක්රමණය echo චුම්භක අනුනාද ස්කෑන්
මානසික රෝග සහ නිදන්ගත භින්නෝන්මාද රෝගීන්ගේ පළමු කථාංගය.
මනෝචිකිත්සා Res 1991, 40:203-207.
233. බට්ලර් ටී, වෙයිෂෝල්ට්ස් ඩී, ඉසෙන්බර්ග් එන්, හාඩින් ඊ, එප්ස්ටයින් ජේ, ස්ටර්න් ඊ, සිල්බර්ස්වීග්
D: භින්නෝන්මාදයේ ඉදිරිපස-ලිම්බික් අක්රියතාවයේ ස්නායු ප්රතිරූපණය සහ
අපස්මාරය ආශ්රිත මනෝ ව්යාධිය: අභිසාරී ස්නායු ජීව විද්යාව දෙසට.
අපස්මාර හැසිරීම 2012, 23:113-122.234. බට්ලර් ටී, මාඕස් ඒ, වල්ලභජෝසුලා එස්, මොලර් ජේ, ඉචිස් එම්, පරේෂ් කේ, පර්වේස් එෆ්,
ෆ්රීඩ්මන් ඩී, ගෝල්ඩ්ස්මිත් එස්, නජ්ජර් එස්, ඔස්බෝන් ජේ, සෝල්ස් එල්, වැන්ග් එක්ස්, ප්රංශ ජේ,
Thisen T, Devinsky O, Kuzniecky R, Stern E, Silbersweig D: Imaging
ප්රතිදේහ සමඟ සම්බන්ධ අපස්මාරය සහිත රෝගියෙකුගේ දැවිල්ල
ග්ලූටමික් අම්ලය decarboxylase [වියුක්ත]. ඇම් අපස්මාර සමාජයේ සාරාංශ,
වෙළුම 2. Baltimore: American Epilepsy Society; 2011:191.
235. van Berckel BN, Bossong MG, Boellaard R, Kloet R, Schuitemaker A, Caspers
E, Luurtsema G, Windhorst AD, Cahn W, Lammertsma AA, Kahn RS:
මෑත-ආරම්භක භින්නෝන්මාදය තුළ මයික්රොග්ලියා සක්රීය කිරීම: ප්රමාණාත්මක (R)-
[11C]PK11195 පොසිට්රෝන විමෝචන ටොමොග්රැෆි අධ්යයනය. ජීව මනෝචිකිත්සාව 2008,
64:820-822.
236. Doorduin J, de Vries EF, Willemsen AT, de Groot JC, Dierckx RA, Klein HC:
භින්නෝන්මාදය ආශ්රිත මනෝ ව්යාධියේ ස්නායු ප්රදාහය: PET අධ්යයනයක්.
J Nucl Med 2009, 50:1801-1807.
237. Takano A, Arakawa R, Ito H, Tateno A, Takahashi H, Matsumoto R, Okubo Y,
සුහාරා ටී: නිදන්ගත රෝගීන්ගේ පර්යන්ත බෙන්සෝඩියසපයින් ප්රතිග්රාහක
භින්නෝන්මාදය: [11C]DAA1106 සමඟ PET අධ්යයනයක්. ඉන්ට් ජේ
Neuropsychopharmacol 2010, 13:943-950.
238. M'ller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Muller B,
Spellmann I, Hetzel G, Maino K, Kleindienst N, M'ller HJ, Arolt V, Riedel M:
cyclooxygenase-2 inhibitor celecoxib හි චිකිත්සක බලපෑම් ඇත
ප්රධාන මානසික අවපීඩනය: ද්විත්ව අන්ධ, සසම්භාවී, ප්ලේසෙබෝ වල ප්රතිඵල
පාලනය, reboxetine කිරීමට ඇඩෝන නියමු අධ්යයනය. Mol මනෝචිකිත්සාව 2006,
11:680-684.
239. Akhondzadeh S, Jafari S, Raisi F, Nasehi AA, Ghoreishi A, Salehi B, MohebbiRasa
S, Raznahan M, Kamalipour A: අතිරේක සෙලෙකොක්සිබ් හි සායනික පරීක්ෂණය
විශාල මානසික අවපීඩනයෙන් පෙළෙන රෝගීන්ට ප්රතිකාර කිරීම: ද්විත්ව අන්ධ සහ
ප්ලේසෙබෝ පාලනය කළ අත්හදා බැලීම. මානසික අවපීඩනය 2009, 26:607-611.
240. Mendlewicz J, Kriwin P, Oswald P, Souery D, Alboni S, Brunello N:
භාවිතා කරන ප්රධාන මානසික අවපීඩනයකදී විෂාදනාශකවල ක්රියාකාරිත්වයේ කෙටි ආරම්භය
ඇසිටිල්සාලිසිලික් අම්ලය වැඩි කිරීම: නියමු විවෘත ලේබල් අධ්යයනයක්. ඉන්ට් ක්ලින්
Psychopharmacol 2006, 21:227-231.
241. Uher R, Carver S, Power RA, Mors O, Maier W, Rietschel M, Hauser J,
Dernovsek MZ, Henigsberg N, Souery D, Placentino A, Farmer A, McGuffin P:
ස්ටෙරොයිඩ් නොවන ප්රති-ගිනි අවුලුවන ඖෂධ සහ විෂාදනාශකවල කාර්යක්ෂමතාව
ප්රධාන මානසික අවපීඩන ආබාධය. Psychol Med 2012, 42:2027-2035.
242. M'ller N, Riedel M, Scheppach C, Brandstatter B, Sokullu S, Krampe K,
Ulmschneider M, Engel RR, Moller HJ, Schwarz MJ: ප්රයෝජනවත් ප්රති-සයිකෝටික්
රිස්පෙරිඩෝන් වලට පමණක් සාපේක්ෂව සෙලෙකොක්සිබ් ඇඩෝන ප්රතිකාරයේ බලපෑම්
භින්නෝන්මාදය. Am J මනෝචිකිත්සාව 2002, 159:1029-1034.
243. M'ller N, Riedel M, Schwarz MJ, Engel RR: COX-2 හි සායනික බලපෑම්
භින්නෝන්මාදය තුළ සංජානනය පිළිබඳ නිෂේධක. Eur Arch Psychiatry Clin Neurosci
2005, 255:149-151.
244. M'ller N, Krause D, Dehning S, Musil R, Schennach-Wolff R, Obermeier M,
Moller HJ, Klauss V, Schwarz MJ, Riedel M: Celecoxib ප්රතිකාරය ඉක්මනින්
භින්නෝන්මාදයේ අදියර: සසම්භාවී, ද්විත්ව අන්ධ, ප්ලේසෙබෝ පාලනයක ප්රතිඵල
ඇමයිසල්ප්රයිඩ් ප්රතිකාරයේ සෙලෙකොක්සිබ් වැඩි කිරීමේ අත්හදා බැලීම.
Schizophr Res 2010, 121:118-124.
245. Sayyah M, Boostani H, Pakseresht S, Malayeri A: මූලික අහඹු
ද්වි-අන්ධ සායනික අත්හදා බැලීමේ අතිරේකයක් ලෙස celecoxib හි කාර්යක්ෂමතාවය
උමතු-සම්පීඩන ආබාධ සඳහා ප්රතිකාර කිරීම. මනෝචිකිත්සා Res 2011,
189:403-406.
246. Sublette ME, Ellis SP, Geant AL, Mann JJ: බලපෑම් පිළිබඳ මෙටා විශ්ලේෂණය
මානසික අවපීඩනයේ සායනික පරීක්ෂණ වලදී eicosapentaenoic අම්ලය (EPA). ජේ ක්ලින්
මනෝචිකිත්සාව 2011, 72:1577-1584.
247. Bloch MH, Hannestad J: ප්රතිකාර සඳහා ඔමේගා-3 මේද අම්ල
මානසික අවපීඩනය: ක්රමානුකූල සමාලෝචනය සහ මෙටා විශ්ලේෂණය. Mol මනෝචිකිත්සාව 2012,
17:1272-1282.
248. Keller WR, Kum LM, Wehring HJ, Koola MM, Buchanan RW, Kelly DL: A
භින්නෝන්මාදයේ රෝග ලක්ෂණ සඳහා ප්රති-ගිනි අවුලුවන නියෝජිතයන් පිළිබඳ සමාලෝචනය.
J Psychopharmacol.
249. Warner-Schmidt JL, Vanover KE, Chen EY, Marshall JJ, Greengard P:
තෝරාගත් serotonin reuptake inhibitors (SSRIs) හි විෂාදනාශක බලපෑම්
මීයන් සහ මිනිසුන් තුළ ප්රති-ගිනි අවුලුවන ඖෂධ මගින් දුර්වල වේ. Proc Natl
Acad Sci USA 2011, 108:9262-9267.
250. Gallagher PJ, Castro V, Fava M, Weilburg JB, Murphy SN, Gainer VS, චර්චිල්
SE, Kohane IS, Iosifescu DV, Smoller JW, Perlis RH: විෂාදනාශක ප්රතිචාරය
NSAID වලට නිරාවරණය වන විශාල මානසික අවපීඩනයෙන් පෙළෙන රෝගීන්: a
ඖෂධ නිරීක්ෂණ අධ්යයනය. Am J මනෝචිකිත්සාව 2012, 169:1065-1072.
251. ෂෙල්ටන් ආර්සී: එන්එස්ඒඅයිඩී එකවර භාවිතා කිරීම එහි කාර්යක්ෂමතාව අඩු කරයිද?
විෂාදනාශක? Am J මනෝචිකිත්සාව 2012, 169:1012-1015.
252. Martinez-Gras I, Perez-Nievas BG, Garcia-Bueno B, Madrigal JL, AndresEsteban
E, Rodriguez-Jimenez R, Hoenicka J, Palomo T, Rubio G, Leza JC:
ප්රති-ගිනි අවුලුවන prostaglandin 15d-PGJ2 සහ එහි න්යෂ්ටික ප්රතිග්රාහක
භින්නෝන්මාදය තුළ PPARgamma අඩු වේ. Schizophr Res 2011,
128:15-22.
253. Garcia-Bueno B, Perez-Nievas BG, Leza JC: න්යෂ්ටික කාර්යභාරයක් තිබේද?
ස්නායු මනෝචිකිත්සක රෝග වල ප්රතිග්රාහක PPARgamma? ඉන්ට් ජේ
Neuropsychopharmacol 2010, 13:1411-1429.
254. Meyer U: භින්නෝන්මාදයෙහි ප්රති-ගිනි අවුලුවන සංඥා. මොළයේ හැසිරීම
Immun 2011, 25:1507-1518.
255. රමර් ආර්, හයින්මන් කේ, මර්කෝඩ් ජේ, රොඩ් එච්, සලමන් ඒ, ලිනබචර් එම්,
Hinz B: COX-2 සහ PPAR-gamma cannabidiol-induced apoptosis ලබා දෙයි
මානව පෙනහළු පිළිකා සෛල. Mol Cancer Ther 2013, 12:69-82.
256. හෙන්රි CJ, Huang Y, Wynne A, Hanke M, Himler J, Bailey MT, Sheridan JF,
Godbout JP: Minocycline ලිපොපොලිසැකරයිඩ (LPS) ප්රේරණය කරයි
ස්නායු ආසාධනය, අසනීප හැසිරීම් සහ ඇනෙඩෝනියාව.
J Neuroinflammation 2008, 5:15.
257. Sarris J, Mischoulon D, Schweitzer I: Bipolar disorder සඳහා Omega-3: metaanalyses
උමතුව සහ බයිපෝල අවපීඩනය සඳහා භාවිතා වේ. ජේ ක්ලින් මනෝචිකිත්සාව 2012,
73:81-86.
258. Amminger GP, Schafer MR, Papageorgiou K, Klier CM, Cotton SM, Harrigan
SM, Mackinnon A, McGorry PD, Berger GE: දිගු දාම ඔමේගා-3 මේද අම්ල
මනෝචිකිත්සක ආබාධ පෙන්නුම් කරන ලද වැළැක්වීම සඳහා: සසම්භාවී, ප්ලේසෙබෝ පාලනය
නඩු විභාගය. Arch Gen Psychiatry 2010, 67:146-154.
259. Fusar-Poli P, Berger G: Eicosapentaenoic අම්ලය මැදිහත්වීම්
භින්නෝන්මාදය: සසම්භාවී, ප්ලේසෙබෝ-පාලිත අධ්යයනයන්හි මෙටා විශ්ලේෂණය.
J Clin Psychopharmacol 2012, 32:179-185.
260. Zorumski CF, Paul SM, Izumi Y, Covey DF, Mennerick S: Neurosteroids,
ආතතිය සහ මානසික අවපීඩනය: විභව චිකිත්සක අවස්ථා.
Neurosci Biobehav Rev 2013, 37:109-122.
261. Uhde TW, Singareddy R: කාංසාව ආබාධ පිළිබඳ ජීව විද්යාත්මක පර්යේෂණ. තුළ
ස්නායු විද්යාව ලෙස මනෝචිකිත්සාව. සංස්කරණය කළේ Juan Jose LI, Wolfgang G, Mario M,
Norman S. Chichester: John Wiley & Sons, Ltd; 2002:237-286.
262. Gibson SA, Korado Z, Shelton RC: ඔක්සිකාරක ආතතිය සහ ග්ලූටතයෝන්
විශාල මානසික අවපීඩනයෙන් පෙළෙන පුද්ගලයන්ගෙන් පටක සංස්කෘතීන්හි ප්රතිචාරය.
J Psychiatr Res 2012, 46:1326-1332.
263. නෙරි FG, Monkul ES, Hatch JP, Fonseca M, Zunta-Soares GB, Frey BN,
Bowden CL, Soares JC: Celecoxib ප්රතිකාරයේ අතිරේකයක් ලෙස
බයිපෝල අක්රමිකතාවේ මානසික අවපීඩන හෝ මිශ්ර කථාංග: ද්විත්ව අන්ධ,
සසම්භාවී, ප්ලේසෙබෝ-පාලිත අධ්යයනය. 2008, 23:87-94.
264. ලෙවින් ජේ, කොලෙස්ටෝයි ඒ, සිමර්මන් ජේ: විය හැකි විෂාදනාශක බලපෑම
මිනොසයික්ලයින්. 1996, 153:582.
265. Levkovitz Y, Mendlovich S, Riwkes S, Braw Y, Levkovitch-Verbin H, Gal G,
Fennig S, Treves I, Kron S: ද්විත්ව අන්ධ, අහඹු අධ්යයනයක්
ඍණාත්මක සහ සංජානන රෝග ලක්ෂණ වලට ප්රතිකාර කිරීම සඳහා minocycline
මුල් අවධියේ භින්නෝන්මාදය. J Clin Psychiatry 2010, 71:138-149.
266. Miyaoka T, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
රෝගීන් තුළ මයිනොසයික්ලයින් හි ඇති විය හැකි ප්රති-සයිකෝටික් බලපෑම
භින්නෝන්මාදය. Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:304-307.
267. Miyaoka J, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
භින්නෝන්මාදය සඳහා අතිරේක ප්රතිකාරයක් ලෙස Minocycline: විවෘත ලේබලයක්
අධ්යයනය. 2008, 31:287-292.
268. Rodriguez CI, Bender Jr, Marcus SM, Snape M, Rynn M, Simpson HB:
උමතු-සම්පීඩනය තුළ ඖෂධීය චිකිත්සාව මිනොසයික්ලයින් වැඩි කිරීම
ආබාධය: විවෘත ලේබල් අත්හදා බැලීමක්. 2010, 71:1247-1249.
doi:10.1186/1742-2094-10-43
මෙම ලිපිය උපුටා දක්වන්න: Najjar et al.: Neuroinflammation සහ psychiatric
අසනීපය. Neuroinflammation සඟරාව 2013 10:43.
Accordion වසා දමන්න
මෙහි ඇති තොරතුරු "ස්නායු ආසාධනය සහ මානසික රෝග"සුදුසුකම් ලත් සෞඛ්ය සේවා වෘත්තිකයෙකු හෝ බලපත්රලාභී වෛද්යවරයෙකු සමඟ එකින් එක සම්බන්ධයක් ප්රතිස්ථාපනය කිරීමට අදහස් නොකරන අතර එය වෛද්ය උපදෙස් නොවේ. ඔබගේ පර්යේෂණ සහ සුදුසුකම් ලත් සෞඛ්ය සේවා වෘත්තිකයෙකු සමඟ හවුල්කාරිත්වය මත පදනම්ව සෞඛ්ය ආරක්ෂණ තීරණ ගැනීමට අපි ඔබව දිරිමත් කරමු.
බ්ලොග් තොරතුරු සහ විෂය පථය සාකච්ඡා
අපගේ තොරතුරු විෂය පථය චිරොක්ට්රැක්ටික්, මස්කියුෙලොස්ෙකලටල්, භෞතික ඖෂධ, සුවතාවය, හේතු විද්යාත්මක දායකත්වයට සීමා වේ viscerosomatic කැළඹීම් සායනික ඉදිරිපත් කිරීම්, ආශ්රිත somatovisceral reflex clinical dynamics, subluxation complexes, සංවේදී සෞඛ්ය ගැටළු සහ/හෝ ක්රියාකාරී වෛද්ය ලිපි, මාතෘකා සහ සාකච්ඡා.
අපි ලබා දෙනවා සහ ඉදිරිපත් කරනවා සායනික සහයෝගීතාව විවිධ විෂයයන් වල විශේෂඥයින් සමඟ. සෑම විශේෂඥයෙක්ම පාලනය වන්නේ ඔවුන්ගේ වෘත්තීය පරිචය විෂය පථය සහ බලපත්ර ලබා දීමේ බල ප්රදේශය මගිනි. මාංශ පේශි පද්ධතියේ තුවාල හෝ ආබාධ සඳහා ප්රතිකාර කිරීමට සහ ප්රතිකාර කිරීමට අපි ක්රියාකාරී සෞඛ්ය සහ සුවතා ප්රොටෝකෝල භාවිතා කරමු.
අපගේ වීඩියෝ, පළ කිරීම්, මාතෘකා, විෂයයන් සහ තීක්ෂ්ණ බුද්ධිය සායනික කරුණු, ගැටළු සහ අපගේ සායනික ප්රායෝගික විෂය පථයට සම්බන්ධ සහ සෘජුව හෝ වක්රව සහාය දක්වන මාතෘකා ආවරණය කරයි.*
අපගේ කාර්යාලය උපකාරක උපුටා දැක්වීම් ලබා දීමට සාධාරණ ලෙස උත්සාහ කර ඇති අතර අපගේ තනතුරු සඳහා සහාය වන අදාළ පර්යේෂණ අධ්යයනය හෝ අධ්යයනයන් හඳුනාගෙන ඇත. නියාමන මණ්ඩල සහ මහජනයාගේ ඉල්ලීම පරිදි ආධාරක පර්යේෂණ අධ්යයනවල පිටපත් අපි ලබා දෙන්නෙමු.
විශේෂිත සත්කාර සැලැස්මක් හෝ ප්රතිකාර ප්රොටෝකෝලයක් සඳහා එය සහාය වන්නේ කෙසේද යන්න පිළිබඳ අතිරේක පැහැදිලි කිරීමක් අවශ්ය වන කරුණු අපි ආවරණය කරන බව අපි තේරුම් ගනිමු; එමනිසා, ඉහත විෂය පිළිබඳව වැඩිදුර සාකච්ඡා කිරීම සඳහා කරුණාකර විමසීමට නිදහස් වන්න ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස්, ඩී.සී, හෝ අප අමතන්න 915-850-0900.
අපි මෙහි සිටින්නේ ඔබට සහ ඔබේ පවුලේ අයට උදව් කිරීමටයි.
ආශීර්වාද
ආචාර්ය ඇලෙක්ස් ගිම්නෙස් ඩීසී, MSACP, RN*, CCST, අයිඑෆ්එම්සීපී*, සීඅයිඑෆ්එම්*, ATN*
විද්යුත් තැපෑල: coach@elpasofunctionalmedicine.com
චිරොක්ට්රැක්ටික් (ඩීසී) වෛද්යවරයකු ලෙස බලපත්ර ලබා ඇත ටෙක්සාස් & නිව් මෙක්සිකෝ*
ටෙක්සාස් ඩීසී බලපත්රය # TX5807, New Mexico DC බලපත්රය # NM-DC2182
ලියාපදිංචි හෙදියක් ලෙස බලපත්ර ලබා ඇත (RN*) in ෆ්ලොරිඩා
ෆ්ලොරිඩා බලපත්රය RN බලපත්රය # ආර්එන් 9617241 (පාලන අංකය. 3558029)
සංයුක්ත තත්ත්වය: බහු රාජ්ය බලපත්රය: තුළ පුහුණු වීමට අවසර ඇත 40 ජනපද*
ආචාර්ය ඇලෙක්ස් ජිමිනෙස් DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
මගේ ඩිජිටල් ව්යාපාරික කාඩ්පත