කීටෝන ශරීරවල බහු-මාන භූමිකාවන්
කීටෝන සිරුරු අක්මාව විසින් නිර්මාණය කරන අතර මිනිස් සිරුරේ ග්ලූකෝස් පහසුවෙන් ලබා ගත නොහැකි විට බලශක්ති ප්රභවයක් ලෙස භාවිතා කරයි. ප්රධාන කීටෝන දේහ දෙක වන්නේ ඇසිටොඇසිටේට් (AcAc) සහ 3-බීටා-හයිඩ්රොක්සිබියුටයිරේට් (3HB) වන අතර ඇසිටෝන් තුන්වන සහ අවම වශයෙන් බහුල කීටෝන ශරීරය වේ. කීටෝන සෑම විටම රුධිරයේ පවතින අතර නිරාහාරව සිටීමේදී සහ දිගු ව්යායාමයේදී ඒවායේ මට්ටම වැඩි වේකීටොජෙනිස් මේද අම්ල සහ කීටොජනික් ඇමයිනෝ අම්ල බිඳවැටීම හරහා ජීවීන් කීටෝන ශරීර නිපදවන ජෛව රසායනික ක්රියාවලියයි.
කීටෝන සිරුරු ප්රධාන වශයෙන් ජනනය වේ අක්මා සෛලවල මයිටොකොන්ඩ්රියා. කීටොජෙනසිස් සිදු වන්නේ රුධිරයේ අඩු ග්ලූකෝස් මට්ටමක් ඇති විට, විශේෂයෙන් ග්ලයිකෝජන් වැනි අනෙකුත් සෛලීය කාබෝහයිඩ්රේට් ගබඩා අවසන් වූ පසුවය. ඉන්සියුලින් ප්රමාණවත් ප්රමාණයක් නොමැති විට මෙම යාන්ත්රණය ද සිදුවිය හැක. කීටෝන ශරීර නිෂ්පාදනය අවසානයේ ආරම්භ වන්නේ මේද අම්ල ලෙස මිනිස් සිරුරේ ගබඩා කර ඇති ශක්තිය ලබා ගැනීමට ය. කීටොජෙනසිස් ස්වාධීනව නියාමනය වන මයිටොකොන්ඩ්රියාවේ සිදු වේ.
වියුක්ත
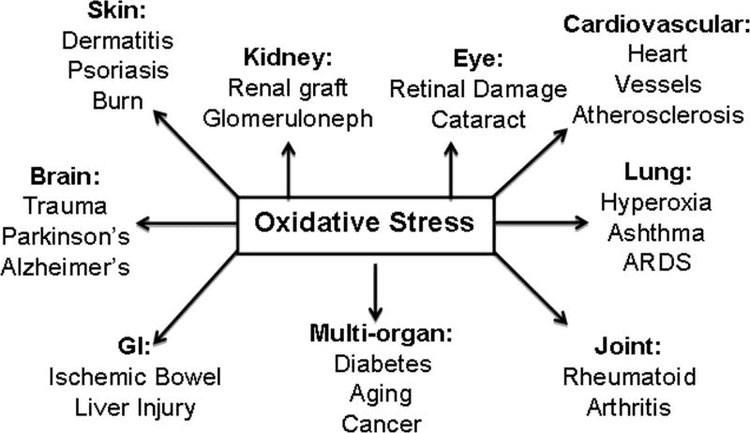
කීටෝන ශරීර පරිවෘත්තීය භෞතික විද්යාත්මක හෝමියස්ටැසිස් හි කේන්ද්රීය නෝඩයකි. මෙම සමාලෝචනයේදී, විවිධ පෝෂ්ය පදාර්ථවල ඉන්ද්රිය සහ ජීවීන්ගේ ක්රියාකාරිත්වය ප්රශස්ත කරන සහ බහු ඉන්ද්රිය පද්ධතිවල දැවිල්ල හා තුවාල වලින් ආරක්ෂා වන විවික්ත සියුම් සුසර කිරීමේ පරිවෘත්තීය භූමිකාවන් කීටෝන ඉටු කරන්නේ කෙසේදැයි අපි සාකච්ඡා කරමු. සාම්ප්රදායිකව කාබෝහයිඩ්රේට් සීමා කිරීම් සඳහා පමණක් ඇතුළත් කර ඇති පරිවෘත්තීය උපස්ථර ලෙස සැලකේ, මෑත නිරීක්ෂණ මගින් අවධාරණය කරන්නේ කීටෝන ශරීරවල වැදගත් පරිවෘත්තීය සහ කාබෝහයිඩ්රේට් බහුල වන විට සංඥා කරන මැදිහත්කරුවන් ලෙස වැදගත්කමයි. ස්නායු පද්ධතියේ රෝග සඳහා දන්නා ප්රතිකාර විකල්පයන් අනුපූරකයක් ලෙස, පිළිකා වල කීටෝන ශරීර සඳහා අනාගත භූමිකාවන් පැන නැගී ඇත, හෘදයේ සහ අක්මාවේ කුතුහලය දනවන ආරක්ෂිත භූමිකාවන් මෙන්ම තරබාරුකම හා සම්බන්ධ හා හෘද වාහිනී රෝග සඳහා ප්රතිකාර විකල්ප විවෘත කරයි. කීටෝන පරිවෘත්තීය හා සංඥා පිළිබඳ මතභේදයන් සමකාලීන නිරීක්ෂණ සමඟ සම්භාව්ය ප්රවාදය සමථයකට පත් කිරීමට සාකච්ඡා කෙරේ.
හැදින්වීම
කීටෝන සිරුරු යනු ජීවය, යුකාර්යා, බැක්ටීරියා සහ පුරාවිද්යාවේ සියලුම වසම් සඳහා අත්යවශ්ය විකල්ප පරිවෘත්තීය ඉන්ධන ප්රභවයකි (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). මිනිසුන්ගේ කීටෝන ශරීර පරිවෘත්තීය පෝෂක ඌනතාවයේ එපිසෝඩික් කාලවලදී මොළයට ඉන්ධන සැපයීම සඳහා උත්තෝලනය කර ඇත. කීටෝන සිරුරු ?-ඔක්සිකරණය (FAO), ට්රයිකාබොක්සිලික් අම්ල චක්රය (TCA), ග්ලූකෝනොජෙනිසිස්, ඩි නොවෝ ලිපොජෙනිසිස් (DNL) සහ ස්ටෙරෝල්වල ජෛව සංස්ලේෂණය වැනි තීරණාත්මක ක්ෂීරපායී පරිවෘත්තීය මාර්ග සමඟ බැඳී ඇත. ක්ෂීරපායීන් තුළ, කීටෝන සිරුරු FAO-ව්යුත්පන්න ඇසිටිල්-CoA වලින් අක්මාව තුළ ප්රධාන වශයෙන් නිපදවනු ලබන අතර, ඒවා අග්ර ඔක්සිකරණය සඳහා බාහිර පටක වෙත ප්රවාහනය කෙරේ. මෙම කායික විද්යාව මගින් විකල්ප ඉන්ධනයක් සපයන අතර එය මේද අම්ල ලබා ගැනීමේ හැකියාව වැඩි කරන අතර කාබෝහයිඩ්රේට් ලබා ගැනීමේ හැකියාව අඩු කරයි (Cahill GF Jr, 2006; McGarry and Foster, 1980; Robinson and Williamson, 1980). කීටෝන ශරීර ඔක්සිකරණය නිරාහාරව සිටීම, කුසගින්න, නව ජන්ම කාලය, පශ්චාත් ව්යායාම, ගැබ් ගැනීම සහ අඩු කාබෝහයිඩ්රේට් ආහාරවලට අනුගත වීම ඇතුළු භෞතික විද්යාත්මක තත්වයන් ගණනාවකින් බාහිර පටක තුළ සමස්ත ශක්ති ක්ෂීරපායී පරිවෘත්තීය සඳහා සැලකිය යුතු දායකත්වයක් සපයයි. නිරෝගී වැඩිහිටි මිනිසුන්ගේ සංසරණ සම්පූර්ණ කීටෝන ශරීර සාන්ද්රණය සාමාන්යයෙන් දළ වශයෙන් 100-250 µM අතර චක්ර දෝලනය පෙන්නුම් කරයි, දිගු ව්යායාමයකින් හෝ පැය 1 ක නිරාහාරයෙන් පසු ~24 mM දක්වා ඉහළ යයි, සහ දියවැඩියා දියවැඩියා වැනි ව්යාධි තත්ත්වයන් වලදී 20 mM දක්වා ඉහළ යා හැක. Cahill GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson and Williamson, 1980; Wildenhoff et al., 1974). මිනිස් අක්මාව දිනකට කීටෝන ශරීර ග්රෑම් 300 ක් දක්වා නිපදවයි (බාලස් සහ ෆෙරි, 1989), එය පෝෂණය, නිරාහාරව සහ කුසගින්නෙන් පෙළෙන ප්රාන්තවල මුළු බලශක්ති වියදමෙන් 5-20% අතර දායක වේ (Balasse et al., 1978; Cox et. අල්., 2016).
මෑත අධ්යයනයන් දැන් ක්ෂීරපායී සෛල පරිවෘත්තීය, හෝමියස්ටැසිස් සහ විවිධාකාර කායික හා ව්යාධිජනක තත්වයන් යටතේ සංඥා කිරීම සඳහා කීටෝන ශරීර සඳහා අනිවාර්ය භූමිකාවන් ඉස්මතු කරයි. මොළය, හෘදය හෝ අස්ථි මාංශ පේශි වැනි බාහිර පටක සඳහා බලශක්ති ඉන්ධන ලෙස සේවය කිරීමට අමතරව, කීටෝන සිරුරු සංඥා මැදිහත්කරුවන්, ප්රෝටීන පශ්චාත් පරිවර්තන වෙනස් කිරීමේ (PTM) ධාවකයන් සහ දැවිල්ල සහ ඔක්සිකාරක ආතතියේ මොඩියුලේටර් ලෙස ප්රධාන භූමිකාවන් ඉටු කරයි. මෙම සමාලෝචනයේදී, අපි කීටෝන ශරීරවල ප්ලෙයෝට්රොපික් භූමිකාවන් සහ ඒවායේ පරිවෘත්තීය පිළිබඳ සම්භාව්ය සහ නවීන දසුන් සපයන්නෙමු.
කීටෝන ශරීර පරිවෘත්තීය පිළිබඳ දළ විශ්ලේෂණය
රක්තපාත කීටොජෙනසිස් අනුපාතය පාලනය කරනු ලබන්නේ මේදයේ කායික හා ජෛව රසායනික පරිවර්තන මාලාවක් මගිනි. ප්රාථමික නියාමකයින්ට ට්රයිසයිල්ග්ලිසරෝල් වලින් මේද අම්ල lipolysis, හෙපටෝසයිට් ප්ලාස්මා පටලයට ප්රවාහනය කිරීම, carnitine palmitoyltransferase 1 (CPT1), ?-ඔක්සිකරණ සර්පිලාකාරය, TCA චක්රීය ක්රියාකාරකම් සහ අතරමැදි විභව සාන්ද්රණය සහ redhorox විභව සාන්ද්රණයන්, hepatocyte ප්ලාස්මා පටලය හරහා මයිටොකොන්ඩ්රියාවට ප්රවාහනය කිරීම ඇතුළත් වේ. මෙම ක්රියාවලීන්ගෙන්, ප්රධාන වශයෙන් ග්ලූකොජන් සහ ඉන්සියුලින් [සමාලෝචනය කරන ලදී (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; ෆොස්ටර් , 1980; Williamson et al., 1969)]. සම්භාව්ය වශයෙන් කීටොජෙනසිස් යනු පිටාර ගැලීමේ මාර්ගයක් ලෙස සැලකේ, එහි ?-ඔක්සිකරණයෙන් ව්යුත්පන්න වූ ඇසිටිල්-CoA සයිටේ්රට් සින්තේස් ක්රියාකාරකම් සහ/හෝ සයිටේ්රට් සෑදීම සඳහා ඝනීභවනය සඳහා ඇති ඔක්සලෝඇසිටේට් ප්රමාණය ඉක්මවයි. ත්රි-කාබන් අතරමැදි ප්රති-කීටොජනික් ක්රියාකාරකම් ප්රදර්ශනය කරයි, අනුමාන වශයෙන් ඇසිටිල්-කෝඒ පරිභෝජනය සඳහා ඔක්සලෝඇසිටේට් සංචිතය පුළුල් කිරීමට ඇති හැකියාව නිසා විය හැකිය, නමුත් හෙපටික ඇසිටිල්-කෝඒ සාන්ද්රණය පමණක් කීටොජනික් අනුපාතය තීරණය නොකරයි (ෆෝස්ටර්, 1967; රාවට් සහ මෙනහන්, 1975; et al., 1969). හෝර්මෝන, පිටපත් කිරීමේ සහ පශ්චාත් පරිවර්තන සිදුවීම් මගින් කීටොජෙනසිස් නියාමනය කිරීම එක්ව කීටොජනික් අනුපාතය සියුම් ලෙස සකස් කරන අණුක යාන්ත්රණයන් අසම්පූර්ණව අවබෝධ කර ගනී යන අදහසට සහාය වේ (HMGCS2 සහ SCOT/OXCT1 නියාමනය බලන්න).
කීටොජෙනසිස් මූලික වශයෙන් සිදුවන්නේ රක්තපාත මයිටොකොන්ඩ්රියල් අනුකෘතියේ සම්පූර්ණ මේද ඔක්සිකරණයට සමානුපාතික වේ. මයිටොකොන්ඩ්රියල් පටල හරහා ඇසිල් දාම ප්රවාහනය කිරීමෙන් සහ ?-ඔක්සිකරණයෙන් පසුව, 3-hydroxymethylglutaryl-CoA synthase (HMGCS2) හි මයිටොකොන්ඩ්රියල් සමස්ථානිකය, acetoacetyl-CoA (AcAc-CoA-ජනනය කිරීමට HAcAc-CoA) ඝනීභවනය කරන ඉරණම උත්ප්රේරණය කරයි. (රූපය 1A). HMG-CoA lyase (HMGCL) acetyl-CoA සහ acetoacetate (AcAc) නිදහස් කිරීම සඳහා HMG-CoA ඛණ්ඩනය කරයි, සහ ෆොස්ෆටයිඩයිල්කොලීන් මත යැපෙන මයිටොකොන්ඩ්රියල් d-Oase මගින් d-?-hydroxybutyrate (d-?OHB) දක්වා අඩු වේ. BDH1) NAD+/NADH-කපල්ඩ් ආසන්න සමතුලිත ප්රතික්රියාවක (Bock and Fleischer, 1975; LEHNINGER et al., 1960). BDH1 සමතුලිතතා නියතය d-?OHB නිෂ්පාදනයට අනුග්රහය දක්වයි, නමුත් AcAc/d-?OHB කීටෝන සිරුරුවල අනුපාතය මයිටොකොන්ඩ්රියල් NAD+/NADH අනුපාතයට සෘජුව සමානුපාතික වේ, එබැවින් BDH1 ඔක්සිඩෝඩෙක්ටේස් ක්රියාකාරකම් මයිටොකොන්ඩ්රියල් රෙඩොක්ස් විභවය මොඩියුලේට් කරයි (Krebs, 1969;1967.; Williamson et al., 1929). AcAc හට ස්වයංසිද්ධව acetone බවට decarboxylate කළ හැක (Pedersen, 7), ketoacidosis (එනම්, සම්පූර්ණ සෙරුමය කීටෝන සිරුරු > ~3.6 mM; AcAc pKa 4.7, ?OHB pKa 1). මයිටොකොන්ඩ්රිය අභ්යන්තර පටලය හරහා කීටෝන ශරීර ප්රවාහනය කරන යාන්ත්රණයන් නොදන්නා නමුත් AcAc/d-?OHB සෛල වලින් මොනොකාබොක්සිලේට් ප්රවාහක හරහා මුදා හරිනු ලැබේ (ක්ෂීරපායින් තුළ MCT 2 සහ 16, ද්රාව්ය වාහක 1A පවුලේ සාමාජිකයන් 7 සහ 2011) සහ පර්යන්ත ඔක්සිකරණය සඳහා පරිවෘත්තීය පටක වලට පරිවහනය කිරීම (Cotter et al., 2012; Halestrap and Wilson, 2012; Halestrap, 2012; Hugo et al., 1940). සංසරණ කීටෝන ශරීරවල සාන්ද්රණය බාහිර පටක වල සාන්ද්රණයට වඩා වැඩිය (හැරිසන් සහ ලෝන්ග්, 1) කීටෝන සිරුරු සාන්ද්රණ අනුක්රමයකින් ප්රවාහනය කරන බව පෙන්නුම් කරයි. MCTXNUMX හි ක්රියාකාරීත්වය නැතිවී යාමේ විකෘති කිරීම් ස්වයංසිද්ධ කීටොසයිඩෝසිස් සමඟ සම්බන්ධ වී ඇති අතර, කීටෝන ශරීර ආනයනය කිරීමේදී තීරණාත්මක කාර්යභාරයක් යෝජනා කරයි.
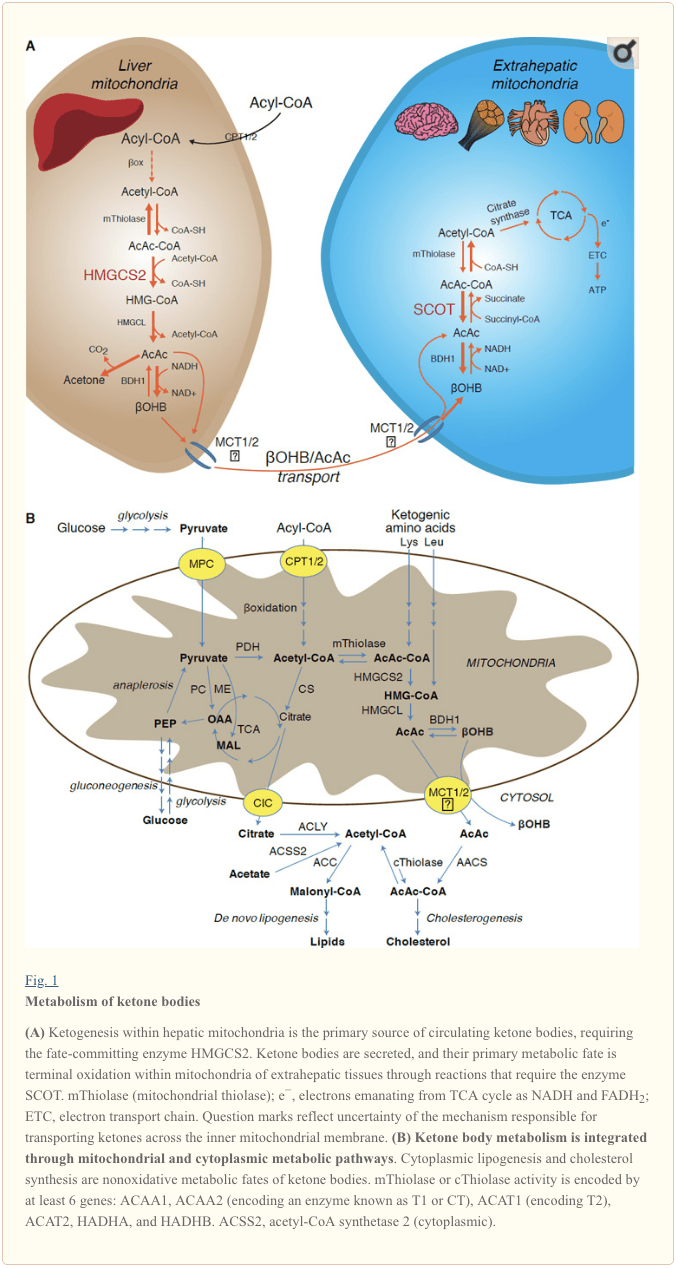
කීටෝන සිරුරු ඔක්සිකාරක නොවන ඉරණමට හැරවීම හැර (කීටෝන සිරුරු වල ඔක්සිකාරක නොවන පරිවෘත්තීය ඉරණම බලන්න), හෙපටෝසයිට් වලට තමන් නිපදවන කීටෝන ශරීර පරිවෘත්තීය කිරීමට හැකියාවක් නැත. අක්මාව මගින් ඩි නොවෝ සංස්ලේෂණය කරන ලද කීටෝන සිරුරු (i) ටර්මිනල් ඔක්සිකරණය සඳහා TCA චක්රයට ලබා ගත හැකි ඇසිටිල්-CoA වෙත බාහිර පටක වල මයිටොකොන්ඩ්රියාවේ උත්ප්රේරණය වේ (රූපය 1A), (ii) lipogenesis හෝ sterol සංශ්ලේෂණ මාර්ග වෙත හරවා යවනු ලැබේ ( Fig. 1B), හෝ (iii) මුත්රා තුළ බැහැර කරයි. විකල්ප ශක්තිජනක ඉන්ධනයක් ලෙස, කීටෝන සිරුරු හදවත, අස්ථි මාංශ පේශි සහ මොළය තුළ දැඩි ලෙස ඔක්සිකරණය වේ (Balasse and Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan ) Extrahepatic mitochondrial BDH1988 ?OHB ඔක්සිකරණයේ පළමු ප්රතික්රියාව උත්ප්රේරණය කරයි, එය back AcAc බවට පරිවර්තනය කරයි (LEHNINGER et al., 1; Sandermann et al., 1960). BDH1986 ට 2% අනුක්රමික අනන්යතාවයක් සහිත සයිටොප්ලාස්මික් d-?OHB-dehydrogenase (BDH20) කීටෝන ශරීර සඳහා ඉහළ කි.මී., සහ යකඩ හෝමියස්ටැසිස් වල කාර්යභාරයක් ඉටු කරයි (Davuluri et al., 1; Guo et al., 2016) . Extrahepatic mitochondrial matrix වලදී, AcAc, succinyl-CoA වෙතින් CoA-moiety හුවමාරු කිරීම හරහා AcAc-CoA වෙත සක්රිය කර ඇත, ප්රතික්රියාවක දී සුවිශේෂී ක්ෂීරපායී CoA Transferase, succinyl-CoA:2006-oxoacid-CoA transferase (SCOT, CoA transferase; OXCT3 මගින් කේතනය කර ඇත), ආසන්න සමතුලිත ප්රතික්රියාවක් හරහා. AcAc-CoA හි ජල විච්ඡේදනය මගින් නිකුත් කරන නිදහස් ශක්තිය succinyl-CoA වලට වඩා වැඩි වන අතර එය AcAc සෑදීමට හිතකර වේ. මෙලෙස කීටෝන ශරීර ඔක්සිකාරක ප්රවාහය ස්කන්ධ ක්රියාව හේතුවෙන් සිදුවේ: බහුල ලෙස AcAc සැපයීම සහ citrate synthase හරහා acetyl-CoA වේගවත් පරිභෝජනය SCOT විසින් AcAc-CoA (+ succinate) සෑදීමට හිතකර වේ. සැලකිය යුතු ලෙස, ග්ලූකෝස් (හෙක්සොකිනේස්) සහ මේද අම්ල (ඇසිල්-කෝඒ සින්තටේස්) වලට ප්රතිවිරුද්ධව, කීටෝන ශරීර (SCOT) ඔක්සිකරණය කළ හැකි ස්වරූපයකට සක්රීය කිරීම සඳහා ATP ආයෝජනය අවශ්ය නොවේ. ආපසු හැරවිය හැකි AcAc-CoA තයෝලේස් ප්රතික්රියාවක් [ACAA1 (T2 හෝ CT ලෙස හඳුන්වන එන්සයිමයක් කේතනය කිරීම), ACAT1 (T1 කේතනය කිරීම), HADHA හෝ HADHB මඟින් කේතනය කරන ලද මයිටොකොන්ඩ්රියල් තයෝලේස් හතරෙන් ඕනෑම එකක් මගින් උත්ප්රේරණය කර ඇසිටිල්-CoA අණු දෙකක් ලබා දෙයි. TCA චක්රයට ඇතුල් වන (Hersh and Jencks, 2; Stern et al., 1967; Williamson et al., 1956). කීටෝටික් තත්වයන් තුළ (එනම්, සම්පූර්ණ සෙරුම් කීටෝන > 1971 µM), කීටෝන සිරුරු බලශක්ති වියදම් සඳහා සැලකිය යුතු දායකත්වයක් ලබා දෙන අතර ඔක්සිකරණය ලබා ගැනීම හෝ සංතෘප්ත වීම සිදු වන තෙක් පටක වල වේගයෙන් භාවිතා වේ (Balasse et al., 500; Balasse and Fery, 1978 ; එඩ්මන්ඩ් සහ අල්., 1989). අක්මාවෙන් ව්යුත්පන්න වූ කීටෝන සිරුරු ඉතා කුඩා කොටසක් මුත්රාවලින් පහසුවෙන් මැනිය හැකි අතර, වකුගඩු මඟින් භාවිත කිරීම සහ නැවත අවශෝෂණ අනුපාතය සංසරණ සාන්ද්රණයට සමානුපාතික වේ (Goldstein, 1987; Robinson and Williamson, 1987). අධික කීටෝටික් තත්වයන් තුළ (> 1980 mM ප්ලාස්මාවේ), ketonuria කීටෝසිස් පිළිබඳ අර්ධ ප්රමාණාත්මක වාර්තාකරුවෙකු ලෙස සේවය කරයි, නමුත් බොහෝ සායනික පරීක්ෂණ මගින් AcAc හඳුනා ගන්නා නමුත් ?OHB (Klocker et al., 1).
කීටොජනික් උපස්ථර සහ හෙපටෝසයිට් පරිවෘත්තීය කෙරෙහි ඒවායේ බලපෑම
කීටොජනික් උපස්ථරවලට මේද අම්ල සහ ඇමයිනෝ අම්ල ඇතුළත් වේ (රූපය 1B). ඇමයිනෝ අම්ලවල උත්ප්රේරකය, විශේෂයෙන් ලියුසීන්, පශ්චාත් අවශෝෂණ තත්ත්වයෙන් කීටෝන ශරීරවලින් 4% ක් පමණ ජනනය කරයි (තෝමස් සහ වෙනත්., 1982). මේ අනුව, කීටෝන ශරීර උත්පාදනය කිරීම සඳහා ඇසිටිල්-කෝඒ උපස්ථර සංචිතය ප්රධාන වශයෙන් මේද අම්ල වලින් ව්යුත්පන්න වේ, මන්ද කාබෝහයිඩ්රේට් සැපයුම අඩු වන අවස්ථා වලදී, පයිරුවේට් ප්රධාන වශයෙන් ඇනප්ලෙරෝසිස් හරහා රක්තපාත TCA චක්රයට ඇතුල් වේ, එනම්, ATP මත යැපෙන කාබොක්සිලේෂන් ඔක්සලෝඇසිටේට් (OAA) හෝ මැලේට් වෙත. (MAL), සහ acetyl-CoA වෙත ඔක්සිකාරක decarboxylation නොවේ (Jeoung et al., 2012; Magnusson et al., 1991; Merritt et al., 2011). ඇසිටිල්-කෝඒ වෙත පයිරුවේට් ඩෙකාබොක්සිලේෂණය උපරිම වන විට පවා අක්මාව තුළ, ග්ලූකෝස් සහ පයිරුවේට් කීටොජෙනසිස් සඳහා නොසැලකිලිමත් ලෙස දායක වේ (Jeoung et al., 2012).
Acetyl-CoA පර්යන්ත ඔක්සිකරණය හරහා ATP උත්පාදනයට ඔබ්බෙන් රක්තපාත අතරමැදි පරිවෘත්තීය ක්රියාවලියට අත්යවශ්ය භූමිකාවන් කිහිපයක් ඇතුළත් කරයි (කීටෝන ශරීර පරිවෘත්තීය ඒකාබද්ධ කිරීම, පශ්චාත් පරිවර්තන වෙනස් කිරීම සහ සෛල කායික විද්යාව ද බලන්න). ඇසිටයිල්-කෝඒ (i) පයිරුවේට් කාබොක්සිලේස් (PC) සක්රීය කරයි, එමගින් පරිවෘත්තීය පාලන යාන්ත්රණයක් සක්රීය කරයි, එය TCA චක්රයට පරිවෘත්තීය ප්රවේශය වැඩි කරයි (Owen et al., 2002; Scrutton and Utter, 1967) සහ (ii) kinase, එය පොස්පරයිලේට් සහ pyruvate dehydrogenase (PDH) නිෂේධනය කරයි (Cooper et al., 1975), එමගින් ඇනප්ලෙරෝසිස් හරහා TCA චක්රයට පයිරුවේට් ගලායාම තවදුරටත් වැඩි දියුණු කරයි. තවද, මයිටොකොන්ඩ්රියල් ඇසිටිල්-CoA ප්රවාහනය කළ හැකි පරිවෘත්තීය බවට පරිවර්තනය කරන යාන්ත්රණයන් මගින් වැඩි කරන ලද සයිටොප්ලාස්මික් ඇසිටිල්-CoA, මේද අම්ල ඔක්සිකරණය වළක්වයි: acetyl-CoA carboxylase (ACC) acetyl-CoA උපසිරසි, mastrologenicA බවට පරිවර්තනය උත්ප්රේරණය කරයි. සහ මයිටොකොන්ඩ්රියල් CPT1 හි ඇලෝස්ටරික් නිෂේධකය [සමාලෝචනය කරන ලද්දේ (Kahn et al., 2005; McGarry and Foster, 1980)]. මේ අනුව, මයිටොකොන්ඩ්රියල් ඇසිටයිල්-CoA තටාකය නියාමනය සහ නියාමනය කරනු ලබන්නේ රක්තපාත අතරමැදි පරිවෘත්තීය ක්රියාවලියේ ප්රධාන අංගයන් මෙහෙයවන කීටොජෙනසිස් හි පිටාර ගැලීමේ මාර්ගය මගිනි.
කීටෝන ශරීරවල ඔක්සිකාරක නොවන පරිවෘත්තීය ඉරණම
අක්මා ව්යුත්පන්න කීටෝන වල ප්රධාන ඉරණම වන්නේ SCOT මත යැපෙන බාහිර ඔක්සිකරණයයි. කෙසේ වෙතත්, AcAc මයිටොකොන්ඩ්රියාවෙන් අපනයනය කළ හැකි අතර සයිටොප්ලාස්මික් ඇසිටොඇසිටයිල්-කෝඒ සින්තටේස් (AACS, Fig. 1B) මගින් උත්ප්රේරණය කරන ලද ATP-යැපෙන ප්රතික්රියාවක් මගින් AcAc-CoA බවට පරිවර්තනය කිරීම හරහා ඇනොබලික් මාර්ගවල භාවිතා කළ හැක. මොළය වර්ධනය කිරීමේදී සහ කිරි දෙන ක්ෂීරපායී ග්රන්ථිය තුළ මෙම මාර්ගය ක්රියාකාරී වේ (Morris, 2005; Robinson and Williamson, 1978; Ohgami et al., 2003). AACS ඇඩිපෝස් පටක සහ සක්රීය ඔස්ටියොක්ලාස්ට් වලද ඉතා ඉහලින් ප්රකාශ වේ (Aguilo et al., 2010; Yamasaki et al., 2016). සයිටොප්ලාස්මික් AcAc-CoA සයිටොසොලික් එච්එම්ජීසීඑස්1 මගින් ස්ටෙරෝල් ජෛව සංස්ලේෂණය දෙසට යොමු කළ හැකිය, නැතහොත් සයිටොප්ලාස්මික් තයෝලේස් දෙකකින් ඇසිටිල්-කෝඒ (ACAA1 සහ ACAT2), මැලෝනිල්-කෝඒ වෙත කාබොක්සිලේටඩ් කර, සහ මේද අම්ල සංස්ලේෂණයට දායක වේ. al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber and Edmond, 1977).
කායික වැදගත්කම තවමත් තහවුරු කර නොමැති අතර, කීටෝන අක්මාව තුළ පවා ඇනබලික් උපස්ථර ලෙස සේවය කළ හැකිය. කෘතිම පර්යේෂණාත්මක සන්දර්භයන්හිදී, AcAc හට අලුතින් සංස්ලේෂණය කරන ලද ලිපිඩ වලින් අඩකටත්, නව සංස්ලේෂණය කරන ලද කොලෙස්ටරෝල් වලින් 75% දක්වාත් දායක විය හැක (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). AcAc ව්යුත්පන්න වී ඇත්තේ අසම්පූර්ණ හෙපටික මේද ඔක්සිකරණයෙන් නිසා, Vivo හි lipogenesis සඳහා දායක වීමට AcAc ට ඇති හැකියාව අක්මාව නිෂ්ඵල බයිසිකල් පැදීමක් අදහස් කරයි, එහිදී මේදය-ව්යුත්පන්න කීටෝන ලිපිඩ නිෂ්පාදනය සඳහා භාවිතා කළ හැකිය, එහි භෞතික විද්යාත්මක වැදගත්කම සඳහා පර්යේෂණාත්මක වලංගු භාවයක් අවශ්ය නමුත් සේවය කළ හැකිය. අනුවර්තන හෝ නොගැලපෙන භූමිකාවන් (Solinas et al., 2015). AcAc ෆෙඩරල් රාජ්යයේ පවා AcAc සක්රිය කිරීමට අනුග්රහය දක්වන අඩු AACS Km-AcAc (~50 µM) සමඟින් කොලෙස්ටරෝජෙනිසිස් ලබා දෙයි (Bergstrom et al., 1984). සයිටොප්ලාස්මික් කීටෝන පරිවෘත්තීය ක්රියාවලියේ ගතික භූමිකාව ප්රාථමික මූසික කළල නියුරෝනවල සහ 3T3-L1 ව්යුත්පන්න-ඇඩිපොසයිටවල යෝජනා කර ඇත, AACS knockdown දුර්වල වූ එක් එක් සෛල වර්ගය (Hasegawa et al., 2012a; Hasegawa, 2012 al). vivo තුළ මීයන් තුළ AACS තට්ටු කිරීම සෙරුම් කොලෙස්ටරෝල් අඩු කළේය (Hasegawa et al., 2012c). SREBP-2, කොලෙස්ටරෝල් ජෛව සංස්ලේෂණයේ ප්රධාන පිටපත් කිරීමේ නියාමකය සහ පෙරොක්සිසෝම් ප්රෝලිෆරේටර් සක්රීය ප්රතිග්රාහක (PPAR)-? AACS පිටපත් කිරීමේ සක්රියකාරක වන අතර, නියුරයිට් වර්ධනයේදී සහ අක්මාව තුළ එහි පිටපත් කිරීම නියාමනය කරයි (Aguilo et al., 2010; Hasegawa et al., 2012c). එකට ගත්විට, සයිටොප්ලාස්මික් කීටෝන ශරීර පරිවෘත්තීය තෝරාගත් තත්වයන් හෝ රෝග ස්වභාවික ඉතිහාසයන් තුළ වැදගත් විය හැකි නමුත්, අක්මා ව්යුත්පන්න කීටෝන සිරුරු බැහැර කිරීමට ප්රමාණවත් නොවේ, මන්ද ක්රියාකාරී විකෘති අහිමි වීම හරහා ප්රාථමික ඔක්සිකාරක ඉරනම තෝරා ගැනීමේ දුර්වලතා සැකසීමේදී දැවැන්ත හයිපර්කෙටෝනෙමියාව ඇති වේ. SCOT වෙත (Berry et al., 2001; Cotter et al., 2011).
HMGCS2 සහ SCOT/OXCT1 නියාමනය
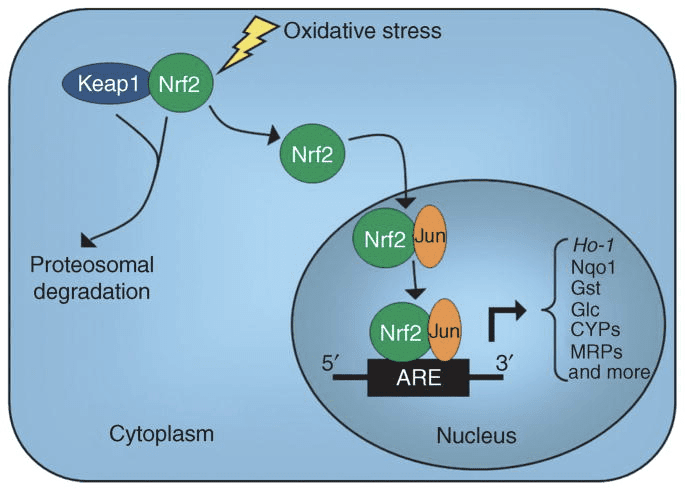
ජාන කේතීකරණ සයිටොසොලික් එච්එම්ජීසීඑස් වෙතින් මයිටොකොන්ඩ්රියක අපසරනය පෘෂ්ඨවංශික පරිණාමයේ මුල් අවධියේදී සිදු වූයේ ඉහළ මොළයේ සිට ශරීර බර අනුපාත ඇති විශේෂවල හෙපටික කීටොජෙනිසිස් සඳහා සහාය වීමේ අවශ්යතාවය හේතුවෙනි (Boukaftane et al., 1994; Cunnane සහ Crawford, 2003). මිනිසුන් තුළ ස්වභාවිකව සිදුවන ක්රියාකාරීත්වය නැතිවීම HMGCS2 විකෘති මගින් හයිපොකෙටොටික් හයිපොග්ලිසිමියා (Pitt et al., 2015; Thompson et al., 1997) ඇති කරයි. ශක්තිමත් HMGCS2 ප්රකාශනය hepatocytes සහ colonic epithelium වලට සීමා වී ඇති අතර, එහි ප්රකාශනය සහ enzymatic ක්රියාකාරකම් විවිධ යාන්ත්රණ හරහා සම්බන්ධීකරණය කර ඇත (Mascaro et al., 1995; McGarry and Foster, 1980; Robinson and Williamson, 1980). HMGCS2 ට බලපෑම් කරන කායික විද්යාත්මක ප්රාන්තවල සම්පූර්ණ විෂය පථය තවදුරටත් පැහැදිලි කිරීමක් අවශ්ය වන අතර, එහි ප්රකාශනය සහ/හෝ ක්රියාකාරීත්වය මුල් පශ්චාත් ප්රසව කාලය, වයසට යෑම, දියවැඩියාව, කුසගින්න හෝ කීටොජනික් ආහාර අනුභවය තුළ නියාමනය කරනු ලැබේ (Balasse and Fery, 1989; Cahill GF Jr, 2006 Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). භ්රෑණය තුළ, Hmgcs5 ජානයේ 2² ප්රදේශයේ මෙතිල්කරණය එහි පිටපත් කිරීම සමඟ ප්රතිලෝමව සහසම්බන්ධ වන අතර, උපතින් පසු අර්ධ වශයෙන් ප්රතිවර්තනය වේ (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferreet; ., 1983). ඒ හා සමානව, hepatic Bdh1 වර්ධන ප්රකාශන රටාවක් ප්රදර්ශනය කරයි, උපතේ සිට කිරි වැරීම දක්වා වැඩි වන අතර, තන්තුමය වර්ධන සාධකය (FGF)-21-රඳා පවතින ආකාරයෙන් කීටොජනික් ආහාර මගින් ද ප්රේරණය වේ (Badman et al., 2007; Zhang et al., 1989 ) ක්ෂීරපායීන්ගේ කීටොජෙනසිස් ඉන්සියුලින් සහ ග්ලූකොජන් යන දෙකටම බෙහෙවින් ප්රතිචාර දක්වයි, පිළිවෙලින් යටපත් කර උත්තේජනය කරනු ලැබේ (McGarry and Foster, 1977). ඉන්සියුලින් ඇඩිපෝස් පටක ලිපොලිසිස් මර්දනය කරයි, එමඟින් එහි උපස්ථරයේ කීටොජෙනිසිස් අහිමි වන අතර ග්ලූකොජන් අක්මාවට සෘජු බලපෑමක් හරහා කීටොජනික් ප්රවාහය වැඩි කරයි (හෙගාඩ්, 1999). Hmgcs2 පිටපත් කිරීම forkhead පිටපත් කිරීමේ සාධකය FOXA2 මගින් උත්තේජනය කරනු ලැබේ, එය insulin-phosphatidylinositol-3-kinase/Akt හරහා නිෂේධනය වන අතර, glucagon-cAMP-p300 සංඥා මගින් ප්රේරණය වේ (Arias et al., 1995t. , 1999; Thumelin et al., 1990; von Meyenn et al., 1993; Wolfrum et al., 2013; Wolfrum et al., 2004). PPAR? (Rodriguez et al., 1994) එහි ඉලක්කය, FGF21 (Badman et al., 2007) සමඟ එක්ව සාගින්නෙන් පෙළෙන විට හෝ කීටොජෙනික් ආහාර පාලනය කිරීමේදී අක්මාව තුළ Hmgcs2 පිටපත් කිරීම ද ඇති කරයි (Badman et al., 2007; Inagaki 2007 et al. ) PPAR හි ප්රේරණය? කලලරූපයේ සිට නවජ කායික විද්යාව දක්වා සංක්රමණය වීමට පෙර සිදු විය හැකි අතර, ?OHB-මැදිහත් වූ histone deacetylase (HDAC)-21 (Rando et al., 3) හරහා FGF2016 සක්රීය කිරීම මුල් නව ජන්ම කාලය තුළ අනුග්රහය දැක්විය හැක. mTORC1 (රපමිසින් සංකීර්ණයේ ක්ෂීරපායී ඉලක්කය 1) PPAR හි යැපෙන නිෂේධනය? පිටපත් කිරීමේ ක්රියාකාරකම් Hmgcs2 ජාන ප්රකාශනයේ ප්රධාන නියාමකයෙකු ද වේ (Sengupta et al., 2010), සහ අක්මාව PER2, ප්රධාන සර්කැඩියානු දෝලනයක්, Hmgcs2 ප්රකාශනය වක්රව නියාමනය කරයි (Chavan et al., 2016). මෑත නිරීක්ෂණවලින් පෙනී යන්නේ බාහිර පිළිකා-ප්රේරිත ඉන්ටර්ලියුකින්-6 PPAR හරහා කීටෝජනනය අඩාල කරන බවයි? මර්දනය (Flint et al., 2016).
HMGCS2 එන්සයිම ක්රියාකාරකම් බහු PTM හරහා නියාමනය කෙරේ. HMGCS2 සෙරීන් පොස්පරීකරණය එහි ක්රියාකාරිත්වය වැඩි දියුණු කරන ලදී vitro (Grimsrud et al., 2012). HMGCS2 ක්රියාකාරකම succinyl-CoA සහ ලයිසීන් අවශේෂ succinylation මගින් ඇලෝස්ටරිකව නිෂේධනය කරයි (Arias et al., 1995; Hegardt, 1999; Lowe and Tubbs, 1985; Quant et al., 1990; Rardin., 2013etal., 1975etal. 1993; Thumelin et al., 2). රක්තපාත මයිටොකොන්ඩ්රියා හි HMGCS1, HMGCL, සහ BDH5 ලයිසීන් අවශේෂවල සුක්සිනයිලේෂන් NAD+ මත යැපෙන deacylase sirtuin 5 (SIRT2013) හි ඉලක්ක වේ (Rardin et al., 2). HMGCS3 ක්රියාකාරකම් SIRT2 ලයිසීන් ඩීසීටයිලේෂන් මගින් ද වැඩි දියුණු කර ඇති අතර, ඇසිටිලේෂන් සහ සුක්සිනයිලේෂන් අතර හරස් ටෝක් HMGCS2013 ක්රියාකාරකම් නියාමනය කිරීමට ඉඩ ඇත (Rardin et al., 2013; Shimazu et al., 2). HMGCSXNUMX Km සහ Vmax නියාමනය කිරීමට මෙම PTM වල හැකියාව තිබියදීත්, මෙම PTM වල උච්චාවචනයන් තවමත් ප්රවේශමෙන් සිතියම්ගත කර නොමැති අතර vivo තුළ කීටොජෙනසිස් යාන්ත්රික ධාවක ලෙස තහවුරු කර නොමැත.
හෙපටෝසයිට් හැර මයිටොකොන්ඩ්රියා ඇති සියලුම ක්ෂීරපායී සෛල තුළ SCOT ප්රකාශ වේ. SCOT ක්රියාකාරකම් සහ කීටොලිසිස් වල වැදගත්කම SCOT-KO මීයන් තුළ පෙන්නුම් කරන ලද අතර, එය උපතින් පසු පැය 48 ක් ඇතුළත හයිපර්කෙටෝනමික් හයිපොග්ලිසිමියා හේතුවෙන් ඒකාකාර මාරක ප්රදර්ශනය විය (Cotter et al., 2011). නියුරෝන හෝ ඇටසැකිලි මයෝසයිටවල පටක-විශේෂිත SCOT අහිමි වීම කුසගින්න තුළ පරිවෘත්තීය අසාමාන්යතා ඇති කරන නමුත් මාරාන්තික නොවේ (Cotter et al., 2013b). මිනිසුන් තුළ, SCOT ඌනතාවය ජීවිතයේ මුල් අවධියේදී දරුණු කීටොසයිඩෝසිස් සමඟ පෙන්නුම් කරයි, උදාසීනත්වය, වමනය සහ කෝමා ඇති කරයි (Berry et al., 2001; Fukao et al., 2000; Kassovska-Bratinova et al., 1996; Niezen-Kal. , 1997; Saudubray et al., 1987; Snyderman et al., 1998; Tildon and Cornblath, 1972). SCOT ජාන සහ ප්රෝටීන් ප්රකාශන නියාමකයින් පිළිබඳව සෛලීය මට්ටමින් දන්නා දේ සාපේක්ෂව අල්පය. Oxct1 mRNA ප්රකාශනය සහ SCOT ප්රෝටීන් සහ ක්රියාකාරකම් කීටෝටික් තත්වයන් තුළ අඩු වේ, සමහරවිට PPAR මත යැපෙන යාන්ත්රණ හරහා (Fenselau and Wallis, 1974; Fenselau and Wallis, 1976; Grinblat et al., 1986; Okuda et al.; 1991etal. ., 2001; Wentz et al., 2010). දියවැඩියා කීටොසයිඩෝසිස් වලදී, රක්තපාත කීටොජෙනසිස් සහ බාහිර ඔක්සිකරණය අතර නොගැලපීම SCOT ක්රියාකාරිත්වය අඩපණ වීම නිසා උග්ර වේ. හෘද සෛලවල ඉන්සියුලින්-ස්වාධීන ග්ලූකෝස් ප්රවාහකයේ (GLUT1/SLC2A1) අධි ප්රකාශනය Oxct1 ජාන ප්රකාශනය වළක්වන අතර කීටෝටික් නොවන තත්වයකදී කීටෝන අග්ර ඔක්සිකරණය අඩු කරයි (Yan et al., 2009). අක්මාව තුළ, Oxct1 mRNA බහුලත්වය microRNA-122 සහ histone methylation H3K27me3 මගින් මර්දනය කරනු ලබන අතර එය කලලයේ සිට නව ජන්ම කාලය දක්වා සංක්රමණය වීමේදී පැහැදිලි වේ (Thorrez et al., 2011). කෙසේ වෙතත්, පශ්චාත් ප්රසව කාලය තුළ රක්තපාත Oxct1 ප්රකාශනය යටපත් කිරීම මූලික වශයෙන් ආරෝපණය කළ හැක්කේ Oxct1-ප්රකාශිත hematopoietic පූර්වජයන් අක්මාවෙන් ඉවත් කිරීම, පර්යන්ත ලෙස වෙනස් වූ හෙපටෝසයිට් වල කලින් පැවති Oxct1 ප්රකාශනය නැතිවීම වෙනුවට ය. ඇත්ත වශයෙන්ම, වෙනස් වූ හෙපටෝසයිට් වල Oxct1 mRNA සහ SCOT ප්රෝටීන් ප්රකාශනය අතිශයින් අඩුය (Orii et al., 2008).
SCOT ද PTM මගින් නියාමනය කරනු ලැබේ. එන්සයිමය SIRT3 KO මීයන්ගේ මොළයේ අධි-ඇසිටයිල් කර ඇත, එය අඩු වූ AcAc මත යැපෙන ඇසිටයිල්-CoA නිෂ්පාදනය ද ප්රදර්ශනය කරයි (Dittenhafer-Reed et al., 2015). SCOT හි ටයිරොසීන් අපද්රව්යවල එන්සයිම නොවන නයිට්රේෂන් ද එහි ක්රියාකාරිත්වය දුර්වල කරයි, එය විවිධ දියවැඩියා මීයන් ආකෘතිවල හදවත් තුළ වාර්තා වී ඇත (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). ඊට වෙනස්ව, ට්රිප්ටෝෆාන් අපද්රව්ය නයිට්රේෂන් SCOT ක්රියාකාරකම් වැඩි කරයි (Brg're et al., 2010; Rebrin et al., 2007). SCOT ක්රියාකාරකම් මොඩියුලේට් කිරීම සඳහා නිර්මාණය කර ඇති අවශේෂ-විශේෂිත නයිට්රේෂන් හෝ ඩී-නයිට්රේෂන් අණුක යාන්ත්රණ පැවතිය හැකි අතර පැහැදිලි කිරීමක් අවශ්ය වේ.
Extrahepatic Ketogenesis හි මතභේද
ක්ෂීරපායීන්ගේ ප්රාථමික කීටොජනික් ඉන්ද්රිය අක්මාව වන අතර, හෙපටෝසයිට් සහ බඩවැල් එපිටිලියල් සෛල පමණක් HMGCS2 හි මයිටොකොන්ඩ්රිය සමස්ථානිකය බහුල ලෙස ප්රකාශ කරයි (Cotter et al., 2013a; Cotter et al., 2014; McGarry and Foster, 1980) Robinson, 1980; . සංකීර්ණ පොලිසැකරයිඩවල නිර්වායු බැක්ටීරියා පැසවීම මගින් බියුටේට් ලබා දෙයි, එය පර්යන්ත ඔක්සිකරණය හෝ කීටොජෙනසිස් සඳහා ක්ෂීරපායීන් තුළ කොලනොසයිට් මගින් අවශෝෂණය කර ගනී (Cherbuy et al., 1995), එය colonocyte අවකලනයෙහි කාර්යභාරයක් ඉටු කළ හැකිය (Wang et al., 2016). අන්ත්ර අපිච්ඡද සෛල සහ හෙපටෝසයිට් හැර අනෙකුත් සියලුම ක්ෂීරපායී සෛලවල HMGCS2 බොහෝ දුරට නොපවතී, නමුත් පිළිකා සෛල, මධ්යම ස්නායු පද්ධතියේ තාරකා සෛල, වකුගඩු, අග්න්යාශය තුළ බාහිර කීටොජෙනිසිස් අපේක්ෂාව ඉහළ ගොස් තිබේද? සෛල, දෘෂ්ටි විතානයේ වර්ණක එපිටිලියම් (RPE) සහ අස්ථි මාංශ පේශිවල පවා (Adijanto et al., 2014; Avogaro et al., 1992; El Azzouny et al., 2016; Grabacka et al., 2016; Kang 2015, al. ; Le Foll et al., 2014; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2016; Zhang et al., 2011). Ectopic HMGCS2 ශුද්ධ කීටොජනික් ධාරිතාවක් නොමැති පටක වල නිරීක්ෂණය වී ඇත (කුක් සහ වෙනත් අය, 2016; Wentz et al., 2010), සහ HMGCS2 සෛල න්යෂ්ටිය ඇතුළුව අනාගත කීටොජෙනිස්-ස්වාධීන සඳ එළිය කිරීමේ ක්රියාකාරකම් ප්රදර්ශනය කරයි (චෙන් ආදිය. , 2016; Kostiuk et al., 2010; Meertens et al., 1998).
කීටෝන ශරීර ඔක්සිකරණය කරන ඕනෑම බාහිර පටකයකට HMGCS2 ස්වාධීන යාන්ත්රණ හරහා කීටෝන සිරුරු සමුච්චය කිරීමේ හැකියාව ඇත (රූපය 2A). කෙසේ වෙතත්, ස්ථායී තත්වයේ කීටෝන ශරීර සාන්ද්රණය රුධිර සංසරණයේදී ඉක්මවන බාහිර පටකයක් නොමැත (Cotter et al., 2011; Cotter et al., 2013b; Harrison and Long, 1940), කීටෝන සිරුරු පහළට ප්රවාහනය කරන බව අවධාරනය කරයි. MCT1/2 මත යැපෙන යාන්ත්රණ හරහා සාන්ද්රණ අනුක්රමය. පෙනෙන පිටස්තර කීටොජෙනසිස් වල එක් යාන්ත්රණයක් ඇත්ත වශයෙන්ම කීටෝන ඔක්සිකරණයේ සාපේක්ෂ දුර්වලතාවය පිළිබිඹු කරයි. අමතර විභව පැහැදිලි කිරීම් කීටෝන ශරීර සෑදීමේ ක්ෂේත්රය තුළට වැටේ. පළමුව, thiolase සහ SCOT හි ප්රතිවර්ත කළ හැකි එන්සයිම ක්රියාකාරකම් හරහා de novo ketogenesis සිදු විය හැක (Weidemann and Krebs, 1969). acetyl-CoA සාන්ද්රණය සාපේක්ෂ වශයෙන් ඉහළ මට්ටමක පවතින විට, AcAc ඔක්සිකරණය සඳහා සාමාන්යයෙන් වගකිව යුතු ප්රතික්රියා ප්රතිලෝම දිශාවට ක්රියා කරයි (GOLDMAN, 1954). TCA චක්ර බාධකයක් හේතුවෙන් ?-ඔක්සිකරණ-ව්යුත්පන්න අතරමැදි එකතු වන විට දෙවන යාන්ත්රණයක් ඇතිවේ, AcAc-CoA මයිටොකොන්ඩ්රියල් 3-හයිඩ්රොක්සිසයිල්-CoA dehydrogenase මගින් උත්ප්රේරණය කරන ලද ප්රතික්රියාවක් හරහා l-?OHB-CoA බවට පරිවර්තනය වේ, සහ 3-hydroxybutyryl CoA deacylase to l-?OHB, ස්කන්ධ වර්ණාවලීක්ෂය හෝ අනුනාද වර්ණාවලීක්ෂය මගින් භෞතික විද්යාත්මක enantiomer d-?OHB (Reed and Ozand, 1980) වෙතින් වෙන්කර හඳුනාගත නොහැක. l-?OHB d-?OHB වලින් වර්ණදේහාත්මකව හෝ එන්සයිමය වශයෙන් වෙන්කර හඳුනාගත හැකි අතර එය බාහිර පටක වල පවතී, නමුත් අක්මාවේ හෝ රුධිරයේ නොවේ (Hsu et al., 2011). Hepatic ketogenesis නිෂ්පාදනය කරන්නේ BDH උපස්ථරයක් වන එකම enantiomer වන d-?OHB පමණි (Ito et al., 1984; Lincoln et al., 1987; Reed and Ozand, 1980; Scofield et al., 1982; Scofield et al.,field 1982). තෙවන HMGCS2-ස්වාධීන යාන්ත්රණයක් ඇමයිනෝ අම්ල උත්ප්රේරක හරහා d-?OHB ජනනය කරයි, විශේෂයෙන් ලියුසීන් සහ ලයිසීන්. හතරවන යාන්ත්රණයක් පෙනෙන්නේ එය ලේබල් කිරීමේ කෞතුක වස්තුවක් නිසා වන අතර එබැවින් ව්යාජ කේතුජනනය ලෙස හැඳින්වේ. මෙම සංසිද්ධිය SCOT සහ thiolase ප්රතික්රියා වල ප්රතිවර්තනයට ආරෝපණය කළ හැකි අතර, බාහිර පටකවල ඇති කීටෝන ශරීර ට්රේසර් සමස්ථානික තනුක කිරීම හේතුවෙන් කීටෝන ශරීර පිරිවැටුම අධිතක්සේරු කිරීමට හේතු විය හැක (Des Rosiers et al., 1990; Fink et al., 1988). . එසේ වුවද, බොහෝ සන්දර්භයන් තුළ ව්යාජ කේතුජනනය නොසැලකිය හැකිය (Bailey et al., 1990; Keller et al., 1978). ක්රමානුකුල (රූපය 2A) මඟින් කීටෝනවල උස් වූ පටක ස්ථායී සාන්ද්රණය සලකා බැලීමේදී යෙදිය යුතු ප්රයෝජනවත් ප්රවේශයක් පෙන්නුම් කරයි.
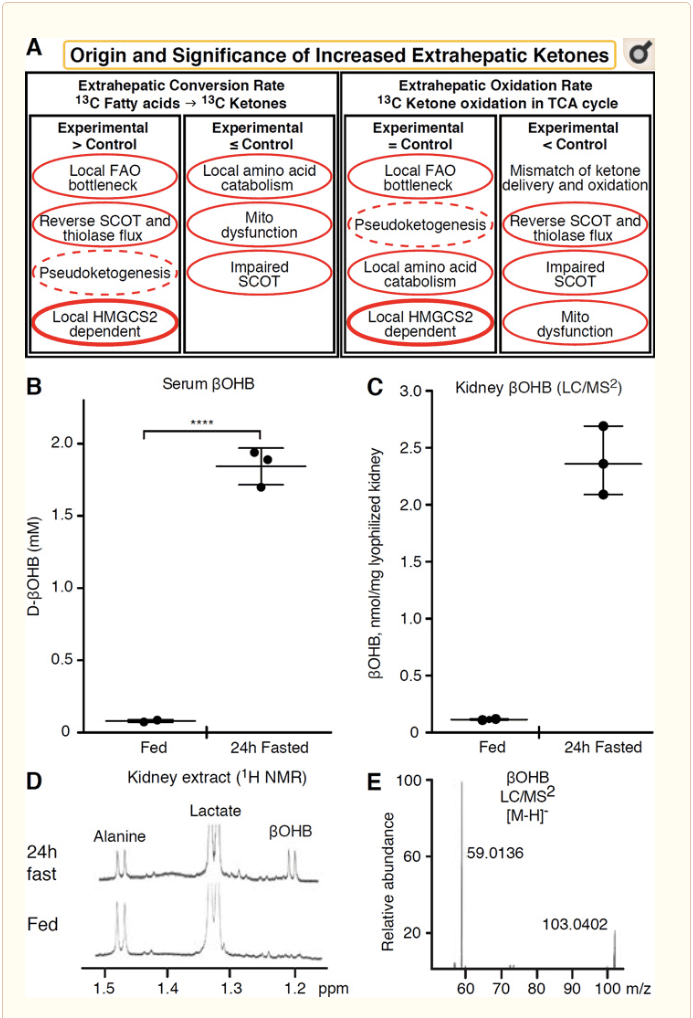

▪️වකුගඩු මෑතක දී විභව කීටොජනික් ඉන්ද්රියයක් ලෙස අවධානයට ලක්ව ඇත. ප්රාන්තවල අතිමහත් බහුතරයක, වකුගඩු යනු අක්මාවෙන් ව්යුත්පන්න වූ කීටෝන ශරීරවල ශුද්ධ පාරිභෝගිකයෙකු වන අතර, රුධිරයෙන් කීටෝන සිරුරු බැහැර කිරීම හෝ නැවත අවශෝෂණය කිරීම, සහ වකුගඩු සාමාන්යයෙන් ශුද්ධ කීටෝන ශරීර උත්පාදකයක් හෝ සාන්ද්රණයක් නොවේ (රොබින්සන් සහ විලියම්සන්, 1980). සම්භාව්ය අධ්යයනයක කතුවරුන් නිගමනය කළේ කෘත්රිම පර්යේෂණ පද්ධතියක ප්රමාණනය කරන ලද අවම වකුගඩු කීටොජෙනිස් භෞතික විද්යාත්මකව අදාළ නොවන බවයි (වීඩෙමන් සහ ක්රෙබ්ස්, 1969). මෑතදී, වකුගඩු කීටොජෙනිසිස් දියවැඩියා සහ ස්වයංක්රීය ඌනතා මූසික ආකෘතිවල අනුමාන කර ඇත, නමුත් බොහෝ අවයවවල යෙදවුම් හරහා පරිවෘත්තීය හෝමියස්ටැසිස් හි බහු අවයව මාරුවීම් ඒකාබද්ධ කීටෝන පරිවෘත්තීය වෙනස් කිරීමට වැඩි ඉඩක් ඇත (ටකාගි සහ වෙනත් අය, 2016a; Takagi etal. 2016b; Zhang et al., 2011). මෑත කාලීන ප්රකාශනයකින් වකුගඩු කීටොජෙනිසිස් වකුගඩු වල ඉෂ්මෙමියා-ප්රතිවර්තන තුවාල වලට එරෙහිව ආරක්ෂිත යාන්ත්රණයක් ලෙස යෝජනා කරන ලදී (Tran et al., 2016). මීයන්ගේ වකුගඩු පටක නිස්සාරණයෙන් ?OHB හි නිරපේක්ෂ ස්ථාවර සාන්ද්රණය ~4-12 mM ලෙස වාර්තා විය. මෙය දරාගත හැකි ද යන්න පරීක්ෂා කිරීම සඳහා, අපි පෝෂණය කළ සහ පැය 24 ක නිරාහාර මීයන්ගෙන් වකුගඩු සාරය තුළ ?OHB සාන්ද්රණය ගණනය කළෙමු. සීරම් ?OHB සාන්ද්රණය පැය 100ක නිරාහාරව සිටීමත් සමඟ ~2 µM සිට 24 mM දක්වා වැඩි විය (රූපය 2B), වකුගඩු ස්ථායී තත්ත්වය ?OHB සාන්ද්රණය ෆෙඩරල් ප්රාන්තයේ දළ වශයෙන් 100 μM වන අතර පැය 1 නිරාහාරව සිටියදී 24 mM පමණි (රූපය. 2C'E), වසර 45 කට පෙර ප්රමාණ කළ සාන්ද්රණයන්ට අනුකූල වන නිරීක්ෂණ (Hems and Brosnan, 1970). කීටෝටික් තත්වයන් තුළ, අක්මාවෙන් ලබාගත් කීටෝන සිරුරු ප්රතිනිර්මාණය කළ හැකි නමුත් වකුගඩු කීටොජෙනසිස් සඳහා සාක්ෂි තවදුරටත් සනාථ කිරීම අවශ්ය වේ. සත්ය පිටස්තර කීටොජෙනසිස් සඳහා සහාය වන බලගතු සාක්ෂි RPE හි ඉදිරිපත් කරන ලදී (Adijanto et al., 2014). මෙම කුතුහලය දනවන පරිවෘත්තීය පරිවර්තනය යෝජනා කරන ලද්දේ RPE-ව්යුත්පන්න කීටෝන ප්රභා ප්රතිග්රාහක හෝ M'ller glia සෛල වෙත ගලා යාමට ඉඩ සලසා දීම සඳහා වන අතර එමඟින් ප්රභා ප්රතිග්රාහක බාහිර කොටස ප්රතිජනනය කිරීමට උපකාරී වේ.
?OHB සංඥා මැදිහත්කරුවෙකු ලෙස
ඒවා ජවසම්පන්න ලෙස පොහොසත් වුවද, කීටෝන ශරීර සෛලීය හෝමියස්ටැසිස් (පය. 3) තුළ ප්රකෝපකාරී "කැනොනිකල්" සංඥා භූමිකාවන් ඉටු කරයි (Newman and Verdin, 2014; Rojas-Morales et al., 2016). උදාහරණයක් ලෙස, ?OHB I පන්තියේ HDAC වලක්වයි, එය histone acetylation වැඩි කරන අතර එමගින් ඔක්සිකාරක ආතතිය සීමා කරන ජානවල ප්රකාශනය ඇති කරයි (Shimazu et al., 2013). ?OHB යනු නිරාහාරව හෝ ස්ට්රෙප්ටොසොසින් ප්රේරිත දියවැඩියා මීයන්ගේ (Xie et al., 2016) අක්මාවේ ඇති ලයිසීන් අවශේෂවල හිස්ටෝන් සහසංයුජ විකරණයකි (පහත බලන්න, කීටෝන ශරීර පරිවෘත්තීය ඒකාබද්ධ කිරීම, පශ්චාත් පරිවර්තන කායික විද්යාව, සහ සෛල කීටෝන ශරීර, ඔක්සිකාරක ආතතිය සහ ස්නායු ආරක්ෂණය).
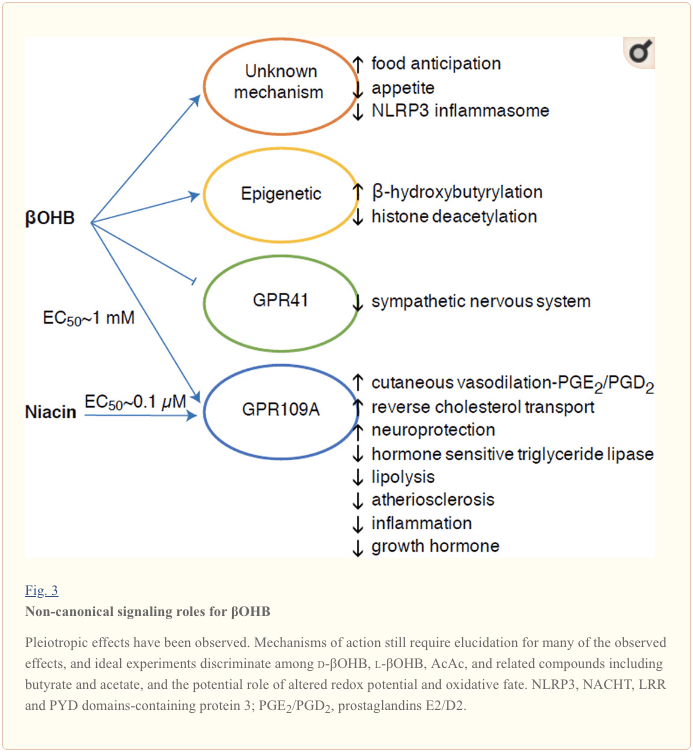
?OHB යනු G-ප්රෝටීන් සම්බන්ධිත ප්රතිග්රාහක හරහා ද බලපෑමක් ඇති කරයි. නොපැහැදිලි අණුක යාන්ත්රණ හරහා, එය සානුකම්පිත ස්නායු පද්ධතියේ ක්රියාකාරිත්වය යටපත් කරන අතර G ප්රෝටීන කපුල්ඩ් ප්රතිග්රාහක 41 (GPR41) හරහා කෙටි දාම මේද අම්ල සංඥා කිරීම වැළැක්වීම මගින් සම්පූර්ණ බලශක්ති වියදම සහ හෘද ස්පන්දන වේගය අඩු කරයි (Kimura et al., 2011). ?OHB GPR109A (HCAR2 ලෙසද හැඳින්වේ), ඇඩිපෝස් පටක වල (සුදු සහ දුඹුරු) ප්රකාශිත හයිඩ්රොකාබොක්සිලික් අම්ලය GPCR උප පවුලේ සාමාජිකයෙකු හරහා ඉදිරියට යයි (Tunaru et al., 2003), සහ ප්රතිශක්තිකරණ සෛල (Ahmed et al., 2009). ?OHB යනු d-?OHB, l-?OHB, සහ බියුටේට් මගින් සක්රිය කරන ලද GPR109A ප්රතිග්රාහකයේ (EC50 ~770 µM) එකම දන්නා අන්තරාසර්ග ලිගන්ඩ් එක වන නමුත් AcAc නොවේ (Taggart et al., 2005). GPR109A සක්රීය කිරීම සඳහා ඉහළ සාන්ද්රණ සීමාවක් ලබා ගත හැක්කේ කීටොජනික් ආහාර වේලක්, කුසගින්නෙන් පෙළීම හෝ කීටොසයිඩෝසිස් අතරතුර, ඇඩිපෝස් පටක ලිපොලිසිස් නිෂේධනය කිරීම මගිනි. GPR109A හි ප්රති-ලිපොලිටික් බලපෑම ඇඩිනයිල් සයික්ලේස් නිෂේධනය කිරීම සහ cAMP අඩු කිරීම, හෝමෝන සංවේදී ට්රයිග්ලිසරයිඩ් lipase නිෂේධනය කිරීම හරහා ඉදිරියට යයි (Ahmed et al., 2009; Tunaru et al., 2003). මෙය ඍණාත්මක ප්රතිපෝෂණ පුඩුවක් නිර්මාණය කරන අතර, කීටෝසිස් මගින් ඇඩිපොසයිට් වලින් එස්ටරීකරණය නොකළ මේද අම්ල මුදා හැරීම අඩු කිරීම මගින් කීටොජෙනසිස් මත මොඩියුලේටරි තිරිංගයක් තබයි (Ahmed et al., 2009; Taggart et al., 2005), එය ප්රති තුලනය කළ හැකි බලපෑමකි. lipolysis උත්තේජනය කරන සානුකම්පිත ධාවකය. Niacin (විටමින් B3, nicotinic අම්ලය) යනු GRP50A සඳහා ප්රබල (EC0.1 ~ 109 µM) ලිගන්ඩ්, dyslipidemias සඳහා දශක ගනනාවක් ඵලදායි ලෙස භාවිතා කරයි (Benyo et al., 2005; Benyo et al., 2006; Fabbrini, 2010 Lukasova et al., 2011; Tunaru et al., 2003). niacin macrophages තුළ ප්රතිලෝම කොලෙස්ටරෝල් ප්රවාහනය වැඩි දියුණු කරන අතර ධමනි ස්රාවය වන තුවාල අඩු කරයි (Lukasova et al., 2011), ධමනි ස්රාවය වන තුවාල මත ?OHB වල බලපෑම තවමත් නොදනී. GPR109A ප්රතිග්රාහකය ආරක්ෂිත භූමිකාවන් ඉටු කරන අතර, ආඝාත සහ ස්නායු විකෘතිතා රෝග (Fu et al., 2015; Rahman et al., 2014) වලදී කීටොජනික් ආහාර භාවිතය අතර කුතුහලය දනවන සම්බන්ධතා පැවතුනද, GPR109A හරහා ?OHB හි ආරක්ෂිත කාර්යභාරයක් vivomondated කර නොමැත. .
අවසාන වශයෙන්, ?OHB ආහාර රුචිය සහ තෘප්තියට බලපෑම් කළ හැකිය. කීටොජනික් සහ ඉතා අඩු ශක්ති ආහාරවල බලපෑම් මනින ලද අධ්යයනයන්හි මෙටා විශ්ලේෂණයකින් නිගමනය වූයේ මෙම ආහාර අනුභව කරන සහභාගිවන්නන් පාලන ආහාරවලට සාපේක්ෂව ඉහළ තෘප්තියක් ප්රදර්ශනය කරන බවයි (ගිබ්සන් සහ වෙනත්., 2015). කෙසේ වෙතත්, මෙම බලපෑම සඳහා පිළිගත හැකි පැහැදිලි කිරීමක් වන්නේ ආහාර රුචිය වෙනස් කළ හැකි අතිරේක පරිවෘත්තීය හෝ හෝමෝන මූලද්රව්ය වේ. නිදසුනක් ලෙස, මීයන් කීටොජනික් ආහාර වේලක් මත පවත්වාගෙන යන මීයන් සමාන කැලරි ප්රමාණයක් ලබාගෙන තිබියදීත්, චව් පාලනයෙන් පෝෂණය වූ මීයන්ට සාපේක්ෂව වැඩි බලශක්ති වියදමක් ප්රදර්ශනය කළ අතර, ලෙප්ටින් හෝ පෝෂණ හැසිරීම නියාමනය කරන පෙප්ටයිඩවල ජාන සංසරණය වීම වෙනස් නොවීය (කෙනඩි සහ වෙනත්., 2007). ?OHB මගින් ආහාර රුචිය යටපත් කිරීම යෝජනා කරන යෝජිත යාන්ත්රණයන් අතරට සංඥා කිරීම සහ ඔක්සිකරණය යන දෙකම ඇතුළත් වේ (Laeger et al., 2010). Circadian rhythm gene (Per2) හි Hepatocyte විශේෂිත මකාදැමීම සහ chromatin immunoprecipitation අධ්යයනයන් මගින් PER2 සෘජුවම Cpt1a ජානය සක්රිය කරන අතර, Hmgcs2 වක්රව නියාමනය කරන අතර, Per2 knockout මීයන් (Chavan 2016, al). මෙම මීයන් ආබාධිත ආහාර අපේක්ෂාව ප්රදර්ශනය කළ අතර එය පද්ධතිමය ?OHB පරිපාලනය මගින් අර්ධ වශයෙන් ප්රතිසාධනය කරන ලදී. මධ්යම ස්නායු පද්ධතිය සෘජු ?OHB ඉලක්කයක් ලෙස තහවුරු කිරීමට අනාගත අධ්යයනයන් අවශ්ය වනු ඇත, සහ නිරීක්ෂණය කරන ලද බලපෑම් සඳහා කීටෝන ඔක්සිකරණය අවශ්යද, නැතහොත් වෙනත් සංඥා යාන්ත්රණයක් සම්බන්ධද යන්න. අනෙකුත් විමර්ශකයින් ආහාර ගැනීම නියාමකයෙකු ලෙස කශේරුකා හයිපොතලමස් තුළ දේශීය තාරකා සෛල ව්යුත්පන්න කීටොජෙනසිස් සඳහා ඇති හැකියාව ඉල්ලා ඇත, නමුත් මෙම මූලික නිරීක්ෂණ ජානමය සහ ප්රවාහ මත පදනම් වූ තක්සේරු වලින් ද ප්රතිලාභ ලබනු ඇත (Le Foll et al., 2014). කුසගින්න සහ තෘප්තිය අසාර්ථක බර අඩු කර ගැනීමේ උත්සාහයේ වැදගත් අංගයන් වන නිසා කීටෝසිස් සහ පෝෂක ඌනතාවය අතර සම්බන්ධය උනන්දුව පවතී.
කීටෝන ශරීර පරිවෘත්තීය ඒකාබද්ධ කිරීම, පශ්චාත් පරිවර්තන වෙනස් කිරීම සහ සෛල කායික විද්යාව
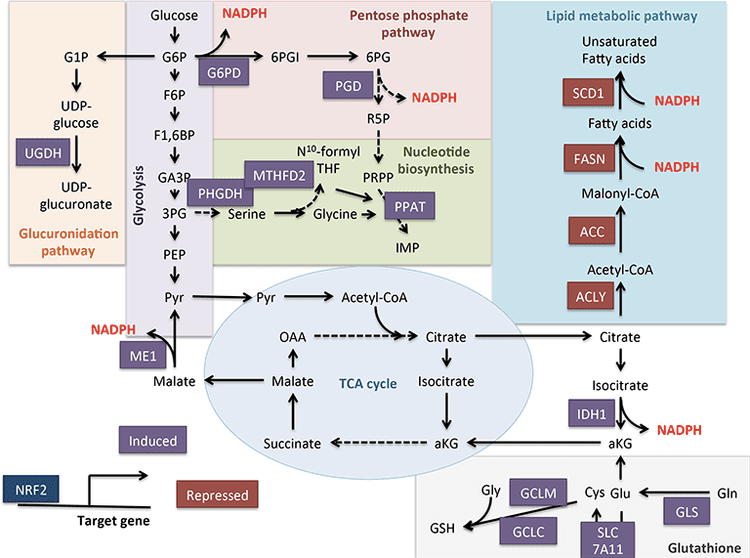
සෛලීය පරිවෘත්තීය ක්රියාවලියේ ප්රමුඛ භූමිකාවන් ප්රදර්ශනය කරන ප්රධාන අතරමැදියක් වන ඇසිටයිල්-CoA හි කොටස් කළ සංචිතවලට කීටෝන සිරුරු දායක වේ (Pietrocola et al., 2015). acetyl-CoA හි එක් කාර්යභාරයක් වන්නේ ඇසිටිලේෂන් සඳහා උපස්ථරයක් ලෙස සේවය කිරීමයි, එන්සයිමය-උත්ප්රේරක හිස්ටෝන සහසංයුජ වෙනස් කිරීම (චෞද්රි සහ වෙනත් අය, 2014; Dutta et al., 2016; Fan et al., 2015; Menzies 2016, al. ) ගතිකව ඇසිටිලේටඩ් මයිටොකොන්ඩ්රියල් ප්රෝටීන විශාල ප්රමාණයක්, එන්සයිම නොවන යාන්ත්රණ හරහා සිදු විය හැකි, පරිගණක ප්රෝටෝමික්ස් අධ්යයනයෙන් ද මතු වී ඇත (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al. ; ෂිමාසු සහ වෙනත්., 2013). Lysine deacetylases සින්ක් cofactor (උදා, nucleocytosolic HDACs) හෝ NAD+ සම-උපස්ථරයක් ලෙස (sirtuins, SIRTs) භාවිතා කරයි (Choudhary et al., 2010; Menzies et al., 2014). කායික හා ජානමය උපාමාරු එක් එක් ප්රතිඵලයක් ලෙස එන්සයිම නොවන ඇසිටිලේෂන් ගෝලීය වෙනස්කම් ඇති කරන බැවින්, ඇසිටිල්ප්රෝටියෝම් සමස්ත සෛලීය ඇසිටිල්-කෝඒ සංචිතයේ සංවේදකය සහ ප්රයෝගකාරකය ලෙස ක්රියා කරයි (වීනෙර්ට් සහ වෙනත්., 2016). අන්තර් සෛලීය පරිවෘත්තීය ද්රව්ය ලයිසීන් අවශේෂ ඇසිටිලේෂන් මොඩියුලේටර ලෙස ක්රියා කරන බැවින්, බහුලත්වය ඉතා ගතික වන කීටෝන සිරුරු වල කාර්යභාරය සලකා බැලීම වැදගත් වේ.
?OHB යනු අවම වශයෙන් යාන්ත්රණ දෙකක් හරහා එපිජෙනටික් විකරණයකි. නිරාහාරව සිටීම, කැලරි සීමා කිරීම, සෘජු පරිපාලනය හෝ දිගුකාලීන ව්යායාම මගින් ප්රේරණය කරන ලද ?OHB මට්ටම් HDAC නිෂේධනය හෝ හිස්ටෝන් ඇසිටිල්ට්රාන්ස්ෆෙරේස් සක්රීය කිරීම අවුලුවයි (Marosi et al., 2016; Sleiman et al., 2016) හෝ ඔක්සිකාරක ආතතියට (Shimazu, 2013.) . ?HDAC3 හි OHB නිෂේධනය අලුත උපන් පරිවෘත්තීය කායික විද්යාව නියාමනය කළ හැකිය (Rando et al., 2016). ස්වාධීනව, ?OHB විසින්ම හිස්ටෝන් ලයිසීන් අවශේෂ සෘජුවම වෙනස් කරයි (Xie et al., 2016). දිගු නිරාහාරව සිටීම හෝ ස්ටෙප්ටොසොසින්-ප්රේරිත දියවැඩියා කීටොසයිඩෝසිස් හිස්ටෝන් ?-හයිඩ්රොක්සිබියුටයිරයිලේෂන් වැඩි වීම. ලයිසීන් ?-hydroxybutyrylation සහ acetylation sites සංඛ්යාව සැසඳිය හැකි වුවද, acetylation වලට වඩා stoichiometrically විශාල histone ?-hydroxybutyrylation නිරීක්ෂණය විය. වෙනස් ජානවලට histone lysine ?-hydroxybutyrylation, acetylation හෝ methylation එදිරිව, වෙනස් සෛලීය ක්රියාකාරකම් යෝජනා කරයි. ?-හයිඩ්රොක්සිබියුටයිරයිලේෂන් ස්වයංසිද්ධද නැතහොත් එන්සයිමයක්ද යන්න නොදනී, නමුත් කීටෝන ශරීර හරහා යාන්ත්රණ පරාසය ප්රසාරණය කිරීම පිටපත් කිරීමට ගතිකව බලපායි.
කැලරි සීමා කිරීම් සහ පෝෂ්ය පදාර්ථ අහිමි වීමේදී අත්යවශ්ය සෛල ප්රතික්රමලේඛන සිදුවීම් පිළිවෙලින් SIRT3- සහ SIRT5 මත යැපෙන මයිටොකොන්ඩ්රියල් ඩීසීටයිලේෂන් සහ desuccinylation වලදී මැදිහත් විය හැක, පශ්චාත් පරිවර්තන මට්ටමේ දී කීටොජනික් සහ කීටොලයිටික් ප්රෝටීන නියාමනය කිරීම අක්මාව සහ පිටකිරීමේ පටක (Ditetenhafer. 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). වාඩිලාගෙන සිටින අඩවි වල ස්ටෝචියෝමිතික සංසන්දනය අනිවාර්යයෙන්ම පරිවෘත්තීය ප්රවාහයේ මාරුවීම් වලට සෘජුවම සම්බන්ධ නොවුනද, මයිටොකොන්ඩ්රියල් ඇසිටයිලේෂන් ගතික වන අතර එන්සයිම ඇසිටිල්ට්රාන්ස්ෆෙරේස් (Wag2013, Payne3) වලට වඩා ඇසිටිල්-CoA සාන්ද්රණය හෝ මයිටොකොන්ඩ්රියල් pH මගින් මෙහෙයවනු ලැබේ. SIRT5 සහ SIRT2012 කීටෝන ශරීර පරිවෘත්තීය එන්සයිමවල ක්රියාකාරකම් මොඩියුලේට් කිරීම ඇසිටිල්ප්රෝටියෝම්, සුක්සිනයිල්ප්රෝටියෝම් සහ අනෙකුත් ගතික සෛලීය ඉලක්ක මූර්තිමත් කිරීමේදී කීටෝනවල අන්යෝන්ය භූමිකාව පිළිබඳ ප්රශ්නය අවුස්සයි. ඇත්ත වශයෙන්ම, කීටොජෙනසිස් හි වෙනස්කම් NAD+ සාන්ද්රණයන් පිළිබිඹු කරන බැවින්, කීටෝන නිෂ්පාදනය සහ බහුලත්වය සර්ටුයින් ක්රියාකාරකම් නියාමනය කළ හැකි අතර එමඟින් සම්පූර්ණ ඇසිටයිල්-CoA/succinyl-CoA තටාක, acylproteome සහ ඒ අනුව මයිටොකොන්ඩ්රියල් සහ සෛල කායික විද්යාවට බලපෑම් කළ හැකිය. ?-එන්සයිම ලයිසීන් අපද්රව්ය හයිඩ්රොක්සිබියුටයිරයිලේෂන් සෛලීය ප්රතිනිර්මාණයට තවත් ස්ථරයක් එක් කළ හැක. බාහිර පටක වල, කීටෝන ශරීර ඔක්සිකරණය සෛල හෝමියස්ටැසිස් හි සමාන වෙනස්කම් උත්තේජනය කළ හැකිය. acetyl-CoA තටාකවල මැදිරි බෙහෙවින් නියාමනය කර ඇති අතර සෛලීය වෙනස්කම්වල පුළුල් වර්ණාවලියක් සම්බන්ධීකරණය කරන අතර, මයිටොකොන්ඩ්රියල් සහ සයිටොප්ලාස්මික් ඇසිටයිල්-CoA සාන්ද්රණයන් දෙකම සෘජුව හැඩගැස්වීමට කීටෝන සිරුරුවලට ඇති හැකියාව පැහැදිලි කිරීම අවශ්ය වේ (චෙන් සහ වෙනත්, 2016; Corbetal. 2014; Pougovkina et al., 2009; Schwer et al., 2012; Wellen and Thompson, 2015). acetyl-CoA සාන්ද්රණය දැඩි ලෙස නියාමනය කර ඇති නිසාත්, acetyl-CoA පටල නොගැලපෙන නිසාත්, TCA චක්රයේ නිෂ්පාදන අනුපාතය සහ පර්යන්ත ඔක්සිකරණය, කීටෝන ශරීර බවට පරිවර්තනය කිරීම ඇතුළුව ඇසිටිල්-CoA හෝමියස්ටැසිස් සම්බන්ධීකරණය කරන ධාවක යාන්ත්රණයන් සලකා බැලීම ඉතා වැදගත් වේ. Carnitine acetyltransferase (CrAT) හරහා ගලා යාම, හෝ Citrate බවට පරිවර්තනය කිරීමෙන් පසු acetyl-CoA නිර්යාතය Cytosol වෙත අපනයනය කිරීම සහ ATP citrate lyase (ACLY) මගින් මුදා හැරීම. සෛල acetylproteome සහ homeostasis හි මෙම පසුකාලීන යාන්ත්රණවල ප්රධාන භූමිකාවන්ට කීටොජෙනසිස් සහ කීටෝන ඔක්සිකරණයේ භූමිකාවන් පිළිබඳ ගැලපෙන අවබෝධයක් අවශ්ය වේ (Das et al., 2016; McDonnell et al., 2015; Moussaieff et al., 2015 ; 2014; Seiler et al., 2015; Seiler et al., 2009; Wellen et al., 2012; Wellen and Thompson, XNUMX). ඉලක්ක සහ ප්රතිඵල නියම කිරීම සඳහා ජානමය වශයෙන් හසුරුවන ලද ආකෘති සැකසීමේදී පරිවෘත්තීය සහ ඇසිල්ප්රෝටෝමික්ස් හි අභිසාරී තාක්ෂණයන් අවශ්ය වේ.
කීටෝන ශරීර වලට ප්රති- සහ ප්රදාහකාරී ප්රතිචාර
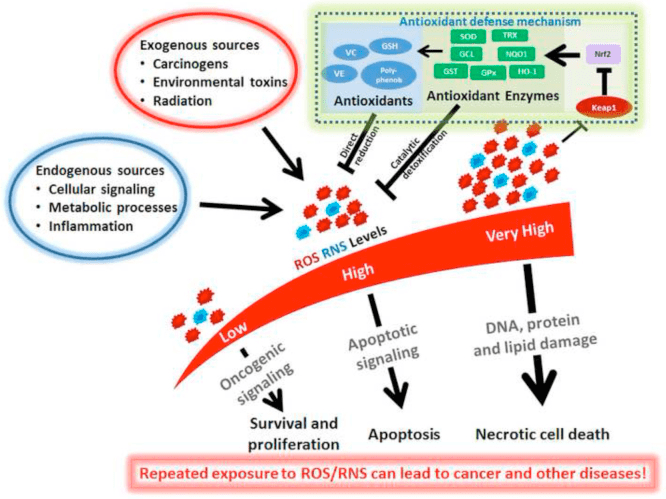
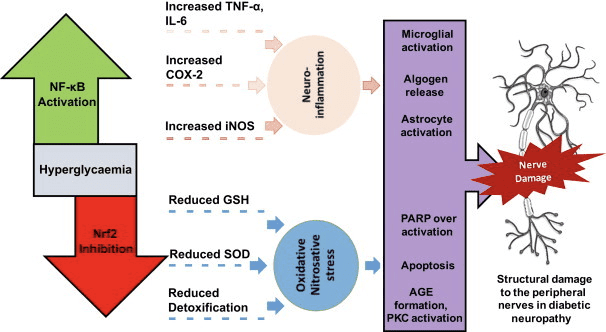
කීටෝසිස් සහ කීටෝන ශරීර දැවිල්ල සහ ප්රතිශක්තිකරණ සෛල ක්රියාකාරීත්වය වෙනස් කරයි, නමුත් විවිධ සහ නොගැලපෙන යාන්ත්රණ යෝජනා කර ඇත. දිගුකාලීන පෝෂ්ය පදාර්ථ හිඟකම දැවිල්ල අඩු කරයි (Youm et al., 2015), නමුත් 1 වර්ගයේ දියවැඩියාවේ නිදන්ගත කීටෝසිස් ගිනි අවුලුවන තත්වයකි (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kurepa et al., 2012 ) මැක්රෝෆේජ් හෝ මොනොසයිට් ඇතුළු බොහෝ ප්රතිශක්තිකරණ පද්ධති සෛල GPR109A බහුල ලෙස ප්රකාශ කරන නිසා දැවිල්ලෙහි ?OHB සඳහා යාන්ත්රණය මත පදනම් වූ සංඥා භූමිකාවන් මතු වේ. ?OHB ප්රධාන වශයෙන් ප්රති-ගිනි අවුලුවන ප්රතිචාරයක් දක්වන අතර (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), කීටෝන ශරීරවල ඉහළ සාන්ද්රණය, විශේෂයෙන් AcAC, විය හැක. ගිනි අවුලුවන ප්රතික්රියාවක් අවුලුවාලීම (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kurepa et al., 2012).
ධමනි සිහින් වීම, තරබාරුකම, ගිනි අවුලුවන බඩවැල් රෝග, ස්නායු රෝග සහ පිළිකා සඳහා GPR109A ලිගන්ඩ් වල ප්රති-ගිනි අවුලුවන භූමිකාවන් සමාලෝචනය කර ඇත (Graff et al., 2016). GPR109A ප්රකාශනය දියවැඩියා ආකෘතිවල RPE සෛල, මානව දියවැඩියා රෝගීන් (Gambhir et al., 2012) සහ ස්නායු විකෘති වීමේදී ක්ෂුද්ර ග්ලියාව තුළ (Fu et al., 2014) වැඩි වේ. ?OHB හි ප්රති-ගිනි අවුලුවන බලපෑම් RPE සෛල තුළ GPR109A අධික ලෙස ප්රකාශ කිරීම මගින් වැඩි දියුණු කර ඇති අතර, GPR109A හි ඖෂධීය නිෂේධනය හෝ ජානමය තට්ටු කිරීම මගින් අහෝසි කරනු ලැබේ (Gambhir et al., 2012). ?OHB සහ exogenous nicotinic acid (Taggart et al., 2005), දෙකම TNF හි ප්රති-ගිනි අවුලුවන බලපෑම් ලබා දෙනවාද? හෝ LPS-ප්රේරිත ප්රදාහය ප්රෝ-ගිනි අවුලුවන ප්රෝටීන (iNOS, COX-2) මට්ටම් අඩු කිරීමෙන් හෝ ස්රාවය කරන සයිටොකයින් (TNF?, IL-1?, IL-6, CCL2/MCP-1), අර්ධ වශයෙන් NF නිෂේධනය කිරීම හරහා -?B පරිවර්තනය (Fu et al., 2014; Gambhir et al., 2012). ?OHB ප්රතිඔක්සිකාරක ආතති ප්රතිචාරය සක්රීය කරමින් ER ආතතිය සහ NLRP3 දැවිල්ල අඩු කරයි (Bae et al., 2016; Youm et al., 2015). කෙසේ වෙතත්, ස්නායු විකෘති ප්රදාහයේ දී, GPR109A- රඳා පවතින ?OHB-මැදිහත් ආරක්ෂාවට MAPK මාර්ග සංඥා (උදා, ERK, JNK, p38) (Fu et al., 2014) වැනි ගිනි අවුලුවන මැදිහත්කරුවන් සම්බන්ධ නොවේ, නමුත් COX-1-යැපෙන PGD2 අවශ්ය විය හැක. නිෂ්පාදනය (Rahman et al., 2014). ඉෂ්කිමික් ආඝාත ආකෘතියක (Rahman et al., 109) ස්නායු ආරක්ෂණ බලපෑමක් ඇති කිරීමට මැක්රෝෆේජ් GPR2014A අවශ්ය වීම කුතුහලය දනවන කරුණකි, නමුත් ඇටමිදුළුවල ව්යුත්පන්න වූ macrophages හි NLRP3 ආසාධනය නිෂේධනය කිරීමට ?OHB හි හැකියාව ස්වාධීන වේ (GPR109 ., 2015). බොහෝ අධ්යයනයන් ?OHB ප්රති-ගිනි අවුලුවන බලපෑම්වලට සම්බන්ධ කළද, ?OHB ප්රදාහයට හිතකර විය හැකි අතර පැටවුන්ගේ හෙපටෝසයිට්වල ලිපිඩ පෙරොක්සයිඩීකරණයේ සලකුණු වැඩි කරයි (Shi et al., 2014). ?OHB හි ප්රති-ප්රෝ-ගිනි අවුලුවන බලපෑම් සෛල වර්ගය, ?OHB සාන්ද්රණය, නිරාවරණ කාලසීමාව සහ සම-මොඩියුලේටර් තිබීම හෝ නොපැවතීම මත රඳා පවතී.
?OHB මෙන් නොව, AcAc ගිනි අවුලුවන සංඥා සක්රිය කළ හැක. විශේෂයෙන් ඉහළ ග්ලූකෝස් සාන්ද්රණයක් සහිත ඉහළ AcAc, NADPH ඔක්සිඩේස්/ඔක්සිකාරක ආතතිය මත යැපෙන යාන්ත්රණයක් හරහා අන්තරාසර්ග සෛල තුවාල තීව්ර කරයි (Kanikarla-Marie and Jain, 2015). දියවැඩියා මව්වරුන්ගේ පෙකණි වැලෙහි ඉහළ AcAc සාන්ද්රණය ඉහළ ප්රෝටීන් ඔක්සිකරණ අනුපාතය සහ MCP-1 සාන්ද්රණය සමඟ සහසම්බන්ධ වී ඇත (Kurepa et al., 2012). දියවැඩියා රෝගීන්ගේ ඉහළ AcAc TNF සමඟ සහසම්බන්ධ වී තිබේද? ප්රකාශනය (Jain et al., 2002), සහ AcAc, නමුත් නොවේ ?OHB, induced TNF?, MCP-1 ප්රකාශනය, ROS සමුච්චය, සහ U937 මානව මොනොසයිට් සෛල තුළ cAMP මට්ටම අඩු විය (Jain et al., 2002; Kurepa et al ., 2012).
කීටෝන දේහ මත යැපෙන සංඥා සංසිද්ධි නිතර ප්රේරණය වන්නේ ඉහළ කීටෝන ශරීර සාන්ද්රණයකින් (> 5 mM) පමණි, සහ බොහෝ අධ්යයනයන්හිදී, නොපැහැදිලි යාන්ත්රණ හරහා කීටෝන ගැති හෝ ප්රති-ගිනි අවුලුවන බලපෑම්වලට සම්බන්ධ කරයි. මීට අමතරව, දැවිල්ල මත ?OHB එදිරිව AcAc හි පරස්පර විරෝධී බලපෑම් සහ මයිටොකොන්ඩ්රියල් රෙඩොක්ස් විභවයට බලපෑම් කිරීමට AcAc/?OHB අනුපාතයට ඇති හැකියාව නිසා, සෛලීය සංසිද්ධි මත කීටෝන සිරුරු වල භූමිකාවන් තක්සේරු කරන හොඳම පරීක්ෂණ AcAc හි බලපෑම් සංසන්දනය කරයි සහ ? OHB විවිධ අනුපාතවල සහ විවිධ සමුච්චිත සාන්ද්රණයන්හි [උදා, (Saito et al., 2016)]. අවසාන වශයෙන්, AcAc වාණිජමය වශයෙන් මිලදී ගත හැක්කේ ලිතියම් ලුණු ලෙස හෝ භාවිතයට පෙර මූලික ජල විච්ඡේදනය අවශ්ය එතිල් එස්ටරයක් ලෙස පමණි. ලිතියම් කැටායන ස්වාධීනව සංඥා සම්ප්රේෂණ කඳුරැල්ල ඇති කරයි (Manji et al., 1995), සහ AcAc ඇනායන ලේබල් වේ. අවසාන වශයෙන්, රේස්මික් d/l-?OHB භාවිතා කරන අධ්යයනයන් ව්යාකූල කළ හැක, මන්ද d-?OHB ස්ටීරියෝසෝමරය පමණක් AcAc වෙත ඔක්සිකරණය කළ හැකි නමුත් d-?OHB සහ l-?OHB GPR109A හරහා එක් එක් සංඥාව NLRP3 ප්රදාහය වළක්වයි, සහ lipogenic උපස්ථර ලෙස සේවය කරයි.
කීටෝන ශරීර, ඔක්සිකාරක ආතතිය සහ ස්නායු ආරක්ෂණය
ඔක්සිකාරක ආතතිය සාමාන්යයෙන් නිර්වචනය කරනු ලබන්නේ අධික නිෂ්පාදනය සහ/හෝ ආබාධිත තුරන් කිරීම හේතුවෙන් ROS අතිරික්තයක් ඉදිරිපත් කරන තත්වයක් ලෙසය. කීටෝන සිරුරු වල ප්රතිඔක්සිකාරක සහ ඔක්සිකාරක ආතතිය අවම කිරීමේ භූමිකාවන් vitro සහ vivo තුළ, විශේෂයෙන් ස්නායු ආරක්ෂණ සන්දර්භය තුළ පුළුල් ලෙස විස්තර කර ඇත. බොහෝ නියුරෝන ඵලදායි ලෙස මේද අම්ල වලින් අධි ශක්ති පොස්පේට් ජනනය නොකරන නමුත් කාබෝහයිඩ්රේට හිඟ වූ විට කීටෝන ශරීර ඔක්සිකරණය කරන බැවින් කීටෝන සිරුරු වල ස්නායු ආරක්ෂණ බලපෑම් විශේෂයෙන් වැදගත් වේ (Cahill GF Jr, 2006; Edmond et al., 1987; Yang et al., 1987). ඔක්සිකාරක ආතති ආකෘතිවලදී, BDH1 ප්රේරණය සහ SCOT මර්දනය මගින් විවිධ සෛල සංඥා, රෙඩොක්ස් විභවය හෝ පරිවෘත්තීය අවශ්යතා පවත්වා ගැනීම සඳහා කීටෝන ශරීර පරිවෘත්තීය නැවත ක්රමලේඛනය කළ හැකි බව යෝජනා කරයි (Nagao et al., 2016; Tieu et al., 2003).
කීටෝන සිරුරු නියුරෝන සහ හෘද සෛලවල සෛලීය හානි, තුවාල, මරණය සහ පහළ ඇපොප්ටෝසිස් ශ්රේණි අඩු කරයි (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). ආමන්ත්රණය කරන ලද යාන්ත්රණ විවිධාකාර වන අතර සෑම විටම සාන්ද්රණයට රේඛීයව සම්බන්ධ නොවේ. අඩු මිලිමෝලර් සාන්ද්රණයන් (d හෝ l)-?OHB scavenge ROS (හයිඩ්රොක්සිල් ඇනායන), නමුත් AcAc බොහෝ ROS විශේෂ ඉවත් කරයි, නමුත් භෞතික විද්යාත්මක පරාසය (IC50 20–67 mM) ඉක්මවන සාන්ද්රණයන්හිදී පමණි (Haces et al., 2008) . අනෙක් අතට, ඉලෙක්ට්රෝන ප්රවාහන දාමයේ රෙඩොක්ස් විභවය කෙරෙහි හිතකර බලපෑමක් d-?OHB වෙත පොදුවේ සම්බන්ධ වන යාන්ත්රණයකි. කීටෝන ශරීර තුනම (d/l-?OHB සහ AcAc) නියුරෝන සෛල මිය යාම සහ ග්ලයිකොලිසිස් වල රසායනික නිෂේධනය මගින් අවුලුවන ROS සමුච්චය අඩු කරන අතර, d-?OHB සහ AcAc පමණක් නියුරෝන ATP පරිහානිය වළක්වන ලදී. ප්රතිවිරුද්ධව, හයිපොග්ලයිසමික් ඉන් vivo මාදිලියේ, (d හෝ l)-?OHB, නමුත් AcAc හිපොකැම්පල් ලිපිඩ පෙරොක්සයිඩනය වැළැක්වීය (Haces et al., 2008; Maalouf et al., 2007; Marosi et al., 2016; මර්ෆි, 2009; මර්ෆි, Tieu et al., 2003). කීටොජනික් ආහාර (87% kcal මේදය සහ 13% ප්රෝටීන්) පෝෂණය කරන ලද මීයන් පිළිබඳ vivo අධ්යයනයන්හි දී ප්රතිඔක්සිකාරක ධාරිතාවේ ස්නායු ව්යුහ විද්යාත්මක විචලනය (Ziegler et al., 2003), එහිදී ග්ලූටතයෝන් පෙරොක්සිඩේස් සහ මුළු එකතුව සමඟ හිපොකැම්පස් හි වඩාත් ගැඹුරු වෙනස්කම් නිරීක්ෂණය කරන ලදී. ප්රතිඔක්සිකාරක ධාරිතාව.
කීටොජනික් ඩයට්, කීටෝන එස්ටර (කීටොජනික් ආහාර සහ බාහිර කීටෝන ශරීරවල චිකිත්සක භාවිතය ද බලන්න), හෝ ?OHB පරිපාලනය ඉස්කිමික් ආඝාතයේ ආකෘතිවල ස්නායු ආරක්ෂාව සිදු කරයි (Rahman et al., 2014); පාකින්සන් රෝගය (Tieu et al., 2003); මධ්යම ස්නායු පද්ධතියේ ඔක්සිජන් විෂ වීම අල්ලා ගැනීම (D'Agostino et al., 2013); අපස්මාර කැක්කුම (Yum et al., 2015); මයිටොකොන්ඩ්රියල් එන්සෙෆලමියෝපති, ලැක්ටික් ඇසිඩෝසිස් සහ ආඝාත වැනි (MELAS) කථාංග සින්ඩ්රෝමය (ෆ්රේ සහ අල්., 2016) සහ ඇල්සයිමර් රෝගය (කුනාන් සහ ක්රෝෆර්ඩ්, 2003; යින් සහ වෙනත්., 2016). අනෙක් අතට, මෑත වාර්තාවක් මගින් මයිටොකොන්ඩ්රියල් ජෛව උත්පාදනය සහ ප්රතිඔක්සිකාරක අත්සන්වල වැඩි වීමක් තිබියදීත්, අසාමාන්ය මයිටොකොන්ඩ්රියල් ඩීඑන්ඒ අළුත්වැඩියා කිරීමේ සංක්රාන්ති මූසික ආකෘතියක කීටොජනික් ආහාරයක් මගින් ස්නායු විකෘති ප්රගතිය පිළිබඳ හිස්ටොපොත විද්යාත්මක සාක්ෂි පෙන්නුම් කළේය (Lauritzen et al., 2016). අනෙකුත් පරස්පර වාර්තා පවසන්නේ ඉහළ කීටෝන ශරීර සාන්ද්රණයට නිරාවරණය වීම ඔක්සිකාරක ආතතිය ඇති කරන බවයි. ඉහළ ?OHB හෝ AcAc මාත්රා මගින් නයිට්රික් ඔක්සයිඩ් ස්රාවය, ලිපිඩ පෙරොක්සයිඩ් ප්රේරණය, SOD, ග්ලූටතයෝන් පෙරොක්සිඩේස් සහ කැටලේස් වල ප්රකාශනය අඩු කරන ලද අතර, මී හෙපටෝසයිට් වල MAPK මාර්ගය ප්රේරණය AcAc වෙත ආරෝපණය කර ඇති නමුත් ?OHB 2004, 2014. ; Shi et al., 2016; Shi et al., XNUMX).
එකට ගත් විට, බොහෝ වාර්තා ?OHB ඔක්සිකාරක ආතතිය දුර්වල කිරීමට සම්බන්ධ කරයි, එහි පරිපාලනය ROS/superoxide නිෂ්පාදනය වළක්වයි, ලිපිඩ පෙරොක්සයිඩ් සහ ප්රෝටීන් ඔක්සිකරණය වළක්වයි, ප්රතිඔක්සිකාරක ප්රෝටීන් මට්ටම් වැඩි කරයි, සහ මයිටොකොන්ඩ්රියල් ශ්වසනය සහ ATP නිෂ්පාදනය වැඩි දියුණු කරයි (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Maalouf et al., 2007; Maalouf and Rho, 2008; Marosi 2016al., Tie2003 et et al., 2016; Yin et al., 2003; Ziegler et al., 2002). AcAc ඔක්සිකාරක ආතතිය ප්රේරණය කිරීමත් සමඟ ?OHB ට වඩා සෘජුව සම්බන්ධ වී ඇති අතර, මෙම බලපෑම් සෑම විටම අනාගත ගිනි අවුලුවන ප්රතික්රියා වලින් පහසුවෙන් විච්ඡේදනය නොවේ (Jain et al., 2015; Kanikarla-Marie and Jain, 2016; Kanikarla-Marie සහ ජේන්, 2016). එපමනක් නොව, ප්ලෙයෝට්රොපික් කීටොජනික් ආහාර මගින් ලබා දෙන දෘශ්ය ප්රතිඔක්සිකාරක ප්රතිලාභය කීටෝන ශරීර මගින්ම සම්ප්රේෂණය නොවිය හැකි අතර කීටෝන ශරීර මගින් ලබා දෙන ස්නායු ආරක්ෂණය සම්පූර්ණයෙන්ම ඔක්සිකාරක ආතතියට ආරෝපණය කළ නොහැකි බව සලකා බැලීම ඉතා වැදගත් වේ. උදාහරණයක් ලෙස ග්ලූකෝස් හිඟවීමේදී, බාහික නියුරෝන වල ග්ලූකෝස් ඌනතාවයේ ආකෘතියක් තුළ, ?OHB ස්වයංක්රීය ප්රවාහය උත්තේජනය කළ අතර නියුරෝන මරණය අඩුවීම සමඟ සම්බන්ධ වූ ස්වයංක්රීය සමුච්චය වැළැක්වීම (Camberos-Luna et al., 3). d-?OHB විසින් HDAC නිෂේධනය හරහා FOXO2016a, SOD, MnSOD, සහ කැටලේස් යන කැනොනිකල් ප්රතිඔක්සිකාරක ප්රෝටීන ද ප්රේරණය කරයි (Nagao et al., 2013; Shimazu et al., XNUMX).
මධ්යසාර නොවන මේද අක්මා රෝග (NAFLD) සහ කීටෝන ශරීර පරිවෘත්තීය
තරබාරුකමට සම්බන්ධ NAFLD සහ මධ්යසාර නොවන ස්ටීටෝහෙපටයිටිස් (NASH) බටහිර රටවල අක්මා රෝග සඳහා වඩාත් පොදු හේතුව වේ (Rinella and Sanyal, 2016), සහ NASH-ප්රේරිත අක්මාව අක්රිය වීම අක්මාව බද්ධ කිරීම සඳහා වඩාත් පොදු හේතුවකි. අක්මාවේ බරෙන් 5% (NAFL) හි ඇති ට්රයිසයිල්ග්ලිසරෝල් අතිරික්ත ගබඩා කිරීම පමණක් අක්මාවේ ක්රියාකාරිත්වය පිරිහීමට හේතු නොවන අතර, මිනිසුන් තුළ NAFLD වෙත ප්රගතිය පද්ධතිමය ඉන්සියුලින් ප්රතිරෝධය සහ 2 වර්ගයේ දියවැඩියාව ඇතිවීමේ වැඩි අවදානම සමඟ සහසම්බන්ධ වේ. හෘද වාහිනී රෝග සහ නිදන්ගත වකුගඩු රෝග (Fabbrini et al., 2009; Targher et al., 2010; Targher and Byrne, 2013). NAFLD සහ NASH හි ව්යාධිජනක යාන්ත්රණයන් අසම්පූර්ණව වටහාගෙන ඇති නමුත් හෙපටෝසයිට් පරිවෘත්තීය අසාමාන්යතා, හෙපටෝසයිට් ස්වයංක්රීයකරණය සහ එන්ඩොප්ලාස්මික් රෙටිකුලම් ආතතිය, රක්තපාත ප්රතිශක්තිකරණ සෛල ක්රියාකාරිත්වය, ඇඩිපෝස් පටක දැවිල්ල සහ පද්ධතිමය ගිනි අවුලුවන මැදිහත්කරුවන් (Fabbrini et al., 2009, Chalasanisuka 2013; Targher et al., 2010; Yang et al., 2010). කාබෝහයිඩ්රේට්, ලිපිඩ සහ ඇමයිනෝ අම්ල පරිවෘත්තීය කැළඹීම් මිනිසුන් තුළ සහ ආදර්ශ ජීවීන් තුළ තරබාරුකම, දියවැඩියාව සහ NAFLD වලට දායක වේ [සමාලෝචනය කරන ලද්දේ (Farese et al., 2012; Lin and Accili, 2011; Newgard, 2012; Samuel සහ ෂුල්මන්, 2012; සන් සහ ලාසර්, 2013)]. NAFLD (Fabbrini et al., 2010b) හි සයිටොප්ලාස්මික් ලිපිඩ පරිවෘත්තීය හි හෙපටෝසයිට් අසාමාන්යතා බහුලව නිරීක්ෂණය වන අතර, මේද ඔක්සිකාරක බැහැර කිරීම පාලනය කරන මයිටොකොන්ඩ්රියල් පරිවෘත්තීය භූමිකාව NAFLD ව්යාධිජනකය තුළ අඩු පැහැදිලිය. මයිටොකොන්ඩ්රියල් පරිවෘත්තීය අසාමාන්යතා NAFLD/NASH ව්යාධිජනකය තුළ ඇති වන අතර දායක වේ (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). සාමාන්ය ඇත (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) නමුත් ඒකාකාරී නොවේ. Koliaki and Roden, 2013; Perry et al., 2016; Rector et al., 2010) සම්මුතිය, විශ්වාසදායක NASH, hepatic mitochondrial ඔක්සිකරණය සහ විශේෂයෙන්ම මේද ඔක්සිකරණය වර්ධනය වීමට පෙර, තරබාරුකමේ පද්ධතිමය ප්රතිරෝධය වැඩි කරයි. , සහ NAFLD. NAFLD ප්රගතිශීලී වන විට, එක් එක් මයිටොකොන්ඩ්රියා අතර පවා ඔක්සිකාරක ධාරිතා විෂමතාවය මතු වන අතර අවසානයේ ඔක්සිකාරක ක්රියාකාරිත්වය අඩාල වේ (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008 etal; ., 2012).
Ketogenesis බොහෝ විට අක්මාවේ මේද ඔක්සිකරණය සඳහා ප්රොක්සියක් ලෙස භාවිතා කරයි. NAFLD සත්ව ආකෘතීන් තුළ ප්රගතියත් සමඟ කීටොජෙනසිස් වල දුර්වලතා මතු වේ, සහ මිනිසුන් තුළ විය හැකිය. අසම්පූර්ණ ලෙස නිර්වචනය කරන ලද යාන්ත්රණ හරහා, හයිපර්ඉන්සියුලිනිමියාව කීටොජෙනසිස් මර්දනය කරයි, කෙට්ටු පාලනයන්ට සාපේක්ෂව හයිපොකීටෝනමියාවට දායක විය හැකිය (බර්ග්මන් සහ වෙනත් අය, 2007; බිකර්ටන් සහ වෙනත්., 2008; සතාපති et al., 2012 etal., 2009 , 2011; උප සහ වෙනත්., 2005). එසේ වුවද, NAFLD පුරෝකථනය කිරීමට කීටෝන ශරීර සාන්ද්රණයන් සංසරණය කිරීමේ හැකියාව මතභේදාත්මක ය (M'nnisté et al., 2015; Sanyal et al., 2001). සත්ව ආකෘතිවල ශක්තිමත් ප්රමාණාත්මක චුම්භක අනුනාද වර්ණාවලීක්ෂ ක්රම මගින් මධ්යස්ථ ඉන්සියුලින් ප්රතිරෝධය සමඟ කීටෝන පිරිවැටුම් අනුපාතය වැඩි වූ බව අනාවරණය විය, නමුත් අඩු අනුපාත වඩාත් දරුණු ඉන්සියුලින් ප්රතිරෝධය සමඟ පැහැදිලි විය (Satapati et al., 2012; Sunny et al., 2010). මේද අක්මාව සහිත තරබාරු මිනිසුන් තුළ, කීටොජනික් අනුපාතය සාමාන්ය වේ (Bickerton et al., 2008; Sunny et al., 2011), එබැවින් හෙපටෝසයිට් තුළ මේද අම්ල බර වැඩිවීමට සාපේක්ෂව කීටොජෙනිස් අනුපාතය අඩු වේ. එහි ප්රතිඵලයක් ලෙස, ?-ඔක්සිකරණ-ව්යුත්පන්න ඇසිටිල්-CoA TCA චක්රයේ අග්ර ඔක්සිකරණයට යොමු විය හැක, පර්යන්ත ඔක්සිකරණය වැඩි කරයි, ඇනප්ලෙරෝසිස්/කැටප්ලෙරෝසිස් හරහා ෆොස්ෆොඑනොල්පයිරුවේට්-ධාවනය කරන ග්ලූකෝනොජෙනිසිස් සහ ඔක්සිකාරක ආතතිය. ඇසිටයිල්-CoA මයිටොකොන්ඩ්රියා වෙතින් ලිපොජෙනසිස් සඳහා පූර්වගාමී උපස්ථරයක් වන සයිටේ්රට් ලෙසද අපනයනය කරයි (රූපය 4) (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). කීටොජෙනසිස් ඉන්සියුලින් වලට අඩු ප්රතිචාරයක් දක්වන අතර හෝ දිගු තරබාරුකම සමඟ නිරාහාරව සිටීම (Satapati et al., 2012), මෙහි යටින් පවතින යාන්ත්රණ සහ පහළ ප්රතිවිපාක අසම්පූර්ණව වටහාගෙන ඇත. මෑත සාක්ෂි වලින් පෙන්නුම් කරන්නේ mTORC1 ඉන්සියුලින් සං signal ාවේ පහළට විය හැකි ආකාරයෙන් කීටොජෙනිසිස් මර්දනය කරන බවයි (කුසෙජෝවා සහ වෙනත්., 2016), එය mTORC1 PPAR?-මැදිහත් වූ Hmgcs2 ප්රේරණය වළක්වන නිරීක්ෂණවලට අනුකූල වේ (Sengupta et al.) (Sengupta 2010) HMGCS2 සහ SCOT/OXCT1 රෙගුලාසි ද බලන්න).

අපගේ කණ්ඩායමේ මූලික නිරීක්ෂණ මගින් කීටොජනික් ඌනතාවයේ අහිතකර අක්මාවේ ප්රතිවිපාක යෝජනා කරයි (Cotter et al., 2014). කාබෝහයිඩ්රේට් බහුල සහ ඒ අනුව 'කීටොජෙනික් නොවන' තත්ත්වයන් තුළ පවා දුර්වල වූ කීටොජෙනිස් තත්ත්වයන් අසාමාන්ය ග්ලූකෝස් පරිවෘත්තීය ක්රියාවලියට දායක වන අතර ස්ටීටෝහෙපටයිටිස් ප්රකෝප කරයි යන උපකල්පනය පරීක්ෂා කිරීම සඳහා, අපි ප්රතිදේහජනක ඔලිගොනියුක්ලියෝටයිඩයිඩ් (ASONUcleotides) ඉලක්ක කර ගැනීම මගින් සලකුණු කළ කීටොජනික් ඌනතාවයේ මූසික ආකෘතියක් නිර්මාණය කළෙමු. Hmgcs2. සම්මත අඩු මේද චව්-පෝෂණය කරන ලද වැඩිහිටි මීයන් තුළ HMGCS2 නැතිවීම මෘදු හයිපර්ග්ලයිසිමියාවට හේතු වූ අතර අක්මාව පරිවෘත්තීය සිය ගණනක නිෂ්පාදනය කැපී පෙනෙන ලෙස ඉහළ නැංවීය, එහි කට්ටලයක් lipogenesis සක්රිය කිරීම දැඩි ලෙස යෝජනා කළේය. ප්රමාණවත් නොවන කීටොජෙනිසිස් සහිත මීයන්ට අධික මේද සහිත ආහාර ලබා දීමෙන් පුළුල් හෙපටෝසයිට් තුවාල හා දැවිල්ල ඇති විය. මෙම සොයාගැනීම් (i) කීටොජෙනිසිස් යනු අක්රීය පිටාර ගැලීමේ මාර්ගයක් නොව අක්මාව හා ඒකාබද්ධ භෞතික විද්යාත්මක හෝමියස්ටැසිස් වල ගතික නෝඩයක් බවට වන මධ්යම උපකල්පනවලට සහය දක්වයි, සහ (ii) NAFLD/NASH සහ අක්රමිකතා අක්මා ග්ලූකෝස් පරිවෘත්තීය අවම කිරීම සඳහා විචක්ෂණශීලී කීටොජනික් වැඩි කිරීම වටී. .
දුර්වල කීටොජෙනසිස් අක්මාව තුවාල වීමට සහ වෙනස් කළ ග්ලූකෝස් හෝමියස්ටැසිස් වලට දායක විය හැක්කේ කෙසේද? මුලින්ම සලකා බැලිය යුත්තේ වැරදිකරු කීටොජනික් ප්රවාහයේ ඌනතාවයද, නැතහොත් කීටෝනමද යන්නයි. මෑත වාර්තාවක් යෝජනා කරන්නේ n-3 බහු අසංතෘප්ත මේද අම්ල වලට ප්රතිචාර වශයෙන් කීටෝන සිරුරු ඔක්සිකාරක ආතතියෙන් ඇතිවන අක්මා තුවාල අවම කළ හැකි බවයි (Pawlak et al., 2015). හෙපටෝසයිට් වල SCOT ප්රකාශනය නොමැතිකම නිසා කීටෝන ශරීර ඔක්සිකරණය නොවන නමුත් ඒවා ලිපොජෙනිසිස් වලට දායක විය හැකි අතර ඒවායේ ඔක්සිකරණයෙන් ස්වාධීනව විවිධ සංඥා භූමිකාවන් ඉටු කළ හැකි බව මතක තබා ගන්න (කීටෝන ශරීරවල ඔක්සිකාරක නොවන පරිවෘත්තීය ඉරණම සහ ?OHB ලෙසද බලන්න. සංඥා මැදිහත්කරු). හෙපටෝසයිට්-ව්යුත්පන්න කීටෝන සිරුරු, තාරකා සෛල සහ කුප්ෆර් සෛල මැක්රෝෆේජ් ඇතුළුව, හෙපටික ඇසිනස් තුළ අසල්වැසි සෛල වර්ග සඳහා සංඥාවක් සහ/හෝ පරිවෘත්තීය ලෙස ක්රියා කළ හැකිය. පවතින සීමිත සාහිත්යයන් මඟින් මැක්රෝෆේජ්වලට කීටෝන ශරීර ඔක්සිකරණය කළ නොහැකි බව යෝජනා කරන අතර, මෙය මනිනු ලැබුවේ සම්භාව්ය ක්රමවේද භාවිතයෙන් පමණක් වන අතර, පෙරිටෝනියල් මැක්රෝෆේජවල පමණි (Newsholme et al., 1986; Newsholme et al., 1987), එය නැවත සිදු වන බව පෙන්නුම් කරයි. ඇටමිදුළුවලින් ව්යුත්පන්න වූ මැක්රෝෆේජ් (Youm et al., 2015) තුළ බහුල SCOT ප්රකාශනය ලබාදී තක්සේරු කිරීම සුදුසුය.
හෙපටොසයිට් කීටොජනික් ප්රවාහය සයිටොප්රොටෙක්ටිව් ද විය හැක. සුවදායී යාන්ත්රණයන් කීටොජෙනසිස් මත රඳා නොපවතින අතර, අඩු කාබෝහයිඩ්රේට් කීටොජනික් ආහාර NAFLD වැඩිදියුණු කිරීම සමඟ සම්බන්ධ වී ඇත (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar සහ Crawford) . අපගේ නිරීක්ෂණවලින් පෙනී යන්නේ හෙපටෝසයිට් කීටොජෙනිස් මගින් TCA චක්ර ප්රවාහය, ඇනප්ලෙරොටික් ප්රවාහය, ෆොස්ෆොඑනොල්පිරුවේට්-ව්යුත්පන්න ග්ලූකොනොජෙනිසිස් (Cotter et al., 2012) සහ ග්ලයිකෝජන් පිරිවැටුම පවා ප්රතිපෝෂණ සහ නියාමනය කළ හැකි බවයි. කීටොජනික් ආබාධය TCA ප්රවාහය වැඩි කිරීමට ඇසිටයිල්-CoA යොමු කරයි, අක්මාව තුළ ROS-මැදිහත් වූ තුවාල වැඩි කිරීමට සම්බන්ධ වී ඇත (Satapati et al., 2014; Satapati et al., 2015); සයිටොටොක්සික් බව ඔප්පු කළ හැකි ඩි නොවෝ සංස්ලේෂණය කරන ලද ලිපිඩ විශේෂවලට කාබන් හැරවීමට බල කරයි; සහ NAD+ වෙත NADH නැවත ඔක්සිකරණය වීම වළක්වයි (Cotter et al., 2012) (රූපය 2014). එකට ගත්විට, සාපේක්ෂ කීටොජනික් ඌනතාවය අක්රමිකතා බවට පත් විය හැකි යාන්ත්රණයන් ආමන්ත්රණය කිරීම, හයිපර්ග්ලයිසිමියාවට දායක වීම, ස්ටීටෝහෙපටයිටිස් අවුලුවාලීම සහ මෙම යාන්ත්රණ මානව NAFLD/NASH තුළ ක්රියාත්මක වන්නේද යන්න පිළිබඳව අනාගත පරීක්ෂණ අවශ්ය වේ. වසංගත රෝග විද්යාත්මක සාක්ෂි වලට අනුව ස්ටීටෝහෙපටයිටිස් ප්රගතියේදී දුර්වල වූ කීටොජෙනිස් (Embade et al., 4; Marinou et al., 2016; M'nnisté et al., 2011; Pramfalk et al., 2015; Safaei 2015, 2016 al., 2016et) රක්තපාත කීටොජෙනසිස් වැඩි කරන ප්රතිකාර මගින් සුවදායක බව ඔප්පු කළ හැකිය (Degirolamo et al., 2016; Honda et al., XNUMX).
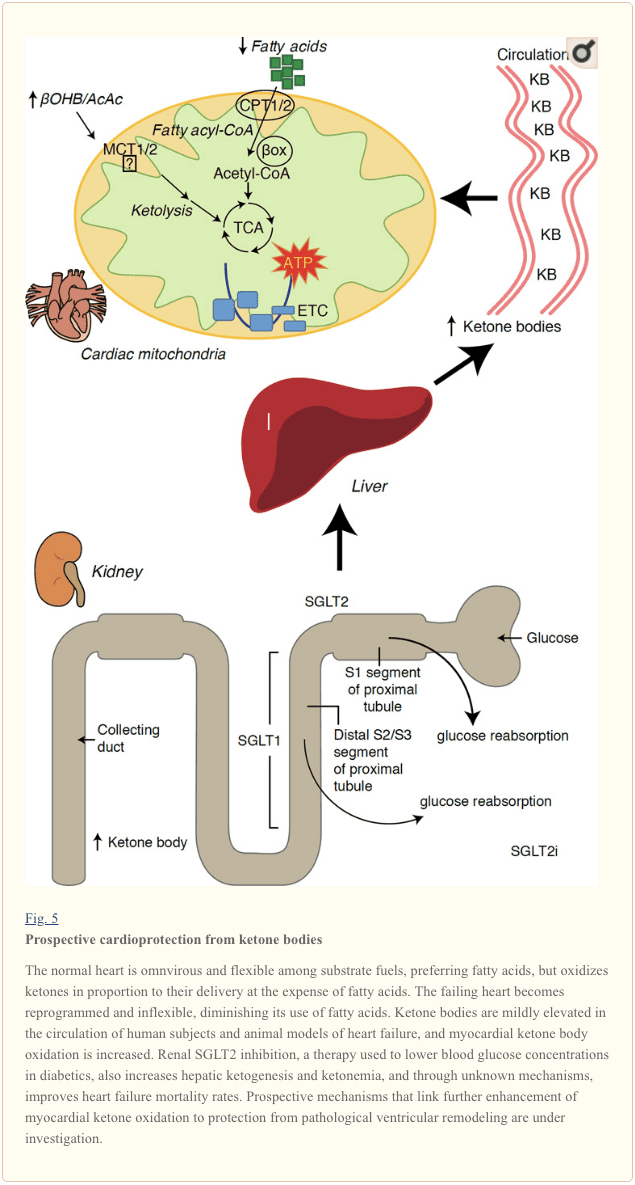
කීටෝන ශරීර සහ හෘදයාබාධ (HF)
පරිවෘත්තීය වේගය 400 kcal/kg/දිනකට වඩා වැඩි, සහ 6-35 kg ATP/දිනකට පිරිවැටුමක් සහිතව, හදවත ඉහළම බලශක්ති වියදම් සහ ඔක්සිකාරක ඉල්ලුමක් ඇති ඉන්ද්රිය වේ (Ashrafian et al., 2007; Wang et al., 2010b). හෘදයාබාධ බලශක්ති පිරිවැටුමෙන් අතිමහත් බහුතරයක් මයිටොකොන්ඩ්රියාව තුළ පවතින අතර, මෙම සැපයුමෙන් 70% ක් FAO වෙතින් ආරම්භ වේ. හෘදය සාමාන්ය තත්ව යටතේ සර්ව භක්ෂක සහ නම්යශීලී වේ, නමුත් ව්යාධි විද්යාත්මකව ප්රතිනිර්මාණය වන හදවත (උදා, අධි රුධිර පීඩනය හෝ හෘදයාබාධ හේතුවෙන්) සහ දියවැඩියා හදවත එක් එක් පරිවෘත්තීය ලෙස නම්යශීලී වේ (Balasse and Fery, 1989; BING, 1954; Fukao et al., 2004. Lopaschuk et al., 2010; Taegtmeyer et al., 1980; Taegtmeyer et al., 2002; Young et al., 2002). ඇත්ත වශයෙන්ම, මවුස් මාදිලිවල හෘද ඉන්ධන පරිවෘත්තීය ජානමය වශයෙන් වැඩසටහන්ගත කළ අසාමාන්යතා හෘද රෝග ඇති කරයි (Carley et al., 2014; Neubauer, 2007). භෞතික විද්යාත්මක තත්ත්වයන් යටතේ සාමාන්ය හදවත් මේද අම්ල හා ග්ලූකෝස් ඔක්සිකරණයේ වියදමින් කීටෝන සිරුරු බෙදා හැරීමට සමානුපාතිකව ඔක්සිකරණය කරන අතර මයෝකාඩියම් ඒකක ස්කන්ධයකට වැඩිම කීටෝන ශරීර පාරිභෝගිකයා වේ (BING, 1954; Crawford et al., 2009; GARLAND et al. ., 1962; Hasselbaink et al., 2003; Jeffrey et al., 1995; Pelletier et al., 2007; Tardif et al., 2001; Yan et al., 2009). මේද අම්ල ඔක්සිකරණය හා සසඳන විට, කීටෝන ශරීර වඩාත් ශක්තිජනක ලෙස කාර්යක්ෂම වන අතර, ආයෝජනය කරන ලද ඔක්සිජන් අණුවකට ATP සංස්ලේෂණය සඳහා වැඩි ශක්තියක් ලබා දෙයි (P/O අනුපාතය) (Kashiwaya et al., 2010; Sato et al., 1995; Veech, 2004) . කීටෝන ශරීර ඔක්සිකරණය FAO ට වඩා වැඩි ශක්තියක් ලබා දෙයි, එය ubiquinone ඔක්සිකරණය කරයි, එය ඉලෙක්ට්රෝන ප්රවාහන දාමයේ රෙඩොක්ස් පරාසය ඉහළ නංවන අතර ATP සංස්ලේෂණය කිරීමට වැඩි ශක්තියක් ලබා දෙයි (Sato et al., 1995; Veech, 2004). කීටෝන සිරුරු ඔක්සිකරණය කිරීම ROS නිෂ්පාදනය ද සීමා කළ හැකි අතර එමඟින් ඔක්සිකාරක ආතතිය (Veech, 2004).
මූලික මැදිහත්වීම් සහ නිරීක්ෂණ අධ්යයනයන් පෙන්නුම් කරන්නේ හදවතේ ඇති කීටෝන සිරුරු වල විභව සුවදායක භූමිකාවකි. පර්යේෂණාත්මක ischemia/reperfusion තුවාල සන්දර්භය තුළ, කීටෝන සිරුරු විභව හෘද ආරක්ෂණ බලපෑම් (Al-Zaid et al., 2007; Wang et al., 2008) ලබා දී ඇත, සමහර විට හෘදයේ මයිටොකොන්ඩ්රියල් බහුලත්වය වැඩි වීම හෝ තීරණාත්මක පොස්පේටරි ඔක්සිකාරක ඉහළ නියාමනය හේතුවෙන්. මැදිහත්කරුවන් (Snorek et al., 2012; Zou et al., 2002). මෑත අධ්යයනයන් පෙන්වා දෙන්නේ මිනිසුන්ගේ (BING, 2016; Fukao et al., 2016; 1954; 2000; ජනාර්දන් et al., 2011; Longo et al., 2004; Rudolph and Schinz, 1973; Tildon and Cornblath, 1972). හෘදයාබාධ ඇති රෝගීන් තුළ සංසරණ කීටෝන ශරීර සාන්ද්රණය වැඩි වේ, පීඩනය පිරවීමට සෘජුව සමානුපාතිකව, නිරීක්ෂණ යාන්ත්රණය සහ වැදගත්කම තවමත් නොදනී (Kupari et al., 1995; Lommi et al., 1996; Lommi et al., 1997; Neely et al ., 1972), නමුත් හෘද සෛලවල තෝරාගත් SCOT ඌනතාවයෙන් යුත් මීයන්, ශල්යකර්මයෙන් ඇති කරන ලද පීඩන අධි බර තුවාල වලට ප්රතිචාර වශයෙන් වේගවත් ව්යාධි කශේරුකා ප්රතිනිර්මාණය සහ ROS අත්සන් ප්රදර්ශනය කරයි (Schugar et al., 2014).
දියවැඩියා ප්රතිකාරයේ මෑත කාලීන කුතුහලය දනවන නිරීක්ෂණ මගින් හෘදයාබාධ කීටෝන පරිවෘත්තීය සහ ව්යාධි කශේරුකා ප්රතිසංස්කරණය අතර විභව සම්බන්ධයක් අනාවරණය කර ඇත (රූපය 5). වකුගඩු සමීප නල සෝඩියම්/ග්ලූකෝස් සම-ප්රවාහනය 2 (SGLT2i) නිෂේධනය කිරීම මිනිසුන් තුළ සංසරණ කීටෝන ශරීර සාන්ද්රණය වැඩි කරයි (Ferrannini et al., 2016a; Inagaki et al., 2015) සහ මීයන් (Suzuki et 2014., හරහා) වැඩි විය. hepatic ketogenesis (Ferrannini et al., 2014; Ferrannini et al., 2016a; Katz and Leiter, 2015; Mudaliar et al., 2015). විශ්මයජනක ලෙස, අවම වශයෙන් මෙම නියෝජිතයන්ගෙන් එක් අයෙකු HF රෝහල්ගතවීම අඩු කර ඇත (උදා, EMPA-REG OUTCOME අත්හදා බැලීම මගින් හෙළිදරව් කර ඇති පරිදි), සහ හෘද වාහිනී මරණ වැඩි දියුණු කිරීම (Fitchett et al., 2016; Sonesson et al., 2016; Wu et al., 2016a ; Zinman et al., 2015). සම්බන්ධිත SGLT2i සඳහා ප්රයෝජනවත් HF ප්රතිඵල පිටුපස ඇති ධාවක යාන්ත්රණයන් ක්රියාකාරීව විවාදයට ලක්ව ඇති අතර, පැවැත්මේ ප්රතිලාභය බහුකාර්ය වේ, අනාගත කීටෝසිස් ඇතුළුව, නමුත් බර, රුධිර පීඩනය, ග්ලූකෝස් සහ යූරික් අම්ල මට්ටම්, ධමනි තද ගතිය, සානුකම්පිත ස්නායු පද්ධතිය, ඔස්මොටික්. ඩයුරිසිස්/ප්ලාස්මා පරිමාව අඩු කිරීම සහ රක්තපාතය වැඩි කිරීම (රාස් සහ කාන්, 2016; වොලන් සහ තොම්සන්, 2016). එකට ගත් විට, HF රෝගීන් තුළ හෝ HF වර්ධනය වීමට වැඩි අවදානමක් ඇති අය තුළ ප්රතිකාරමය වශයෙන් කීටෝනෙමියා වැඩි වීම මතභේදාත්මක ලෙස පවතින නමුත් පූර්ව සායනික හා සායනික අධ්යයනයන්හි සක්රීය විමර්ශනය යටතේ පවතී (Ferrannini et al., 2016b; Kolwicz et al., 2016; Lopaschuk සහ Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
පිළිකා ජීව විද්යාවේ කීටෝන ශරීර
කීටෝන ශරීර සහ පිළිකා අතර සම්බන්ධතා වේගයෙන් මතුවෙමින් පවතින නමුත් සත්ව ආකෘති සහ මිනිසුන් යන දෙඅංශයේම අධ්යයනයන් විවිධ නිගමනවලට එළඹ ඇත. කීටෝන පරිවෘත්තීය ගතික සහ පෝෂණ තත්ත්වයට ප්රතිචාර දක්වන බැවින්, නිරවද්ය මාර්ගෝපදේශක පෝෂණ ප්රතිකාර සඳහා ඇති හැකියාව නිසා පිළිකා සඳහා ජීව විද්යාත්මක සම්බන්ධතා ලුහුබැඳීමට එය පොළඹවයි. සීඝ්ර සෛල ප්රගුණනය සහ වර්ධනය පවත්වා ගැනීම සඳහා පිළිකා සෛල පරිවෘත්තීය ප්රතික්රමලේඛනයට භාජනය වේ (DeNicola and Cantley, 2015; Pavlova and Thompson, 2016). පිළිකා සෛල පරිවෘත්තීය ක්රියාවලියේ සම්භාව්ය වෝර්බර්ග් ආචරණය පැන නගින්නේ ග්ලයිකොලිසිස් සහ ලැක්ටික් අම්ල පැසවීම මගින් ශක්තිය මාරු කිරීම සහ ඔක්සිකාරක පොස්පරීකරණය සහ සීමිත මයිටොකොන්ඩ්රිය ශ්වසනය මත යැපීම සඳහා වන්දි ගෙවීම සඳහා වන ප්රමුඛ භූමිකාවෙනි (De Feyter et al., 2016; Grabacka et al., 2016; Kang et al., 2015; Poff et al., 2014; Shukla et al., 2014). ග්ලූකෝස් කාබන් මූලික වශයෙන් යොමු කරනු ලබන්නේ glycolysis, pentose phosphate මාර්ගය සහ lipogenesis හරහා වන අතර, ඒවා එක්ව පිළිකා ජෛව ස්කන්ධ ප්රසාරණය සඳහා අවශ්ය අතරමැදි සපයයි (Grabacka et al., 2016; Shukla et al., 2014; Yoshii et al., 2015). පිළිකා සෛල ග්ලූකෝස් හිඟයට අනුවර්තනය වීම සිදුවන්නේ ඇසිටේට්, ග්ලූටමින් සහ ඇස්පාර්ටේට් ඇතුළු විකල්ප ඉන්ධන ප්රභවයන් සූරාකෑමේ හැකියාව හරහාය (Jaworski et al., 2016; Sullivan et al., 2015). නිදසුනක් ලෙස, පයිරුවේට් වෙත සීමා කර ඇති ප්රවේශය මගින් ශක්තිජනක සහ ඇනොබලික් අවශ්යතා දෙකම පවත්වා ගනිමින්, කාබොක්සිලේෂන් මගින් ග්ලූටමින් ඇසිටිල්-කෝඒ බවට පරිවර්තනය කිරීමට පිළිකා සෛලවලට ඇති හැකියාව හෙළි කරයි (Yang et al., 2014). පිළිකා සෛලවල රසවත් අනුවර්තනයක් වන්නේ ඇසිටේට් ඉන්ධනයක් ලෙස භාවිතා කිරීමයි (Comerford et al., 2014; Jaworski et al., 2016; Mashimo et al., 2014; Wright and Simone, 2016; Yoshii et al., 2015). ඇසිටේට් යනු පිළිකා සෛල ප්රගුණනය සඳහා තීරනාත්මක වන lipogenesis සඳහා උපස්ථරයක් වන අතර, මෙම lipogenic වාහකය ලබා ගැනීම කෙටි රෝගීන්ගේ පැවැත්ම සහ විශාල පිළිකා බර සමඟ සම්බන්ධ වේ (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al. ., 2015).
පිළිකා නොවන සෛල ග්ලූකෝස් හිඟවීමේදී ඔවුන්ගේ ශක්ති ප්රභවය ග්ලූකෝස් සිට කීටෝන ශරීර වෙත පහසුවෙන් මාරු කරයි. මෙම ප්ලාස්ටික් බව පිළිකා සෛල වර්ග අතර වඩාත් විචල්ය විය හැකි නමුත් vivo තුළ තැන්පත් කරන ලද මොළයේ පිළිකා [2,4-13C2]-?OHB අවට මොළයේ පටක වලට සමාන මට්ටමකට ඔක්සිකරණය විය (De Feyter et al., 2016). ප්රතිලෝම වෝර්බර්ග් ආචරණය හෝ මැදිරි දෙකක පිළිකා පරිවෘත්තීය ආකෘති උපකල්පනය කරන්නේ පිළිකා සෛල යාබද ෆයිබ්රොබ්ලාස්ට් වල OHB නිෂ්පාදනය ප්රේරණය කරන බවයි. . අක්මාවේදී, හෙපටෝසයිටේට් වල කීටොජෙනසිස් සිට කීටෝන ඔක්සිකරණය දක්වා හෙපටෝසයිටල් පිළිකා (හෙපටෝමා) සෛලවල මාරු වීම හෙපටෝමා සෛල රේඛා දෙකක නිරීක්ෂණය කරන ලද BDH2010 සහ SCOT ක්රියාකාරකම් සක්රීය කිරීම සමඟ අනුකූල වේ (Zhang et al., 2012). ඇත්ත වශයෙන්ම, හෙපටමා සෛල OXCT1 සහ BDH1989 ප්රකාශ කර කීටෝන ඔක්සිකරණය කරයි, නමුත් මස්තු සාගින්නෙන් පෙළෙන විට පමණි (Huang et al., 1). විකල්පයක් ලෙස, පිළිකා සෛල කීටොජෙනිසිස් ද යෝජනා කර ඇත. සාමාන්යයෙන් HMGCS1 ප්රකාශ කරන සෛල වර්ගයක් වන colonic epithelium හි පිළිකාමය පරිවර්තනයකදී කීටොජනික් ජාන ප්රකාශනයේ ගතික මාරුවීම් ප්රදර්ශනය වන අතර, මෑත වාර්තාවක් මගින් HMGCS2016, මහා බඩවැලේ සහ squamous සෛල පිළිකා වල දුර්වල පුරෝකථනය කිරීමේ පුරෝකථන සලකුණක් විය හැකි බව යෝජනා කළේය (Camarero, etal. 2; Chen et al., 2). මෙම ආශ්රයට කීටොජෙනිසිස් අවශ්යද නැතහොත් එයට සම්බන්ධද, නැතහොත් HMGCS2006 හි සඳ එළිය කිරීමේ ශ්රිතයක්ද යන්න තීරණය කිරීමට ඉතිරිව ඇත. ප්රතිවිරුද්ධව, PPAR මගින් උත්තේජනය කරන ලද මෙලනෝමා සහ ග්ලියෝබ්ලාස්ටෝමා සෛල මගින් OHB නිෂ්පාදනය පෙනෙයිද? agonist fenofibrate, වර්ධනය අත් අඩංගුවට ගැනීම සමඟ සම්බන්ධ විය (Grabacka et al., 2016). පිළිකා සෛල තුළ HMGCS2/SCOT ප්රකාශනය, කීටොජෙනිස් සහ කීටෝන ඔක්සිකරණය යන භූමිකාවන් සංලක්ෂිත කිරීමට වැඩිදුර අධ්යයනයන් අවශ්ය වේ.
ඉන්ධන පරිවෘත්තීය ක්ෂේත්රයෙන් ඔබ්බට, කීටෝන මෑතකදී සංඥා යාන්ත්රණයක් හරහා පිළිකා සෛල ජීව විද්යාවට සම්බන්ධ කර ඇත. BRAF-V600E+ මෙලනෝමා විශ්ලේෂණය මගින් HMGCL හි OCT1 මත යැපෙන ප්රේරණය ඔන්කොජනික් BRAF මත යැපෙන ආකාරයෙන් පෙන්නුම් කරයි (Kang et al., 2015). HMGCL වැඩි කිරීම ඉහළ සෛලීය AcAc සාන්ද්රණය සමඟ සහසම්බන්ධ වී ඇති අතර, එමඟින් BRAFV600E-MEK1 අන්තර්ක්රියාකාරිත්වය වැඩි දියුණු කරන ලද අතර, පිළිකා සෛල ප්රගුණනය සහ වර්ධනයට හේතු වන පෝෂක-ඉදිරි පුඩුවක් තුළ MEK-ERK සංඥා විස්තාරණය කරයි. මෙම නිරීක්ෂණ මගින් අනාගත පිටස්තර කීටොජෙනසිස් පිළිබඳ කුතුහලය දනවන ප්රශ්නය මතු කරයි, එය පසුව සංඥා යාන්ත්රණයකට සහය දක්වයි (ද බලන්න ?OHB සංඥා මැදිහත්කරුවෙකු ලෙස සහ බාහිර කීටොජෙනසිස්හි මතභේද බලන්න). පිළිකා පරිවෘත්තීය ක්රියාවලියට AcAc, d-?OHB, සහ l-?OHB හි ස්වාධීන බලපෑම් සලකා බැලීම ද වැදගත් වන අතර, HMGCL සලකා බැලීමේදී ලියුසීන් කැටබොලිස්වාදය ද අවුල් විය හැක.
පිළිකා සත්ව ආකෘතිවල කීටොජනික් ආහාරවල බලපෑම් (කීටොජනික් ආහාර සහ බාහිර කීටෝන ශරීරවල චිකිත්සක භාවිතය ද බලන්න) විවිධ වේ (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff etal. ., 2014; Seyfried et al., 2011; Shukla et al., 2014). තරබාරුකම, පිළිකා සහ කීටොජෙනික් ආහාර අතර වසංගත රෝග සම්බන්ධකම් විවාදයට ලක්ව ඇති අතර (Liskiewicz et al., 2016; Wright and Simone, 2016), සත්ව ආකෘතිවල සහ මානව අධ්යයනයන්හි කීටොජනික් ආහාර භාවිතා කරන මෙටා විශ්ලේෂණයක් මගින් පැවැත්මට හිතකර බලපෑමක් යෝජනා කරන ලදී. ප්රතිලාභ කෙටෝසිස් වල විශාලත්වය, ආහාර ආරම්භ කරන වේලාව සහ ගෙඩියේ පිහිටීම සමඟ සම්බන්ධ වේ (Klement et al., 2016; Woolf et al., 2016). කීටෝන ශරීර (d-?OHB හෝ AcAc) සමඟ අග්න්යාශ පිළිකා සෛල ප්රතිකාර කිරීම වර්ධනය, ප්රගුණනය සහ ග්ලයිකොලිසිස් වලක්වන අතර, කීටොජනික් ආහාර වේලක් (81% kcal මේදය, 18% ප්රෝටීන්, 1% කාබෝහයිඩ්රේට්) vivo tumor බර අඩු කිරීම, glycemia සහ බද්ධ කළ පිළිකා ඇති සතුන්ගේ මාංශ පේශි සහ ශරීර බර වැඩි වීම (ශුක්ලා සහ වෙනත් අය, 2014). මීයන් තුළ ඇති මෙටාස්ටැටික් ග්ලියෝබ්ලාස්ටෝමා සෛල ආකෘතියක් භාවිතයෙන් සමාන ප්රතිඵල නිරීක්ෂණය කරන ලද අතර එය ආහාර වේලෙහි කීටෝන අතිරේකය ලබා ගන්නා ලදී (Poff et al., 2014). අනෙක් අතට, කීටොජෙනික් ආහාර වේලක් (91% kcal මේදය, 9% ප්රෝටීන්) සංසරණ වැඩි වීම ?OHB සාන්ද්රණය සහ අඩු වූ ග්ලයිසිමියා නමුත් ග්ලියෝමා දරණ මීයන්ගේ ගෙඩි පරිමාව හෝ පැවැත්මේ කාලසීමාව කෙරෙහි බලපෑමක් ඇති කළේ නැත (De Feyter et al., 2016). මිනිසුන් සහ මීයන් තුළ කීටොජෙනික් ආහාර ප්රේරිත මොළයේ පිළිකා ප්රතිකාරයේ පරිවෘත්තීය කළමනාකරණය වැඩි දියුණු කරන සායනික දර්ශකයක් ලෙස ග්ලූකෝස් කීටෝන දර්ශකයක් යෝජනා කර ඇත (Meidenbauer et al., 2015). එකට ගත් විට, පිළිකා ජීව විද්යාවේ කීටෝන ශරීර පරිවෘත්තීය සහ කීටෝන සිරුරු වල භූමිකාවන් ප්රබෝධමත් වන්නේ ඒවා එක් එක් ප්රතිකාර ක්රම ඉදිරිපත් කරන බැවිනි, නමුත් (i) බාහිර කීටෝන අතර වෙනස්කම් ඇතුළුව විචල්ය න්යාසයකින් මතුවන පැහැදිලි බලපෑම් සමඟ මූලික අංගයන් පැහැදිලි කිරීමට ඉතිරිව ඇත. සිරුරු එදිරිව කීටොජනික් ආහාර, (ii) පිළිකා සෛල වර්ගය, ජානමය බහුරූපතා, ශ්රේණිය සහ අදියර; සහ (iii) කීටොටික් තත්ත්වයට නිරාවරණය වන කාලය සහ කාලසීමාව.

මේද අම්ල සහ කීටොජනික් ඇමයිනෝ අම්ල බිඳවැටීම හරහා කීටෝන ශරීර මගින් කීටොජෙනිසිස් නිර්මාණය වේ. මෙම ජෛව රසායනික ක්රියාවලිය විවිධ අවයව වලට, විශේෂයෙන් මොළයට, රුධිර ග්ලූකෝස් නොමැතිකමට ප්රතිචාරයක් ලෙස නිරාහාරව සිටින තත්වයන් යටතේ ශක්තිය සපයයි. කීටෝන සිරුරු ප්රධාන වශයෙන් නිපදවන්නේ අක්මා සෛලවල මයිටොකොන්ඩ්රියාවේ ය. අනෙකුත් සෛල කීටොජෙනසිස් සිදු කිරීමට සමත් වුවද, ඒවා අක්මා සෛල තරම් ඵලදායී නොවේ. මයිටොකොන්ඩ්රියාවේ කීටොජෙනසිස් සිදුවන නිසා එහි ක්රියාවලීන් ස්වාධීනව නියාමනය කරනු ලැබේ. ආචාර්ය ඇලෙක්ස් ජිමිනෙස් ඩීසී, සීසීඑස්ටී ඉන්සයිට්
කීටොජෙනික් ඩයට් සහ බාහිර කීටෝන ශරීරවල චිකිත්සක යෙදුම
තරබාරුකම සහ NAFLD/NASH (Browning et al., 2011; Foster et al., 2010; Schugar and Crawford, 2012) ඇතුළු පිළිකා නොවන සන්දර්භයන් තුළද චිකිත්සක මෙවලම් ලෙස කීටොජනික් ආහාර සහ කීටෝන ශරීර යෙදීම් මතු වී ඇත; හෘදයාබාධ (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); ස්නායු හා ස්නායු විකෘතිතා රෝග (Martin et al., 2016; McNally and Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang and Cheng, 2010; Yao et al., 2011); සහජ පරිවෘත්තීය දෝෂ (Scholl-Brgi et al, 2015); සහ ව්යායාම කාර්ය සාධනය (Cox et al., 2016). විශේෂයෙන් මත්ද්රව්යවලට ඔරොත්තු දෙන රෝගීන් සඳහා අපස්මාර ප්රතිකාරයේදී කීටොජනික් ආහාරවල කාර්යක්ෂමතාවය විශේෂයෙන් අගය කර ඇත. බොහෝ අධ්යයනයන් මගින් ළමා රෝගීන්ගේ කීටොජනික් ආහාර වේල ඇගයීමට ලක් කර ඇති අතර, තෝරාගත් සින්ඩ්රෝම් වල වැඩිදියුණු කළ සඵලතාවය සමඟින්, මාස 50කට පසු අල්ලාගැනීමේ වාර ගණන ~3% දක්වා අඩුවීමක් අනාවරණය කර ඇත (Wu et al., 2016b). වැඩිහිටි අපස්මාරය තුළ අත්දැකීම් වඩාත් සීමිත වේ, නමුත් රෝග ලක්ෂණ සහිත සාමාන්ය අපස්මාර රෝගීන් තුළ වඩා හොඳ ප්රතිචාරයක් සමඟ සමාන අඩුවීමක් පැහැදිලි වේ (Nei et al., 2014). අඩු ග්ලූකෝස් භාවිතය/ග්ලයිකොලිසිස්, ප්රතිනිර්මාණය කරන ලද ග්ලූටමේට් ප්රවාහනය, ATP-සංවේදී පොටෑසියම් නාලිකාව හෝ ඇඩිනොසීන් A1 ප්රතිග්රාහකයට වක්ර බලපෑම, සෝඩියම් නාලිකාවේ සමස්ථානික ප්රකාශනය වෙනස් කිරීම (හෝ සංසරණ හෝර්මෝන ප්රකාශනය ඇතුළුව බලපෑම් ඇතුළුව උපකල්පිත උපකල්පනවලට යටින් පවතින ප්රති-කම්පිත යාන්ත්රණයන් අපැහැදිලි වේ. Lambrechts et al., 2016; Lin et al., 2017; Lutas and Yellen, 2013). ප්රති-කම්පිත බලපෑම මූලික වශයෙන් කීටෝන සිරුරු වලට ආරෝපණය කළ හැකිද, නැතහොත් අඩු කාබෝහයිඩ්රේට් ආහාරවල පරිවෘත්තීය ප්රතිවිපාක නිසාද යන්න තවමත් පැහැදිලි නැත. එසේ වුවද, කීටෝන එස්ටර (පහත බලන්න) ප්රකෝප කරන ලද අල්ලා ගැනීම් වල සත්ව මාදිලිවල අල්ලා ගැනීමේ සීමාව ඉහළ නංවන බව පෙනේ (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
Atkins-style සහ ketogenic, අඩු කාබෝහයිඩ්රේට් ආහාර බොහෝ විට අප්රසන්න ලෙස සලකනු ලබන අතර, මලබද්ධය, හයිපර්යුරිසිමියා, hypocalcemia, hypomagnesemia, nephrolithiasis, ketoacidosis, hyperglycemia ඇති කිරීමට හේතු විය හැක, සහ සංසරණ කොලෙස්ටරෝල් සහ නිදහස් මේද අම්ල සාන්ද්රණය ඉහළ නැංවීම (2001.B.2012. ; Kossoff සහ Hartman, 2003; Kwiterovich et al., 2002; Suzuki et al., 94). මෙම හේතූන් නිසා, දිගුකාලීන පිළිපැදීම අභියෝග මතු කරයි. මීයන් අධ්යයනයන් සාමාන්යයෙන් සුවිශේෂී සාර්ව පෝෂක ව්යාප්තියක් (1% kcal මේදය, 5% kcal කාබෝහයිඩ්රේට්, 3666% kcal ප්රෝටීන්, Bio-Serv F10) භාවිතා කරයි, එය ශක්තිමත් කීටෝසිස් ඇති කරයි. කෙසේ වෙතත්, ප්රෝටීන් අන්තර්ගතය 5% kcal දක්වා වැඩි කිරීමෙන් කීටෝසිස් සැලකිය යුතු ලෙස අඩු වන අතර 2011% kcal ප්රෝටීන් සීමා කිරීම ව්යාකූල පරිවෘත්තීය හා භෞතික විද්යාත්මක බලපෑම් ඇති කරයි. මෙම ආහාර සැකසීම ද choline ක්ෂය වී ඇත, අක්මා තුවාල වලට ගොදුරු වීමේ අවදානමට බලපාන තවත් විචල්යයක් සහ කීටොජෙනිසිස් පවා (Garbow et al., 2010; Jornayvaz et al., 2007; Kennedy et al., 2013; Pissios 2013 al; Schus 2015 al. et al., XNUMX). මීයන්ගේ කීටොජනික් ආහාර දිගු කාලීන පරිභෝජනයේ බලපෑම් අසම්පූර්ණ ලෙස අර්ථ දක්වා ඇත, නමුත් මීයන් පිළිබඳ මෑත අධ්යයනවලින් හෙළි වූයේ සාමාන්ය පැවැත්ම සහ මීයන් තුළ අක්මා තුවාල සලකුණු නොමැතිකම ඔවුන්ගේ ජීවිත කාලය පුරාවට කීටොජනික් ආහාර මත ය, නමුත් ඇමයිනෝ අම්ල පරිවෘත්තීය, බලශක්ති වියදම් සහ ඉන්සියුලින් සංඥා කැපී පෙනෙන ලෙස නැවත වැඩසටහන්ගත කරන ලදී (Douris et al., XNUMX).
කීටොජනික් ආහාර වේලට විකල්ප යාන්ත්රණ හරහා කීටෝසිස් වැඩි කිරීමේ යාන්ත්රණවලට අජීර්ණ කීටෝන ශරීර පූර්වගාමී භාවිතය ඇතුළත් වේ. බාහිර කීටෝන ශරීර පරිපාලනය කිරීම සාමාන්ය කායික විද්යාවේ දක්නට නොලැබෙන අද්විතීය භෞතික විද්යාත්මක තත්වයක් නිර්මාණය කළ හැකිය, මන්ද සංසරණ ග්ලූකෝස් සහ ඉන්සියුලින් සාන්ද්රණය සාපේක්ෂ වශයෙන් සාමාන්ය වන අතර සෛල ග්ලූකෝස් අවශෝෂණය සහ භාවිතය ඉතිරි කළ හැකිය. කීටෝන සිරුරු කෙටි අර්ධ ආයු කාලයක් ඇති අතර, චිකිත්සක කීටෝසිස් සාක්ෂාත් කර ගැනීම සඳහා සෝඩියම් ?OHB ලුණු ශරීරගත කිරීම හෝ කාන්දු කිරීම අනවශ්ය සෝඩියම් බරක් ඇති කරයි. R/S-1,3-butanediol යනු d/l-?OHB (Desrochers et al., 1992) ලබා දීම සඳහා අක්මාව තුළ පහසුවෙන් ඔක්සිකරණය වන විෂ නොවන ඩයල්කොහොල් වේ. වෙනස් පර්යේෂණාත්මක සන්දර්භයන්හිදී, මෙම මාත්රාව සති හතක් තරම් දීර්ඝ කාලයක් මීයන්ට හෝ මීයන්ට දිනපතා පරිපාලනය කර ඇති අතර, පරිපාලනයෙන් පැය 5ක් ඇතුළත ?OHB සාන්ද්රණය 2 mM දක්වා ලබා දෙයි, එය අවම වශයෙන් අතිරේක 3h (D') සඳහා ස්ථායී වේ. Agostino et al., 2013). R/S-1,3-butanediol (වඩු කාර්මික සහ ග්රෝස්මන්, 1983) ලබා දුන් මීයන් තුළ ආහාර ගැනීම අර්ධ වශයෙන් මර්දනය කිරීම නිරීක්ෂණය කර ඇත. මීට අමතරව, රසායනිකව වෙනස් වූ කීටෝන එස්ටර තුනක් (KEs), (i) R-1,3-බියුටනේඩියෝල් සහ d-?OHB (R-3-hydroxybutyl R-?OHB) මොනෝස්ටර්; (ii) glyceryl-tris-?OHB; සහ (iii) R,S-1,3-butanediol acetoacetate diester ද පුළුල් ලෙස අධ්යයනය කර ඇත (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; ., 1995b; Kashiwaya et al., 2010). පූර්වයෙහි ආවේනික වාසියක් නම්, බඩවැලේ හෝ අක්මාවේ එස්ටරේස් ජල විච්ඡේදනය කිරීමෙන් පසුව, KE මවුලයකට භෞතික විද්යාත්මක d-?OHB මවුල 2ක් නිපදවීමයි. R-3-hydroxybutyl R-?OHB, 714 mg/kg දක්වා මාත්රාවකින්, 6 mM දක්වා සංසරණ d-?OHB සාන්ද්රණයන් ලබා දෙන R-2012-hydroxybutyl R-?OHB ශරීරගත කරන මිනිසුන් තුළ ආරක්ෂාව, ඖෂධවේදය සහ ඉවසීම වඩාත් පුළුල් ලෙස අධ්යයනය කර ඇත (Clarke et al., 2016a; Cox et al., 2015; Kemper et al., 2016; Shivva et al., XNUMX). මීයන් තුළ, මෙම KE කැලරි ප්රමාණය සහ ප්ලාස්මා සම්පූර්ණ කොලෙස්ටරෝල් අඩු කරයි, දුඹුරු මේද පටක උත්තේජනය කරයි, සහ ඉන්සියුලින් ප්රතිරෝධය වැඩි දියුණු කරයි (Kashiwaya et al., 2010; Kemper et al., 2015; Veech, 2013). මෑත සොයාගැනීම්වලින් පෙනී යන්නේ පුහුණු ක්රීඩක ක්රීඩිකාවන්ගේ ව්යායාමයේදී, R-3-hydroxybutyl R-?OHB ශරීරගත වීමෙන් අස්ථි මාංශ පේශි ග්ලයිකොලිසිස් සහ ප්ලාස්මා ලැක්ටේට් සාන්ද්රණය අඩුවීම, අභ්යන්තර මාංශ පේශි ට්රයිසයිල්ග්ලිසරෝල් ඔක්සිකරණය වැඩි වීම සහ මාංශ පේශි ග්ලයිකෝජන් අන්තර්ගතය, සම-උත්ජනය කරන විට පවා (කාබෝහයිඩ්රේට් ස්රාවය කරන විට) ආරක්ෂා වී ඇති බවයි. කොක්ස් සහ අල්., 2016). මෙම කුතුහලය දනවන ප්රතිඵල තවදුරටත් වර්ධනය කිරීම අවශ්ය වේ, මන්ද විඳදරාගැනීමේ ව්යායාම කාර්ය සාධනය වැඩි දියුණු කිරීම ප්රධාන වශයෙන් 2/8 විෂයයන් තුළ KE වෙත ශක්තිමත් ප්රතිචාරයක් මගින් මෙහෙයවනු ලැබේ. එසේ වුවද, මෙම ප්රතිඵල අනෙකුත් උපස්ථරවලට වඩා කීටෝන ඔක්සිකරණය සඳහා කැමැත්තක් දක්වන සම්භාව්ය අධ්යයනයන්ට සහාය දක්වයි (GARLAND et al., 1962; Hasselbaink et al., 2003; Stanley et al., 2003; Valente-Silva et al., 2015), ව්යායාම අතරතුර ඇතුළුව, සහ පුහුණු ක්රීඩක ක්රීඩිකාවන් කීටෝන භාවිතා කිරීමට වඩාත් ප්රමුඛ විය හැක (Johnson et al., 1969a; Johnson and Walton, 1972; Winder et al., 1974; Winder et al., 1975). අවසාන වශයෙන්, සමාන කැලරි ප්රමාණයෙන් (සාර්ව පෝෂක අතර වෙනස් ලෙස බෙදා හරිනු ලැබේ) සහ සමාන ඔක්සිජන් පරිභෝජන අනුපාතවලින් පසුව වැඩිදියුණු කළ ව්යායාම කාර්ය සාධනයට සහාය විය හැකි යාන්ත්රණ තීරණය කිරීමට ඉතිරිව ඇත.
අනාගත ඉදිරිදර්ශනය
කාබෝහයිඩ්රේට් සීමා සහිත ප්රාන්තවල (කීටෝටොක්සික් සුසමාදර්ශය) මේද දහනයෙන් විෂ විමෝචන සමුච්චය කිරීමේ හැකියාව ඇති පිටාර ගැලීමේ මාර්ගයක් ලෙස විශාල වශයෙන් අපකීර්තියට පත් වූ පසු, මෑත නිරීක්ෂණ මගින් කීටෝන ශරීර පරිවෘත්තීය කාබෝහයිඩ්රේට් සහිත තත්වයන් තුළ පවා ප්රයෝජනවත් කාර්යභාරයක් ඉටු කරයි යන අදහසට සහය දක්වයි. උපකල්පනය. කීටෝන පරිවෘත්තීය හැසිරවීම සඳහා පහසු පෝෂණ සහ ඖෂධීය ප්රවේශයන් එය ආකර්ශනීය චිකිත්සක ඉලක්කයක් බවට පත් කරන අතර, ආක්රමණශීලී ලෙස ඉදිරිපත් කරන නමුත් විචක්ෂණශීලී අත්හදා බැලීම් මූලික හා පරිවර්තන පර්යේෂණ රසායනාගාර දෙකෙහිම පවතී. හෘදයාබාධ, තරබාරුකම, NAFLD/NASH, දෙවන වර්ගයේ දියවැඩියාව සහ පිළිකා සඳහා කීටෝන පරිවෘත්තීය උත්තේජනය කිරීමේ කාර්යභාරය නිර්වචනය කිරීමේ වසම් තුළ අසම්පූර්ණ අවශ්යතා මතු වී ඇත. පරිවෘත්තීය සහ සංඥා මාර්ග වෙත ආපසු සහ ඉදිරියට පෝෂණය විය හැකි PTM නියාමනය ඇතුළු කීටෝන සිරුරුවල 'කැනොනිකල් නොවන' සංඥා භූමිකාවන්හි විෂය පථය සහ බලපෑම ගැඹුරු ගවේෂණයක් අවශ්ය වේ. අවසාන වශයෙන්, Extrahepatic ketogenesis මගින් කුතුහලය දනවන පැරාක්රීන් සහ ස්වයංක්රීය සංඥා යාන්ත්රණයන් විවෘත කළ හැකි අතර, චිකිත්සක අරමුණු සාක්ෂාත් කර ගැනීම සඳහා ස්නායු පද්ධතිය සහ පිළිකා තුළ සම-පරිවෘත්තීය ක්රියාවලියට බලපෑම් කිරීමේ අවස්ථා.
අනුමත කර
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
පාද සටහන්
අවසාන වශයෙන්, මිනිස් සිරුරේ ප්රමාණවත් තරම් ග්ලූකෝස් නොමැති විට ශක්ති ප්රභවයක් ලෙස භාවිතා කිරීම සඳහා අක්මාව මගින් කීටෝන සිරුරු නිර්මාණය කරයි. විශේෂයෙන්ම අනෙකුත් සෛලීය කාබෝහයිඩ්රේට් ගබඩා අවසන් වූ පසු රුධිරයේ අඩු ග්ලූකෝස් මට්ටමක් ඇති විට කීටොජෙනසිස් සිදුවේ. ඉහත ලිපියේ අරමුණ වූයේ ඉන්ධන පරිවෘත්තීය ක්රියාවලියේදී, සංඥාකරණයේදී සහ ප්රතිකාර ක්රමවලදී කීටෝන ශරීරවල බහු-මාන භූමිකාවන් පිළිබඳව සාකච්ඡා කිරීමයි. අපගේ තොරතුරු වල විෂය පථය චිරොක්ට්රැක්ටික් සහ කොඳු ඇට පෙළේ සෞඛ්ය ගැටළු වලට සීමා වේ. විෂය කරුණු සාකච්ඡා කිරීමට, කරුණාකර වෛද්ය ජිමිනෙස්ගෙන් විමසීමට හෝ අපව අමතන්න915-850-0900 .
ආචාර්ය ඇලෙක්ස් ජිම්ීනෙස් විසින් පාලනය කරන ලදී
යොමු කර ඇත්තේ:Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

අතිරේක මාතෘකා සාකච්ඡාව: උග්ර පිටුපස වේදනාව
ආපහු වේදනාවආබාධිතභාවයට සහ ලොව පුරා වැඩ කරන දින මග හැරීමට වඩාත් පොදු හේතුවකි. වෛද්ය කාර්යාල චාරිකා සඳහා දෙවන වඩාත් පොදු හේතුව පිටුපස වේදනාව ආරෝපණය කරයි, ඉහළ ශ්වසන ආසාදනවලින් පමණක් වැඩි වේ. ජනගහනයෙන් ආසන්න වශයෙන් සියයට 80 කට පමණ ඔවුන්ගේ ජීවිත කාලය පුරාම අවම වශයෙන් එක් වරක්වත් කොන්දේ වේදනාව අත්විඳිනු ඇත. කොඳු ඇට පෙළ යනු අනෙකුත් මෘදු පටක අතර අස්ථි, සන්ධි, බන්ධන සහ මාංශ පේශි වලින් සමන්විත සංකීර්ණ ව්යුහයකි. තුවාල සහ/හෝ උග්ර තත්ත්වයන්, වැනිහර්නිටීස් තැටි, අවසානයේ පිටුපස වේදනාවේ රෝග ලක්ෂණ ඇති විය හැක. ක්රීඩා තුවාල හෝ මෝටර් රථ අනතුරු තුවාල බොහෝ විට පිටුපස වේදනාව සඳහා නිතර නිතර හේතුව වේ, කෙසේ වෙතත්, සමහර විට සරලම චලනයන් වේදනාකාරී ප්රතිඵල ඇති විය හැක. වාසනාවකට මෙන්, චිරොක්ට්රැක්ටික් සත්කාර වැනි විකල්ප ප්රතිකාර විකල්පයන්, කොඳු ඇට පෙළ ගැලපීම් සහ අතින් හැසිරවීම් භාවිතයෙන් පිටුපස වේදනාව සමනය කිරීමට උපකාරී වන අතර අවසානයේ වේදනාව සහන වැඩි දියුණු කරයි. �

අමතර අමතර | වැදගත් මාතෘකාව: නිර්දේශිත El Paso, TX චිරොක්ට්රැක්ටර්
***